- •Санкт-Петербург
- •Содержание
- •Введение
- •Аннотация
- •1. Значение, общие принципы и методы технического анализа Основные понятия: технический контроль производств, технический анализ
- •Технический анализ – важнейшая составная часть технического контроля производств
- •Классификация методов технического анализа
- •Аналитический процесс Пробоотбор и пробоподготовка
- •Измерение и оценка результата Чувствительность аналитической методики
- •Случайная и систематическая погрешности
- •2. Гравиметрический (весовой анализ) Сущность гравиметрического анализа, его возможности и точность. Практическое значение метода
- •Разновидности гравиметрического анализа Форма осаждения и весовая форма
- •Требования, предъявляемые к форме осаждения и весовой форме
- •Контроль полноты осаждения
- •Образование осадков, их свойства, зависимость характера осадков от условий осаждения
- •Гравиметрическая форма.
- •Выбор осадителя; органические осадители.
- •Расчеты в гравиметрическом анализе; соотношение эквивалентности, аналитический фактор
- •Основные методы титриметрического анализа. Основные приемы титрования
- •Метод кислотно-основного титрования (нейтрализации)
- •Индикаторы в методе кислотно-основного титрования
- •Кривые титрования
- •Окислительно-восстановительное титрование (оксидиметрия), его разновидности
- •Титрование по методу осаждения. Комплексометрическое титрование
- •Выражение концентрации рабочих растворов. Расчеты в титриметрии
- •Термометрическое титрование.
- •Кондуктометрия. Кондуктометрическое титрование
- •Вольтамперометрия. Прямая полярография. Амперометрическое титрование
- •Контрольные вопросы к главе 1.3.
- •1.4. Спектральные и оптические методы анализа
- •Оптические спектры
- •Величины светопоглощения
- •Спектр поглощения
- •Выбор длины волны и светофильтра
- •Чувствительность фотоколориметрических и спектрофотометрических методов
- •Основные приемы фотометрического анализа
- •Приборы фотометрического анализа Для количественной оценки интенсивности окраски или светопоглощения применяют различные приборы:
- •Электронные спектры поглощения органических соединений
- •Типы электронных переходов
- •Инфракрасная спектроскопия
- •Устройство ик - спектрометра
- •Ядерный магнитный резонанс
- •Химический сдвиг
- •Спин-спиновое взаимодействие
- •Контрольные вопросы к теме 1.4
- •1.5. Хроматографический анализ и хромато-масс-спектрометрия хроматографические методы анализа
- •Области применения хроматографии
- •Молекулярная адсорбционная хроматография жидких веществ
- •Адсорбенты
- •Растворители
- •I. По механизму разделения
- •II. По форме проведения процесса
- •Газовая хроматография
- •Хромато-масс-спектрометрия
- •Контрольные вопросы к теме 1.5.
- •Заключение
- •Список литературы к разделу 1.1.-1.3.
- •Список литературы к разделу 1.4.-1.5.
- •Терминологический словарь к разделу 1
Типы электронных переходов
Различают молекулярные орбитали и -типа. Орбиты обоих типов могут быть связывающими и (с объединением атомов) и разрыхляющими (с разъединением атомов). Поглощение света сопровождается переходом со связывающей или орбитали на разрыхляющую (* или *). В связи с этим различают -* и -* переходы.
Не участвующие в образовании химических связей электроны неподеленных пар (например 2s2 у азота) образуют несвязывающие n-орбитали. Энергия неподеленной пары электронов в молекуле равна её энергии в изолированном атоме. Несвязываюшие n-орбитали локализованы на отдельных атомах, тогда как и - орбитали обычно распространяются на два или более атома в молекуле.
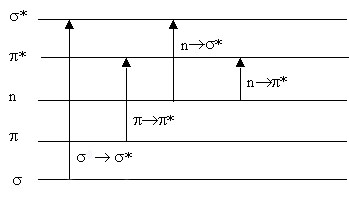
Как видно из рис. 12 уровень n несвязывающей орбитали расположен выше уровней связывающих и -орбиталей. В основном состоянии , и n орбитали обычно заняты электронами, а * и *-орбитали свободны. Поглощение света происходит в результате переходов с занятых орбиталей на свободные. Наибольшей энергии требует →* переход, характерный для насыщенных молекул и соответствующих поглощению в вакуумном УФ (<200 нм). Переходы →* происходят в молекулах с сопряженными связями и в ароматических молекулах. Они связаны с поглощением в видимой области или ближнем УФ. Переходы n→* и n→* происходят в молекулах, содержащих гетероатомы (N, O, S и т.п.).
E |
|
Рис.12 Типы электронных переходов |
|
Практическое применение в органической химии нашли электронные спектры поглощения в области от 195 до 1000 нм. Спектры поглощения в области 195-1000 нм исследуются при помощи приборов, основанных на оптическом методе разложения излучения. Эти приборы включают источник излучения, монохроматор, приемник излучения и регистрирующее устройство.
Источниками излучения служат водородная лампа и лампа накаливания. В качестве приемников излучения используются фотоэлементы или фотоумножители. Монохроматор снабжается кварцевой оптикой. В некоторых приборах кварцевая призма заменяется соответствующими дифракционными решетками. Растворы исследуемого вещества помещаются в кварцевые кюветы.
На рис. 13 приведены примеры УФ спектров ароматических соединений. Как видно приведенных спектров (рис. 13) с увеличением числа колец в ароматических соединениях максимум поглощения сдвигается в длинноволновую область.
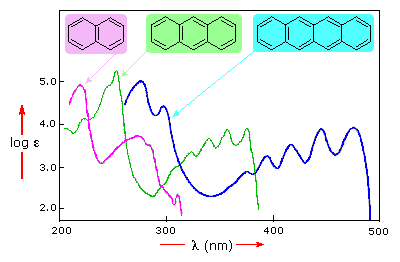
Рис. 13 – УФ спектры ароматических соединений
При получении УФ спектров в различных условиях наблюдаются следующие явления:
Батохромный сдвиг (или красный сдвиг) – в сторону длинных волн;
Гипсохромный сдвиг (или синий) – в сторону коротких волн;
Гиперхромный эффект – повышение интенсивности поглощения;
Гипохромный эффект – понижение интенсивности поглощения.
Инфракрасная спектроскопия
Одним из широко распространенных методов анализа является ИК – спектроскопия. ИК-спектроскопия является наиболее гибким и практичным методом. Это объясняется прежде всего тем, что по ИК- спектрам можно быстро проанализировать вещество в любом агрегатном состоянии. Кроме того, при помощи ИК- спектроскопии можно проанализировать микроколичество вещества.
Физическая природа ИК- спектров поглощения обусловлена переходами между двумя колебательными уровнями молекулы, находящейся в основном электронном состоянии. При рассмотрении колебаний пользуются методами классической механики. Тогда частота колебаний двухатомной молекулы дается уравнением:
![]()
где r
– силовая постоянная связи;
![]() -
приведенная масса.
-
приведенная масса.
Если в такой атомной группировке силовые постоянные связи или массы сильно отличаются от параметров остальной части молекулы, то колебания наблюдаются в узком интервале частот и проявляются в спектрах всех соединений, содержащих эту группировку. Число полос в спектре. Нелинейная молекула содержащая N атомов имеет 3N–6 основных (фундаментальных) колебаний (линейная молекула имеет 3N–5 колебаний). Образование полос поглощения в ИК- спектрах обусловлено либо в результате колебательных движений ядер в молекулах, либо в результате вращения молекул. На практике используются обычно колебательные спектры. Колебания атомов могут быть направлены вдоль валентной связи между атомами молекулы, в этом случае они называются валентными. Различают симметричные валентные колебания, в которых атомы колеблются в одинаковых направлениях, и ассиметричные валентные колебания, в которых атомы в молекулах колеблются в противоположных направлениях.
Когда колебания атомов происходит с изменением величины угла между связями, они называются деформационными. Типы колебаний приведены на рис. 14
Деформационные колебания делятся на ножничные, веерные, крутильные. Такое разделение условно, потому что при валентных колебаниях происходит частично деформация углов и наоборот. Энергия деформационных колебаний меньше, чем энергия валентных колебаний и полосы поглощения, обусловленные деформационными колебаниями, располагаются в области более длинных волн.
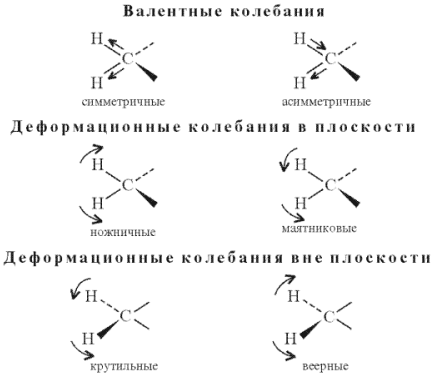
Рис. 14 - Примеры валентных и деформационных колебаний
Колебания всех атомов молекулы обуславливают полосы поглощения, индивидуальны для данного вещества. Но среди этих колебаний можно выделить колебания групп атомов, которые слабо связаны с колебаниями атомов остальной части молекулы. Полосы поглощения, обусловленные такими колебаниями называются характеристическими полосами. Они наблюдаются, как правило, в спектрах всех молекул, в которых имеются данные группы атомов, т.е. химические группы поглощают электромагнитные колебания в узком интервале частот. К таким группам относятся, например, колебания групп: CH, CH2, CH3, O–H, N–H, NH2, C=C, C=O, NO2 и др. Так, например, в спектрах всех насыщенных углеводородов наблюдаются полосы поглощения 2960 и 2870 см–1. Первая полоса обусловлена ассиметричными валентными колебаниями связи C–H в метильной группе CH3, вторая – симметричными валентными колебаниями связи C–H этой же группы.
Следует помнить, что не существует, строго говоря, чисто валентных или чисто деформационных колебаний.