
- •Санкт-Петербург
- •Содержание
- •Введение
- •Аннотация
- •1. Значение, общие принципы и методы технического анализа Основные понятия: технический контроль производств, технический анализ
- •Технический анализ – важнейшая составная часть технического контроля производств
- •Классификация методов технического анализа
- •Аналитический процесс Пробоотбор и пробоподготовка
- •Измерение и оценка результата Чувствительность аналитической методики
- •Случайная и систематическая погрешности
- •2. Гравиметрический (весовой анализ) Сущность гравиметрического анализа, его возможности и точность. Практическое значение метода
- •Разновидности гравиметрического анализа Форма осаждения и весовая форма
- •Требования, предъявляемые к форме осаждения и весовой форме
- •Контроль полноты осаждения
- •Образование осадков, их свойства, зависимость характера осадков от условий осаждения
- •Гравиметрическая форма.
- •Выбор осадителя; органические осадители.
- •Расчеты в гравиметрическом анализе; соотношение эквивалентности, аналитический фактор
- •Основные методы титриметрического анализа. Основные приемы титрования
- •Метод кислотно-основного титрования (нейтрализации)
- •Индикаторы в методе кислотно-основного титрования
- •Кривые титрования
- •Окислительно-восстановительное титрование (оксидиметрия), его разновидности
- •Титрование по методу осаждения. Комплексометрическое титрование
- •Выражение концентрации рабочих растворов. Расчеты в титриметрии
- •Термометрическое титрование.
- •Кондуктометрия. Кондуктометрическое титрование
- •Вольтамперометрия. Прямая полярография. Амперометрическое титрование
- •Контрольные вопросы к главе 1.3.
- •1.4. Спектральные и оптические методы анализа
- •Оптические спектры
- •Величины светопоглощения
- •Спектр поглощения
- •Выбор длины волны и светофильтра
- •Чувствительность фотоколориметрических и спектрофотометрических методов
- •Основные приемы фотометрического анализа
- •Приборы фотометрического анализа Для количественной оценки интенсивности окраски или светопоглощения применяют различные приборы:
- •Электронные спектры поглощения органических соединений
- •Типы электронных переходов
- •Инфракрасная спектроскопия
- •Устройство ик - спектрометра
- •Ядерный магнитный резонанс
- •Химический сдвиг
- •Спин-спиновое взаимодействие
- •Контрольные вопросы к теме 1.4
- •1.5. Хроматографический анализ и хромато-масс-спектрометрия хроматографические методы анализа
- •Области применения хроматографии
- •Молекулярная адсорбционная хроматография жидких веществ
- •Адсорбенты
- •Растворители
- •I. По механизму разделения
- •II. По форме проведения процесса
- •Газовая хроматография
- •Хромато-масс-спектрометрия
- •Контрольные вопросы к теме 1.5.
- •Заключение
- •Список литературы к разделу 1.1.-1.3.
- •Список литературы к разделу 1.4.-1.5.
- •Терминологический словарь к разделу 1
Вольтамперометрия. Прямая полярография. Амперометрическое титрование
Вольтамперометрия основана на изучении кривых зависимости силы тока от напряжения. Поляризационные кривые получают при электролизе раствора анализируемого вещества постепенно повышая напряжение и фиксируя при этом силу тока. Электролиз проводят с использованием легко поляризуемого электрода с небольшой поверхностью, на котором происходит электровосстановление или электроокисление вещества.
Электролиз на ртутном капающем электроде и вольтамперометрию, связанную с использованием ртутного капающего электрода называют полярографией.
Пусть протекает электролиз в системе ртутный капающий электрод (катод) – каломельный электрод (анод). Если в растворе нет веществ, способных восстанавливаться под действием электрического тока, то по закону Ома сила тока I равна:
![]() (31)
(31)
где Е – приложенное напряжение, R – сопротивление.
В присутствии веществ, которые восстанавливаются на ртутном электроде, при достижении потенциала восстановления ионы начнут разряжаться на ртутном катоде с образованием амальгамы.
![]() (32)
(32)
Тогда по уравнению Нерста потенциал ртутного электрода, на котором протекает обратимый процесс (32) равен:
![]() (33)
(33)
где са – концентрация амальгамы; γа – ее коэффициент активности; сМ – концентрация восстанавливающихся ионов в приэлектродном сл γМ – его коэффициент активности; αHg – активность ртути в амальгаме; Е0 – стандартный потенциал электрода.
Сила тока в цепи
зависит от скорости диффузии, которая
пропорциональна разности концентрации
в массе раствора (![]() )
и в приэлектродном слое (см),
тогда сила тока I
равна:
)
и в приэлектродном слое (см),
тогда сила тока I
равна:
![]() (34)
(34)
Постоянный ток, контролируемый диффузией называют диффузионным Id, при см=0 сила диффузионного тока равна:
![]() (35)
(35)
Связь диффузионного тока Id с концентрацией иона см передается уравнением Ильковича:
![]() (36)
(36)
где
c= 605zD1/2m2/3t1/6 (37)
c - константа уравнения Ильковича; D - коэффициент диффузии; z – заряд иона; m – масса ртути, вытекающей из капилляра; t – время образования капли.
Линейная зависимость (36) является основой количественного полярографического анализа.
Методы прямой полярографии основаны на применении уравнения полярографической волны
![]() (38)
(38)
и уравнения
Ильковича (36). Если на график нанести
![]() как функцию Е,
то полученная прямая будет пересекать
ось абсцисс в точке, где Е=Е1\2,
т.е.
как функцию Е,
то полученная прямая будет пересекать
ось абсцисс в точке, где Е=Е1\2,
т.е.
![]() .
.
Этим методом можно определить потенциал полуволны неизвестного вещества, затем по таблице потенциалов полуволны установить наиболее вероятный элемент.
Амперометрическое титрование. В процессе титрования прибавляют порцию реактива и отмечают силу тока при напряжении, соответствующем величине предельного тока. Строят кривую титрования в координатах I – V и графически находят точку эквивалентности.
Преимуществами метода перед другими объемными методами анализа являются: возможность определения вещества в присутствии других, сопутствующих веществ, определения в мутных и окрашенных растворах, устранение ошибок, связанных с применением цветных индикаторов. Определяемое вещество при амперометрическом титровании не обязательно должно быть электрохимически активным. Достаточно, чтобы на электроде могли восстанавливаться или окисляться титрант или продукт химической реакции.
Амперометрические титрования позволяют проводить определения веществ при их концентрациях 10-2 - 10-5 М.
Потенциометрия. Потенциометрическое титрование.
Растворы представляют собой однородные смеси молекул растворенного вещества и растворителя. Под действием электростатических сил, возникающих между полярными молекулами растворителя и растворенного веществ, происходит распад этих молекул на ионы, т.е. группы атомов, обладающие положительными и отрицательными зарядами. Положительные и отрицательные ионы – катионы и анионы – в растворе оказываются окруженными со всех сторон молекулами растворителя.
Этот процесс окружения ионов называется сольватацией, или, в случае воды, гидратацией ионов.
В результате одновременно идущих процессов диссоциации молекул и рекомбинации ионов устанавливается динамическое равновесие. Отношение числа распавшихся молекул к общему числу молекул растворенного вещества называется степенью диссоциации. Растворы, содержащие диссоциированные на катионы и анионы молекулы, называются электролитами.
В любом нейтральном растворе и в чистой воде концентрация ионов H+ и ОН– одинакова и равна 10–7 г-ион/л.
Образование электродного потенциала и понятие о гальванических элементах. Хорошая электрическая проводимость всех металлов объясняется наличием в них “свободных” электронов. Свободное перемещение электронов создает в металле так называемый электронный газ.
При хаотическом перемещении электроны, сталкиваясь с катионами, вновь образуют нейтральные атомы металла. Причем между этими процессами устанавливается равновесие, поэтому металл остается в целом электронейтральным. Если пластину металла погрузить в воду, то отдельные катионы, находящиеся на его поверхности, под действием притяжения со стороны полярных молекул воды вырываются из металла и переходят в воду. Вырывание катионов из решетки связано с преодолением сил притяжения между катионами и электронным газом; при этом происходит выделение энергии, а вырванные из металла катионы гидратируются молекулами воды.
Чем больше катионов переходит из металла в воду, тем больший отрицательный потенциал он принимает. Возникающее между отрицательно заряженной пластиной и перешедшими в воду катионами металла электростатическое притяжение препятствует рассеиванию последних в воде. Катионы металла концентрируются в слое воды, непосредственно прилегающем к поверхности пластины. На границе металл – вода образуется двойной электрический слой, а между металлом (электродом) и водой возникает разность потенциалов Е (скачок потенциала). При некотором значении этого потенциала дальнейшее растворение катионов металла становится невозможным, так как силы, связывающие избыточные электроны и катионы металла, становятся очень большими. Наступившее равновесие между металлом и водой является динамическим, т. е. при данном значении Е между металлом и водой идут непрерывный обмен катионами. При извлечении электрода из раствора катионы, образовавшие двойной слой, вновь входят в кристаллическую решетку металла; вода и металл становятся электронейтральными.
Если искусственно повысить концентрацию катионов металла в воде (например, добавлением в воду соли данного металла), то переход катионов металла из электрода в раствор уменьшится, а переход катионов из раствора в металл увеличится. В результате новое динамическое равновесие наступит при другим (меньшем) значении Е, а отрицательный заряд пластины по абсолютной величине будет меньшим.
Некоторые металлы (золото, платина) обладают столь прочной кристаллической решеткой, что катионы из них не могут освободиться. Поэтому они не имеют характерного скачка потенциала. Однако с помощью этих металлов также можно образовать системы, находящиеся в равновесии с растворами. В этом случае используют свойство поверхности таких металлов адсорбировать многие вещества, способные окисляться или восстанавливаться. Такие электроды называются инертными, так как электродом в подобных системах является адсорбированное вещество (например, водород, адсорбированный на платине – водородный электрод).
Некоторые малоактивные металлы (серебро, медь и пр.) при погружении в электролит заряжаются не отрицательно, а положительно, так как на пластине из раствора выделяется катионов больше, чем их переходит в раствор.
Если концентрация катионов металла в растворе, в который погружен электрод, равна 1 г-ион/л, то возникающий при этом электродный потенциал называется нормальным потенциалом и обозначается Е0. Когда концентрация катионов металла в растворе равна С, то величину Е определяют по уравнению Нернста:
![]() (39)
(39)
где R = 8,314 Дж/град.моль – универсальная газовая постоянная; Т – абсолютная температура (К); F = 96495 К/г-экв – число Фарадея; lnC = 2,303lgC; n – валентность катиона.
Рассмотрим в качестве примера элемент Даниэльса – Якоби (1836 г). В этом элементе один электрод представляет собой медную пластинку, находящуюся в растворе сульфата меди, а другой электрод – цинковую пластинку в растворе сульфата цинка. Растворы имеют между собой жидкостное соединение через солевой мостик или электролитический ключ, представляющий собой стеклянную трубку, заполненную насыщенным раствором KCl (рис. 8).
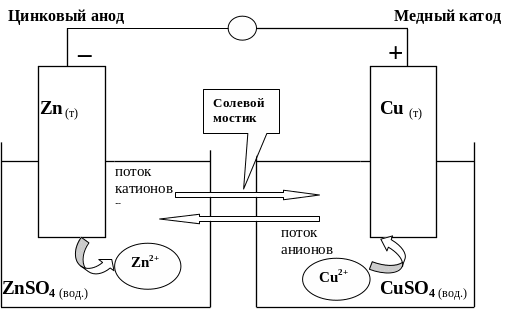
Рис.8 – Гальванический элемент Даниэльса – Якоби
Электрод в данном случае – это металлическая пластинка с окружающим ее раствором электролита. Электродная реакция на катоде – реакция восстановления, на аноде – окисления. В элементе Даниэльса – Якоби медный электрод является катодом, а цинковый электрод – анодом. Если электроды соединить металлическим проводником (внешняя цепь ВЦ), то электроды с цинковой пластины будут перемещаться на медную пластину. В результате этого перехода потенциалы обоих электродов выровняются, а разность потенциалов становится равной 0. Для того чтобы восстановить разность потенциалов и поддерживать ее постоянной, создается внутренняя (электролитическая) цепь ЭЦ в виде трубки, заполненной электролитом. За счет перемещения по ЭЦ гидратированных катионов Zn2+ из левого сосуда в правый происходит непрерывное пополнение положительно заряженных частиц, компенсирующих выделяющиеся из раствора в анодную пластину катионов Cu2+. За счет перехода из правого сосуда в левый гидратированных анионов происходит непрерывное пополнение отрицательных зарядов, компенсирующих уход электронов с катодной пластины во внешнюю цепь. В результате Zn-электрод растворяется, а на Cu-электроде происходит выделение меди:
Cu2+ + 2ē = Cu0
В окончательном виде реакция элемента записывается так:
Zn0 + Сu2+ Zn2+ + Cu0
![]()
Э.д.с. любого гальванического элемента Е равна разности скачков потенциалов полуэлементов, из которых он составлен:
Е = Е2 – Е1 (40)
где Е2 – электродный потенциал катода; Е1 – электродный потенциал анода.
Значения нормальных потенциалов берутся из справочников.
Электроды. Для составления измерительных гальванических элементов могут быть использованы разнообразные материалы и вещества.
Все электроды делятся на:
1. Измерительные, потенциал которых изменяется в зависимости от концентрации ионов в контролируемом растворе.
2. Электроды сравнения, потенциал которых от свойств контролируемого раствора не зависит.
Водородный
электрод является универсальным –
может быть использован как измерительный
и как электрод сравнения. Нормальный
потенциал водородного электрода
![]() при концентрации ионов водорода в
растворе
при концентрации ионов водорода в
растворе
![]() = 1 г-ион/л и давлении 1 атм условно принят
равным 0.
= 1 г-ион/л и давлении 1 атм условно принят
равным 0.
Несмотря на исключительное положение эталона, водородный электрод используется только для калибровки других электродов. Основной его недостаток – необходимость в процессе измерения непрерывной подачи химически чистого водорода, а также невозможность его использования в растворах, содержащих окислители и восстановители, галогены и другие вещества.
