
- •1. Основное кинетическое уравнение массопередачи. Коэффициент массопередачи и движущая сила процесса.
- •2. Движущая сила моссообменного процесса при нелинейной равновесной зависимости. Число единиц переноса и его физический смысл.
- •3. Выражение для средней движущей силы и числа единиц переноса при линейной равновесной зависимости.
- •4. Модифицированные уравнения массопередачи. Число единиц переноса. Высота эквивалентная единице переноса.
- •5. Материальный баланс массообменного процесса. Рабочая линия массообменного процесса.
- •6. Массообмен в системах без твердой фазы. Молекулярная и конвективная диффузия.
- •7. Дифференциальные уравнения молекулярной и конвективной диффузии. Числа подобия диффузионных процессов, их физический смысл.
- •8. Молекулярная диффузия. Первый закон Фика. Коэффициент диффузии и его физический смысл.
- •9. Уравнение Щукарева. Коэффициент массоотдачи и его физический смысл. Сопоставление с коэффициентом массопередачи.
- •10. Выражения коэффициента массопередачи через коэффициенты массоотдачи.
- •11. Равновесие в системах газ-жидкость. Закон Генри. Уравнение равновесной зависимости. Влияние давления и температуры на абсорбцию.
- •12. Равновесие в процессах пар-жидкость для идеальных смесей. Закон Рауля. Диаграммы t-X,y и y-X.
- •13.Принципиальная схема противоточной абсорбции и графическое изображение процесса.
- •14.Принципиальная схема абсорбции с рециркуляцией жидкости и графическое изображение процесса.
- •15. Схема ректификационной установки непрерывного действия. Материальный баланс ректификационной колонны. Флегмовое число.
- •16.Уравнение рабочих линий процесса ректификации для непрерывно действующей ректификационной колонны. Минимальное и оптимальное флегмовое число.
- •17.Изображение рабочих линий ректификации в диаграмме y-X.
- •18.Влияние флегмового числа на размеры ректификационной колонны и расход тепла при ректификации. Оптимальное флегмовое число.
- •19.Схема периодически действующей ректификационной установки. Рабочие линии процессов с переменным и постоянным флегмовым числом.
- •20.Схема периодически действующей ректификационной установки. Изображение процесса в y-X диаграмме при постоянном составе дистиллята.
- •21.Тепловой баланс процесса ректификации.
- •22.Построение кинетической кривой и определение реального числа тарелок.
- •23. Порядок расчета ректификационной тарельчатой колонны.
- •27.Непрерывная противоточная экстракция .Материальный баланс.Графическое изображение процесса.
- •28. Ступенчатая противоточная экстракция. Принципиальная схема. Графическое изображение процесса.
- •29. Многократная экстракция с противотоком растворителя.
- •30. Массопередача в системах с твердой фазой. Массопроводность. Дифференциальные уравнения массопроводности.
- •Процесс сушки. Технические способы проведения процесса. Виды связи влаги с материалом.
- •32.Основные способы сушки. Материальный баланс конвективной сушки.
- •33.Диаграмма состояния влажного воздух (диаграмма Рамзина).
- •34.Изображение в диаграмме н-х процессов изменения параметров влажного воздуха: температура точки росы, охлаждение, нагревание, смешение.
- •36. Тепловой баланс воздушной сушки. Уравнение рабочей линии процесса сушки.
- •37. Параметры, влияющие на процесс сушки. Способы интенсификации сушки.
- •38. Сушка с многократным промежуточным подогревом воздуха. Принципиальная схема. Изображение в н-х диаграмме.
- •39. Сушка с частичным возвратом отобранного воздуха. Принципиальная схема. Изображение в н-х диаграмме.
- •40. Сушка с замкнутой циркуляцией сушильного агента. Принципиальная схема. Изображение в н-х диаграмме.
- •41. Процесс адсорбции. Динамическая и статическая активность адсорбентов. Условия, влияющие на проведение процесса адсорбции.
- •42. Физическая сущность процесса адсорбции. Адсорбенты. Условия, способствующие протеканию процесса адсорбции.
- •43. Ионообменные процессы – основные закономерности, область применения. Регенерация ионитов.
- •44. Кристаллизация. Основные способы проведения кристаллизация. Равновесие в процессах кристаллизации.
- •45. Мембранные процессы. Классификация мембранных процессов в зависимости от их механизма. Область применения.
- •46. Влияние различных параметров на селективность и проницаемость мембран.
- •47. Материальный и тепловой баланс изогидрической кристаллизации
- •48. Материальный и тепловой баланс кристаллизации с удалением части растворителя (это изотермическая кристаллизация).
42. Физическая сущность процесса адсорбции. Адсорбенты. Условия, способствующие протеканию процесса адсорбции.
Адсорбция – поглощение газов или паров из газовых смесей или растворенных веществ из растворов твердыми поглотителями, называемыми адсорбентами. Особенность процессов адсорбции – избирательность и обратимость. Благодаря этой особенности процесса возможно поглощение из парогазовых смесей или растворов одного или нескольких компонентов, а затем, в др. условиях, десорбирование их, т. е. выделение нужного компонента из твердой фазы в более или менее чистом виде. Г(П), Ж → Тв. Адсорбция используется для выделения бензола из парогазовых смесей, разделения смесей газообразных углеводородов, сушки воздуха, очистки жидких нефтепродуктов от растворенных в них примесей.
Виды адсорбции: 1) физическая – молекулы присоединяются к пористой пов-ти; 2) хемосорбция; 3) ионообменные процессы.
Условия, способствующие протеканию процесса адсорбции:
1) природа извлекаемого компонента и поглощаемого вещества. При прочих равных условиях, лучше извлекается тот компонент, у которого больше молекулярный вес. Чем меньшей растворимостью обладает компонент, тем лучше он извлекается.
Зависимость Ленгмюра: выражает равновесные соотношения при адсорбции.
х=А1*b1c/(1+ b1c) –для растворенных веществ [c]=[кг/м3] х=А2*b2р/(1+ b2р) –для газов и паров [х]= [кг погл в-ва/кг адсорбента]=[а], а=А3*b3y/(1+ b3y).
х – равновесная концентрация поглощенного адсорбентом вещества; р – равновесное давление поглощаемого вещества в паровой смеси; y – равновесная концентрация поглощаемого вещества в парогазовой смеси или растворе.
2) температура. Чем ниже температура, тем процесс протекает более интенсивно. С повышением температуры при прочих равных условиях равновесная концентрация уменьшается.
3) давление. Повышение давления улучшает адсорбцию. С ростом давления в парогазовой фазе равновесная концентрация х увеличивается. Изотермы адсорбции:
4) примеси в фазе, из которой поглощается вещество. Адсорбция ухудшается с появлением примесей. В этом случае примеси (также способные поглощаться адсорбентом) либо частично, либо полностью вытесняют или замещают поглощаемый компонент в адсорбенте.
Адсорбенты: испоьзуют материалы, обладающие очень высокой пористостью, а следовательно, большой удельной поверхностью. 1) БАУ-большой активированный уголь, КАУ-костяной активированный уголь; 2) силикагель SiO2*nH2O; 3) алюмогель Al2O3*nH2O; 4) синтетические цеолиты (молекулярные сита)с тонкими порами, сечение которых соизмеримо с размерами молекул.
Материал, который не вошел в эти вопросы:
Сопротивление в адсорбенте незначительно
Основное сопротивление адсорбции находится в жидкой или газовой фазе
М=Ку Δуср F М= Ву Δуср F
Ку ≈ βу βу -> Nuсреды
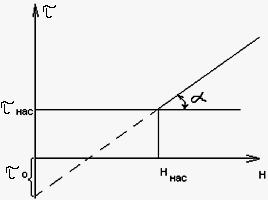
τ –τнас = tgα (H-Hнас)
tg α=Δτ/ΔH=K –коэф-т поглотит. действия
τ=КН-(К Hнас- τнас)
τ=КН- τо–уравнение Шилова
Материальный баланс адсорбции
Процесс адсорбции может осуществляться непрерывно и периодически.
1) непрерывная адсорбция
G(-Dy)=LDa , a-активность
G(yH-yK)=L(aK-aH)
2)Периодическая адсорбция
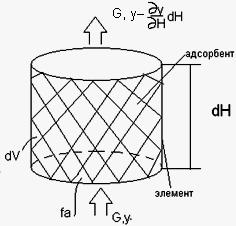
dV=dVпор +dVтв
dV=ε dV+(1- ε) dV
τ:
dM τпоры=у dVпор=у ε dV
dM τтв=а dVТВ=а (1- ε) dV
dM τ= dM τпоры + dM τтв
τ+d τ:
dM τ+d τ поры =(y+δy/δ τ*d τ) εdV
dM τ+d τ тв =(a+δa/δ τ*d τ)(1- ε )dV
dM τ+d τ= dM τ+d τ поры+ dM τ+d τ ТВ
dM = dM τ+d τ- dM τ= δy/δ τ*d τ* εdV+ δa/δ τ*d τ(1- ε )dV
dM τ=G*y *δ τ
dM τ+d τ=G*(y-δy/δ H*dH) δ τ
dM= dM τ+d τ+dM τ
dM=- G* (δy/δ H)* dH* δ τ
- G*(δy/δ H)* dH* δ τ= (δy/δ τ)*d τ* εdV+ (δa/δ τ)*d τ(1- ε )dV | w*fa/G
Материальный баланс для периодической адсорбции:
- δy/δ H*w = δy/δ τ*ε+ (δa/δ τ)* (1- ε )
