
- •Оптичні методи аналізу
- •1.1. Фотометричний метод аналізу 1.1.1. Основні закони і формули
- •1.2. Емісійний спектральний аналіз і полум'яна емісійна спектроскопія 1.2.1. Емісійний спектральний аналіз. Основні закони і формули
- •1.2.2. Полум'яна емісійна спектроскопія. Основні закони і формули
- •1.2.3. Розв’язання типових задач з теми «Емісійний спектральний аналіз і полум'яна емісійна спектроскопія»
- •1.2.4. Контрольні питання по темі «Емісійний спектральний аналіз і полум'яна емісійна спектроскопія»
- •1.3. Атомно-абсорбційний аналіз 1.3.1. Основні закони і формули
- •5. Люмінесцентний аналіз 1.5.1. Основні закони і формули
- •2.1.3.Контрольні питання по темі «Потенціометричний аналіз»
- •2.2. Кондуктометричний метод аналізу 2.2.1. Основні закони і формули
- •2.2.2. Рішення типових задач з теми «Кондуктометричний аналіз»
- •2.2.3. Контрольні питання по темі «Кондуктометричний аналіз»
- •2.3. Кулонометричний метод аналізу
- •2.3.1. Основні закони і формули
- •2.3.2. Рішення типових задач по темі "Кулонометричний аналіз"
- •2.3.3. Контрольні питання з теми «Кулонометричний аналіз»
- •2.4. Вольтамперометричний метод аналізу
- •2.4.1. Основні закони и формули
2.3.2. Рішення типових задач по темі "Кулонометричний аналіз"
Задача 1. На повне відновлення цинку в кулонометрии знадобилося 26 хв при силі струму100 мА. Визначити зміст (г) і концентрацію (моль / л) цинку в розчині, якщо на кулонометричний аналіз було взято 10 мл розчину.
Рішення: Розраховуємо вміст (г) цинку за формулою:
m = (I t / 96500) . M / n; mZn2+ = (0,1 . 26 . 60 / 96500) . 65,38 / 2 = 0,05285 г в 10 мл розчину, тоді в 1 л буде міститися 5,285 г/л або сZn2+ = m / М = 5,285 / 65,38 = 0,0808 моль/л.
Відповідь: mZn2+ =0,05285 г; сZn2+ = 0,0808 моль/л.
Задача 2. На кулонометрическое титрування 10 мл розчину Na2S2O3 йодом, що генеруються в кулонометричній комірці, знадобилося 22 хв при силі струму 300мА. Визначити кількість витраченої електрики і молярну концентрацію еквівалента розчину Na2S2O3.
Рішення: Розраховуємо кількість електрики: Q = 0,3 . 22 . 60 = 396 Кл и масу (г) Na2S2O3 = 158 . 396 / (2. 96500) = 0,3242 г в 10 мл розчину, а в 1 л буде міститься 32,42 г/л.
Э(Na2S2O3) = 79; С = m / Э; С(Na2S2O3) = 32,42 / 79 = 0,4104 моль-екв/л.
Відповідь: Q= 396 Кл; С(Na2S2O3) = 0,4104 моль-екв/л.
2.3.3. Контрольні питання з теми «Кулонометричний аналіз»
1. Який метод кількісного аналізу називається кулонометрією? 2. Які закони лежать в основі кулонометрії? 3. У чому відмінність методів прямої кулонометрії і кулонометричного титрування? 4. Наведіть принципову схему установки для кулонометричного титрування. 5. За яким законом змінюється сила струму в ході прямого кулонометричного визначення? Наведіть приклади прямих кулонометричних визначень. 6. Назвіть найбільш поширені способи фіксування точки еквівалентності в кулонометричному титруванні. 7. Вкажіть переваги і недоліки кулонометричних методів аналізу.
2.4. Вольтамперометричний метод аналізу
2.4.1. Основні закони и формули
Методи аналізу, засновані на розшифровці поляризаційних кривих (вольтамперограм), одержуваних у електролітичній комірці з поляризуючим індикаторним електродом і неполяризуючим електродом порівняння, називають вольтамперометричними.Вольтамперограма дозволяє одночасно отримати якісну і кількісну інформацію про речовини, що відновлюються або окислюються на мікроелектроди (деполяризаторах), а також про характер електродного процесу. Як поляризуючого мікроелектрода часто застосовують ртутний краплинний електрод, а сам метод називають у цьому випадку полярографією, дотримуючись терміну, який запропонував Я. Гейровський, який розробив цей метод у 1922 р. При невеликому потенціалі катода сила струму спочатку повільно збільшується із зростанням потенціалу - це так званий залишковий струм, його значення має порядок 10-7 А. По досягненні потенціалу відновлення на катоді починається розряд іонів, що визначається дифузією, і сила струму різко зростає, а потім стає постійною - це граничний дифузійний струм. Принципова схема полярографічної установки: аналізований розчин 1 знаходиться в електролізері 2, на дні якого є шар ртуті 3, що є анодом. Катодом служить ртутний краплинний електрод 4, з'єднаний з резервауром ртуті 5. Через електролізер протікає струм, напругу якого, що подається на електроди, можна плавно змінювати за допомогою реохорда або дільника напруги 7 і вимірювати при цьому гальванометром 6 силу струму, що проходить через розчин.
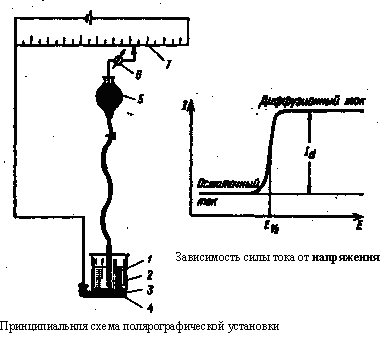
Залежність струму I від прикладеної напруги Е при оборотному електродномупроцесі передається рівнянням полярографической хвилі:
Е = Е1/2 + (R T / n F) ln ( Id – I ) / I, (1)
Де Е1/2 - потенціал напівхвилі; Id - дифузний струм. При I = Id / 2 рівняння (1) переходить в
Е = Е1/2 . (2)
Це співвідношення показує незалежність потенціалу напівхвилі від струму і, отже, від концентрації відновлюючого іона. Потенціал напівхвилі є, таким чином, якісною характеристикою іона в розчині даного електроліту, і визначення потенціалу напівхвилі складає основу якісного полярографічного аналізу.
Кількісний полярографічний аналіз грунтується на рівнянні Ільковича, яке пов’язує дифузійний струм Id з концентрацією іона с і рядом інших величин:
Id = 605 z D1/2 m 2/3 t1/6 c (3)
Де z - заряд іона; D – коефіцієнт дифузиії; m – маса ртуті, що витікає з капіляру за 1 с, мг; t – час утворення каплі (периоду капання), с.
У практиці кількісного полярографічного аналізу коефіцієнт пропорційності між концентрацією речовини і силою дифузійного струму звичайно встановлюють за допомогою стандартних розчинів. При постійних умовах полярографії D,m, і t постійні, тому рівняння (3) переходить в
Id = k c . (4)
