
- •Алканы.
- •Окисление:
- •Качественная реакция:
- •Крекинг (термическое разложение):
- •|Циклоалканы (циклопарафины).
- •Физические свойства:
- •Химические свойства:
- •Применение и нахождение в природе:
- •Реакции присоединения:
- •Алкадиены.
- •Реакции присоединения:
- •Каучуки
- •Реакции присоединения:
- •Природный и попутный нефтяной газы
- •Физические свойства:
- •Строение
- •Химические свойства
- •Получение:
- •Применение:
- •Биологическое действие
- •Одноатомные спирты.
- •Вопросы для закрепления знаний по данной теме:
Природный и попутный нефтяной газы
Природный газ – это смесь, которая состоит из: 88-95% метана (СН4), 3-8% этана (С2Н6), 0,7-2% пропана (С3Н8), 0,2-0,7% бутана (С4Н10), 0,03-0,5% пентана (С5Н12), углекислого газа (СО2), азота (N2), гелия (He). Существует закономерность: чем выше относительная молекулярная масса углеводорода, тем меньше его содержится в природном газе. Применение:
топливо в промышленности и в быту, т.к. СН4 + 2О2 = СО2 + 2Н2О + 890 КДЖ
получение галогенпроизводных углеводородов и хлороводорода:
CH4 + Cl2 → CH3Cl + HCl, CH3Cl - хлорметан – растворитель, сырье для кремнийорганических соединений; HCl – получение соляной кислоты
получение непредельных углеводородов: 2 СН4 → С2Н2 + 3Н2, (С2Н2 – ацетилен – этин - сварка и резка металлов); С2Н6 → С2Н4 + Н2 (С2Н4 – этилен – этен - получение полиэтилена, этанола, уксусной кислоты)
получение водорода и сажи: СН4 → С + 2Н2, (С – сажа → резины и типографских красителей, Н2 →аммиака NH3)
получение кислородсодержащих органических соединений:
СН3 ─ (СН2)2 ─ СН3 → 2СН3СООН + Н2О, СН3СООН - уксусная кислота, получение красителей, медикаментов….
Попутный нефтяной газ находиться над залежами нефти или растворен в ней под давлением.
Содержит углеводороды, которые для рационального применения делят на смеси:
газовый бензин (пентана (С5Н12) и гексан (С6Н14)) добавляют к бензину для улучшения работы двигателя;
пропан - бутановая (пропана (С3Н8) и бутана (С4Н10)) в сжиженном виде как топливо;
с
 ухой
газ (по
составу сходен с природным) для получения
С2Н2
– ацетилен, Н2
и
других веществ, как топливо: СН4
+ Н2О
↔ 3Н2
+ СО ; СО + Н2
↔ СН3ОН,
СН3ОН
- метанол
ухой
газ (по
составу сходен с природным) для получения
С2Н2
– ацетилен, Н2
и
других веществ, как топливо: СН4
+ Н2О
↔ 3Н2
+ СО ; СО + Н2
↔ СН3ОН,
СН3ОН
- метанол
О синтез газ
СН4 + О2 → Н2О + HC , HCHО – метаналь, муравьиный альдегид.
H
Арены
Арены, ароматические углеводороды – органические соединения, молекулы которых содержат устойчивые циклические структуры – бензольные ядра, с особым характером связей. Общая формула: CnH2n-6, где n ≥ 6.
Физические свойства:
 C6H6
-
бензол
– жидкость, без цвета, запах характерный,
Tкип=80°С,
Tпл=5,5°С,
не растворим в Н2О,
плотность
= 0,879 г/см³, молярная масса =78,11г/моль,
хороший растворитель, ядовит.
Открыт
М.Фарадеем в светильном газе в 1825 г.
C6H6
-
бензол
– жидкость, без цвета, запах характерный,
Tкип=80°С,
Tпл=5,5°С,
не растворим в Н2О,
плотность
= 0,879 г/см³, молярная масса =78,11г/моль,
хороший растворитель, ядовит.
Открыт
М.Фарадеем в светильном газе в 1825 г.
Строение
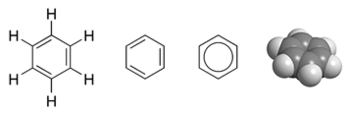
Молекула плоская, атомы углерода объединены в правильный шестиугольник, находятся в состоянии sp2 – гибридизации, валентный угол = 120°; длина (С ≡ С) = 0,140 нм. Шесть неспаренных негибридных р -электронов образуют единую π-электронную систему (ароматическое ядро), которое располагается перпендикулярно к плоскости бензольного кольца, перекрываясь друг с другом сверху и снизу этой плоскости.
Химические свойства
Сходство с предельными углеводородами.
Качественные реакции. Устойчивость к действию обычных окислителей: не обесцвечивают растворы бромной воды (Br2 aq) (при обычных условиях), и перманганата калия (KMnO4).
Реакции замещения:
А ) Галогенирование, взаимодействие с галогенами (при нагревании и в присутствии катализаторов): С6H6 + Cl2 FeCl3 С6H5Cl + HCl, хлорбензол
С 6H6 + Br2 FeBr3 или AlCl3 С6H5Br + HBr, бромбензол
Б) Нитрование, взаимодействие с концентрированной азотной кислотой (при нагревании и в присутствии концентрированной серной кислоты):
С6H6 + HNO3 H2SO4 С6H5NO2 + H2O, нитробензол
В) Алкилирование, взаимодействие с галогенпроизводными (при нагревании и в присутствии катализаторов) (реакция Фриделя-Крафтса):
С 6H6 + С2H5Cl AlCl3 С6H5С2H5 + HCl, этилбензол
Сходство с непредельными углеводородами. Реакции присоединения:
Г идрирование, присоединение водорода (при нагревании и в присутствии катализаторов): С6H6 + 3H2 tkat С6H12, циклогексан
Галогенирование, присоединение галогенов (на свету и в присутствии катализатора):
С 6H6 + 3Cl2 освещение C6H6Cl6,гексахлорциклогексана, гексохлоран
В отличие от непредельных углеводородов не взаимодействуют с H2O, галогенводородами, р-ром KMnO4.
