
- •Алканы.
- •Окисление:
- •Качественная реакция:
- •Крекинг (термическое разложение):
- •|Циклоалканы (циклопарафины).
- •Физические свойства:
- •Химические свойства:
- •Применение и нахождение в природе:
- •Реакции присоединения:
- •Алкадиены.
- •Реакции присоединения:
- •Каучуки
- •Реакции присоединения:
- •Природный и попутный нефтяной газы
- •Физические свойства:
- •Строение
- •Химические свойства
- •Получение:
- •Применение:
- •Биологическое действие
- •Одноатомные спирты.
- •Вопросы для закрепления знаний по данной теме:
Каучуки
Каучуки – эластомеры – высокомолекулярные вещества, сохраняющие свою эластичность в широком интервале температур. Легко изменяют форму при внешнем воздействии, после окончания воздействия принимают исходную.
Натуральный каучук – природный высокомолекулярный, непредельный углеводород (С5Н8)n, n – степень полимеризации = 1000-3000. Получается из млечного сока дерева гевеи, который на воздухе, на свету(hυ) превращается в (─СН2─С=СН─СН2─)n – полиизопрен.
СН3
Важнейшие свойства: эластичность, износоустойчивость, водо- и газонепроницаемость, хороший изолятор, растворяется в органических растворителях.
Недостатки: при высоких t° - размягчается, а при низких t° - хрупкий.
Синтетический каучук впервые был получен в 1932 г. в г. Ярославле С.В.Лебедевым.
СКД (синтетический каучук дивиниловый) бутадиеновый - (С4Н6)n
 С4Н10(бутан)
→ С4Н8(бутен)
→ С4Н6(бутадиен-1,3)
→ СКД;
С4Н10(бутан)
→ С4Н8(бутен)
→ С4Н6(бутадиен-1,3)
→ СКД;
С2Н5ОН
n
СН2=СН─СН=СН2
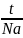 (─СН2─СН=СН─СН2─)n
(─СН2─СН=СН─СН2─)n
Свойства: водо- и газонепроницаемость, уступает по эластичности и износоустойчивости натуральному.
СКИ (синтетический каучук изопреновый) стереорегулярное строение (цис-изомер)


 СН2
H
СН2
H
n
СН2=С─СН=СН2
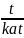 С=С
С=С
CH3 ─ СН2 СН2─ n
Пентан(C5H12) → изопентан(C5H12) → изопрен (C5H8) → СКИ
Природный каучук имеет тот же состав, что и СКИ.
Вулканизация: каучук нагревают с серой с образованием резины, которая обладает большей эластичностью, прочностью, устойчива к действию t° и растворителей. В результате происходит поперечное сшивание молекул полимера между собой дисульфидными мостиками(-Sx-, где х от1 до4) с образованием пространственной сетки. Если серы много, то образуется эбонит(отличный изолятор).
Алкины
Алкины, ацетиленовые углеводороды – это непредельные углеводороды, в молекулах которых между атомами углерода имеется одна тройная связь.
Общая формула: CnH2n-2
C2H2 - ацетилен, этин – газ, без цвета, без запаха, растворим в Н2О
Строение
σ Атомам углерода, образующим тройную связь, в молеку-
Н С π С Н лах алкинов характерна: sp – гибридизация; валентный
π угол = 180°; длина (С ≡ С) = 0,120 нм; имеет линейное строение.
Химические свойства и применение
Окисление – горение: 2C2H2 + 5О2 → 4СО2 + 2Н2О + Q
t° до 3000°С поэтому используется при автогенная сварка и резка металлов;
Качественные реакции: а) обесцвечивание бромной воды (Br2aq):
C2H2 + Br2aq → CHBr = CHBr, 1,2 – дибромэтен – растворитель;
б) раствора перманганата калия (KMnO4 - [О]):
C2H2 + [О] + Н2О → НООC ─ CООН, щавелевая кислота.
Реакции присоединения:
Г идрирование: НС ≡ СН + Н2 katt Н2С=СН2, этен, полиэтилен
Галогенирование: C2H2 + 2Cl2 → CHCl2 ─ CHCl2, 1,1,2,2–тетрахлорэтан-растворитель, получение других производных;
Гидрогалогенирование (галогеноводородов):
C 2H2 + НCl → CH2 = CHCl, хлорэтен (хлорвинил) – производство полихлорвинила – кожзаменителя и т.п.; O
Г идратация: C2H2 + Н2О
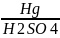 CH3
─ C
, уксусный альдегид (этаналь) –в
производстве уксусной кислоты, лаков,
лекарств; H
CH3
─ C
, уксусный альдегид (этаналь) –в
производстве уксусной кислоты, лаков,
лекарств; HТ римеризация (для ацетилена): 3C2H2
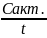 C6H6,
бензол;
C6H6,
бензол;З амещение: НС ≡ СН + Ag2O аммиачный р-р AgС ≡ СAg↓ + Н2О, после высушивания – ВВ.
Получение
Д егидрирование алканов: Н3С − СН3 НС ≡ СН + 2Н2
Из природного газа – метана: 2СН4 → С2Н2 + 3Н2
Карбидный способ: CaC2 + 2Н2О → Ca(OH)2 + НС ≡ СН
Из дигалогенпроизводных – дегидрогалогенирование:
C lCH2− CH2Cl + 2KOH спиртовой р-р НС ≡ СН + 2KCl + 2Н2О
