
- •1.Понятие метода и методики анализа. Характеристики методики.
- •2.Физ. Основы рефрактометрического метода. Коэффициент преломления.
- •3. Дисперсия показателя преломления. Зависимость показателей преломления от температуры, давления. Мольная рефракция.
- •4. Принцип действия рефрактометра Аббе.
- •5. Принцип действия рефрактометра Пульфриха.
- •6. Рефрактометр автоматический непрерывный.
- •7. Применение рефрактометрии для идентификации в-ва и контроля качества.
- •8. Физ. Основы поляриметрического метода.
- •9. Типы оптической активности.
- •10. Зависимость угла вращения плоскости поляризации от строения в-ва
- •11. Спекрополяриметрический метод.
- •12. Принцип действия кругового поляриметра. Схема прибора.
- •13. Устройство клиновых поляриметров.
- •14. Применение поляриметрии и спектрополяриметрии.
- •15. Физ. Основы нефелометрии и турбидиметрии. Рассеяние и поглощение света.
- •16. Основные требования к химическим реакциям и условия их проведения.
- •17. Приборы нефелометрического анализа.
- •18. Приборы турбидиметрического анализа.
- •19. Применение нефелометрии и турбидиметрии.
- •20. Основные характеристики электромагнитного излучения. Классификация методов спектрального анализа.
- •21.Физ. Основы спектрального анализа.
- •22. Схемы энергетических переходов в атомах.
- •23. Схемы энергетических переходов в молекулах.
- •24. Способы атомизации вещества и возбуждения атомов в атомно-эмиссионной спектроскопии.
- •25. Условия и механизм атомизации и возбуждения в-ва в пламенной атомно-эмиссионной спектроскопии.
- •26. Условия и механизм атомизации и возбуждения в-ва в дуговой и искровой атомно-эмиссионной спектроскопии.
- •27. Условия и механизм атомизации и возбуждения в-ва в атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой.
- •28. Вид и основные характеристики спектров атомной эмиссии. Зависимость вида спектра от природы элемента и способа его возбуждения.
- •29. Блок-схема и функции основных узлов атомно-эмиссионного спектрометра. Основные характеристики атомно-эмиссионных спектрометров.
- •30. Устройство и принцип действия трехтрубчатого плазмотрона для атомно-эмиссионного анализа с индуктивно-связанной плазмой.
- •31. Способы выделения аналитических спектральных линий элементов из полихроматического излучения анализируемого образца. Схема и принцип действия монохроматора дисперсионного типа.
- •32. Типы детекторов атомно-эмиссионных спектрометров. Принцип их действия.
- •33. Достоинства и недостатки фотографической регистрации спектров атомной эмиссии.
- •34. Структура таблиц характеристических спектров элементов и атласов спектров.
- •35. Основы качественного атомно-эмиссионного анализа. Определение длин волн характеристических спектральных линий элементов.
- •36. Качественная идентификация спектральных линий в спектрах атомной эмиссии.
- •37. Определение интенсивности спектральной линии элемента при фотографической регистрации спектра.
- •38. Полуколичественный метод сравнения в атомно-эмиссионном анализе.
- •39. Полуколичественный метод гомологических пар в атомно-эмиссионном анализе.
- •40. Полуколичественный метод появления и усиления спектральных линий в атомно-эмиссионном анализе. Уравнение Ломакина-Шейбе.
- •41.Методы точного количественного атомно-эмиссионного анализа с использованием стандартов.
- •42. Метод добавок в количественном атомно-эмиссионном анализе.
- •43. Основы, преимущества и недостатки количественного атомно-эмиссионного анализа с использованием фотоэлектрического детектирования.
- •44. Аналитические характеристики и применение атомно-эмиссионной спектроскопии.
- •45. Физические основы рентгеноспектрального анализа.
- •46. Тормозное и характеристическое рентгеновское излучение.
- •47. Схема возбуждения и испускания рентгеновских спектральных линий. Критический край поглощения.
- •48. Система обозначения характеристических рентгеновских спектральных линий. Серии рентгеновских спектральных линий.
- •49. Методы возбуждения рентгеновских спектров. Принцип действия рентгеновской трубки.
- •50. Диспергирующие и детектирующие устройства рентгеновских спектрометров.
- •51. Основы качественного и количественного рентгеноспектрального анализа.
- •52. Схема проведения, достоинства и недостатки рентгено-эмиссионного анализа.
- •53. Схема проведения, достоинства и недостатки рентгено-флуоресцентного анализа.
- •54. Схема проведения, достоинства и недостатки рентгено-абсорбционного анализа.
- •56.Хромофорные и ауксохромные группы. Гисохромный и битохромный сдвиг. Гипо- и гипехромный эффекты.
- •57.Вид и основные характеристики молекулярных спектров поглощения уф- и видимого диапазона.
- •58.Приборы для проведения фото- и спектрофотометрического анализа. Оптическая схема фотоэлектроколориметра.
- •59.Основные положения количественного фотометрического анализа.
- •60.Типы отклонений закона светопоглощения от линейности и их причины.
- •61.Метод Фирордта.
- •62.Метод Аллена.
- •63.Аналитические применения фотометрии.
- •64.Физические основы ик-спектроскопии. Типы колебаний в молекулах. Зависимость положения спектральной полосы поглощения от типа колебаний, вида атомов и др. Особенностей строения молекул.
- •65 Скелетные колебания и колебания характеристических групп.
- •66.Типичный вид ик - спектра сложного органического вещества. Основные характеристики ик - спектров.
- •67.Подготовка образцов в ик - спектроскопии.
- •68.Особенности конструкции ик - спектрометров.
- •69 Порядок идентификации веществ по их ик- спектрам.
- •70.Использование ик-спектроскопии для определения молекулярной структуры неизвестного вещества.
- •71.Использование ик-спектроскопии для количественного анализа и анализа смеси веществ.
- •72.Физические основы люминесцентного метода. Виды люминесценции и способы ее возбуждения.
- •73. Флуоресценция и фосфоресценция.
- •74.Схема возбуждения и эмиссии люминесцентного излучения.
- •75. Взаимосвязь спектров поглощения и люминесценции. Правило Стокса, закон Стокса-Ломмеля.
- •76. Квантовый и энергетический выход люминесценции. Закон Вавилова.
- •77 Вид спектров люминесценции и их основные характеристики.
- •78. Зависимость интенсивности люминесценции от конц. Люминесцируемого вещества, температуры, рН, примесей.
- •79. Гашение флуоресценции
- •80.Прямой флуоресцентный анализ.
- •81. Косвенный флуоресцентный анализ.
- •82Аппаратура и практическое применение люминесцентного анализа.
- •83 Схема и принцип действия фотометра люминесцентного.
54. Схема проведения, достоинства и недостатки рентгено-абсорбционного анализа.
Анализ по спектрам поглощения рентгеновского излучения.


1 2 3 4 5
Анализируемая проба 2 в виде плоскопараллельной пластинки устанавливается на пути потока рентгеновского излучения от источника 1(рентгеновская трубка или радиоактивный источник) с непрерывным или линейчатым спектром, кванты которого имеют большую энергию, чем энергия краёв поглощения элементов, определяемых в пробе.
Излучение, прошедшее через образец, разлагается в спектр анализатором 3. Из разложенного в спектр излучения выбираются аналитические линии определяемого элемента, которые попадают на приемник излучения 4 и далее регистрируется электрической схемой 5.
Для определения концентрации каждого элемента интенсивность их спектральных линий измеряется дважды: до введения пробы в поток излучения источника и с пробой. Затем определяется оптическая плотность, по которой при соответствующей калибровке прибора (по эталонам) определяется искомая концентрация.
Этап атомизации пробы отсутствует.
 55.
Физические основы молекулярной
спектроскопии поглощения УФ- и видимого
диапазона.
55.
Физические основы молекулярной
спектроскопии поглощения УФ- и видимого
диапазона.
Метод является методом молекулярной абсорбционной спектроскопии, в основе которой лежит изменение электронно-колебательно-вращательного состояния вещества.
При пропускании через вещество, находящееся в молекулярном состоянии, э/м излучения УФ- и видимого диапазона, часть этого излучения может поглощаться в-вом. Хар-р этого поглощения отличается от поглощения света атомизированным в-вом. Атомы каждого элемента способны поглощать излучение с длинами волн, имеющими определенное значение. Спектр ат. абсорбции и ат. имиссии имеет вид узких спектральных линий. Это связано с тем, что для атомов каждого элемента имеются свои строго определенные дискретные значения энергии валентных электронов в осн. состоянии и в состояниях возбуждения, в к-рые эти электроны переходят при поглощении излучения.
При образовании молекул из атомов внешние атомные орбитали перестраиваются, изменяются их энергетические уровни, образуются молекулярные орбитали. При этом считается для упрощения, что внутренние электроны атомов и внешние электроны, не участвующие в образовании связей, сохраняют ту же энергию, что и в индивидуальном атоме.
В зависимости от того, какие атомы участвуют в образовании молекулы, могут образовываться молекулярные орбитали σ- и π-типа.
σ-связи имеют цилиндрическую симметрию электронной плотности относительно линии, соединяющей центры атомов.
π-связи, симметричные относительно плоскости, проходящей через линию, соединяющую центры атомов.
П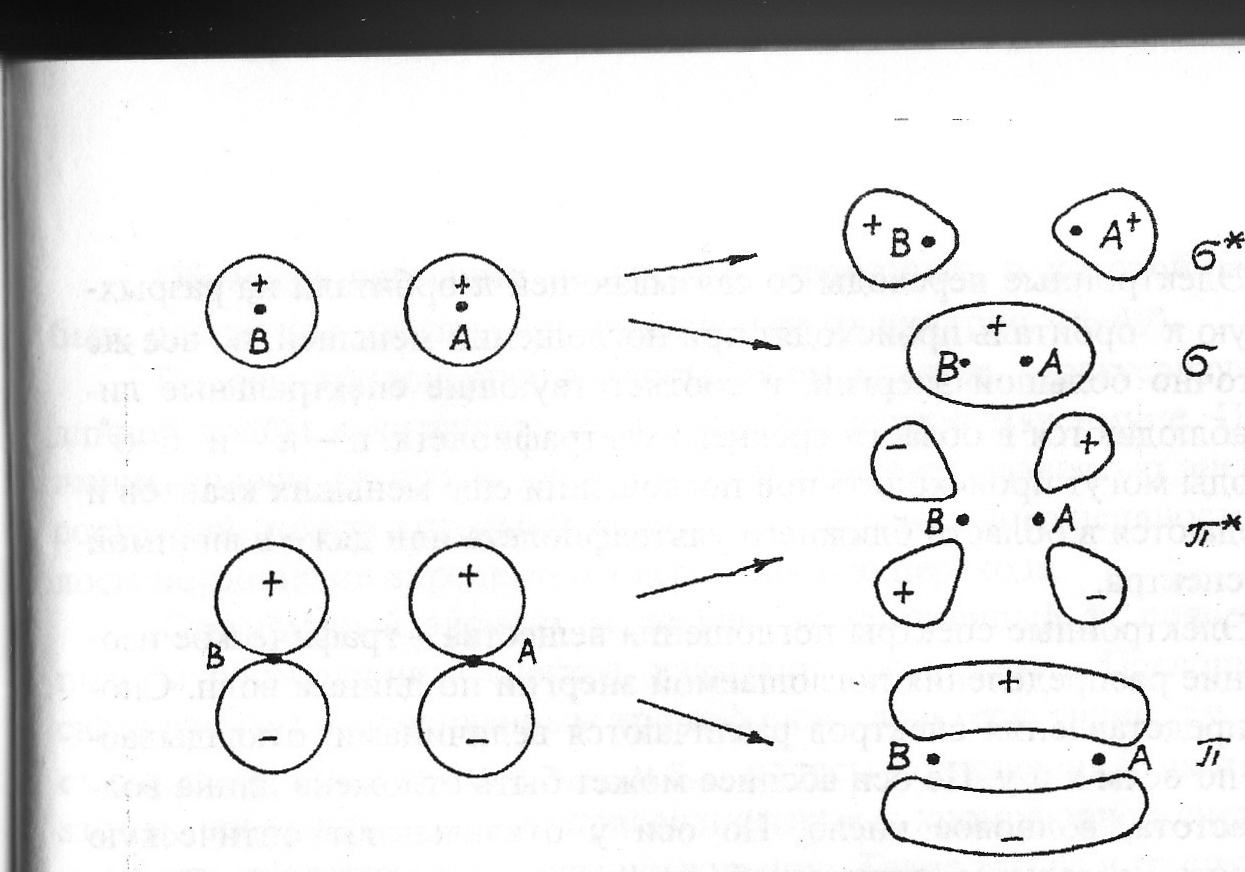 ри
отсутствии внешнего воздействия максимум
электронной плотности в σ- и π-связях
находится между ядрами, стягивая их.
Такие орбитали называются связывающими.
Орбитали,
не принимающие участия в образовании
связей n-электронами,
называются несвязывающими
n-орбиталями.
ри
отсутствии внешнего воздействия максимум
электронной плотности в σ- и π-связях
находится между ядрами, стягивая их.
Такие орбитали называются связывающими.
Орбитали,
не принимающие участия в образовании
связей n-электронами,
называются несвязывающими
n-орбиталями.
При некоторых условиях конфигурация молекулярных орбиталей может измениться - максимум электронной плотности сместится к наружной стороне ядер, увеличивая отталкивание между ними. Образуются т. н. разрыхляющие орбитали.
При поглощении э/м излучения УФ- и видимого диапазона могут происходить электронные переходы со связывающих σ- и π-орбиталей и несвязывающих n-орбиталей на разрыхляющие орбитали.
Относительные энергии молекулярных орбиталей разных типов:
Из этой диаграммы видно, что наибольшую разность энергий имеют σ- и σ*-орбитали. Вследствие этого σ-σ* переход может произойти при поглощении веществом излучения с относительно высокой (в пределах рассматриваемого диапазона)
энергией и, соответственно, в спектре поглощения полоса поглощения будет наблюдаться в коротковолновой области (дальний УФ).
Электронные переходы со связывающей π-орбитали на разрыхляющую π*-орбиталь происходят при поглощении меньшей, но все же достаточно большой энергии, и соответствующие спектральные линии наблюдаются в области среднего ультрафиолета (200-250нм). Переходы n-σ* могут происходить при поглощении еще меньших квантов и наблюдаются в области ближнего ультрафиолета (250-360нм), а переходы n-π* -- даже в видимой части спектра.
Можно посмотреть 57 и 58 вопросы.
