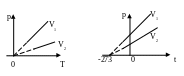- •I. Механическое движение.
- •II. Силы природы.
- •I II. Законы сохранения в механических процессах.
- •1V. Механические колебания.
- •V.Тепловые процессы.
- •2.Законы идеального газа.
- •3. Термодинамика.
- •VI. Электрические явления.
- •V11. Постоянный электрический ток.
- •VIII.Электромагнитные явления.
- •Iх. Геометрическая оптика (используется понятие луча).
2.Законы идеального газа.
Процесс
|
Постоянный параметр |
Формула закона |
Г |
|
|
Закон Дальтона : p = p1 + p2 + …+ pN У |
возрастает |
Изотер- мический |
T=const m=const
|
Закон
Бойля-Мариотта:
pV=const; p1V1
= p2V2=const.
|
T1, T2 – изотермы.
|
Изобарный (изобари - ческий)
|
P=const m=const |
Закон Гей-Люссака:
V
= V0(1
+ αt);α–температурный
коэффициент объёмного расширения. V
= V0αT;
|
p1,
p2-изобары
p2 >
p1
возрастает
возрастает |
Изохорный (изохори - ческий) |
V = const m = const
|
Закон Шарля: p = p0(1+γt); γ-термический коэффициент давления. p = p0γT.
|
V1, V2
– изохоры V2
> V1 |
3. Термодинамика.
a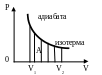 ).
Внутренняя
энергия газа.
U = (Wk1
+ Wn1)·N.
Внутренняя энергия идеального
газа:
).
Внутренняя
энергия газа.
U = (Wk1
+ Wn1)·N.
Внутренняя энергия идеального
газа:
![]() i-число
степеней свободы.
i-число
степеней свободы.
Д ля
одноатомного идеального газа i
= 3; для 2-х-атомного i
=5; для 3-х и более атомов i
=6.
ля
одноатомного идеального газа i
= 3; для 2-х-атомного i
=5; для 3-х и более атомов i
=6.
Закон сохранения энергии. ∆ U = Aвн + Q; Aвн – работа внешних сил, Q – количество теплоты.
А вн = - А; А - работа газа. При p = const, А = p ∆V = p (V2 – V1) = νR∆T . Если V = const, A = 0.
Если Т
= const,
∆U
= 0, Q
=A.
![]() .
В осях p(V)
работа равна площади фигуры (для всех
процессов).
.
В осях p(V)
работа равна площади фигуры (для всех
процессов).
Первый закон термодинамики: Q = ∆U + A . Eсли Q = 0 – система теплоизолированная, происходит
адиабатный процесс; A = - ∆U (внутренняя энергия газа уменьшается) , Aвн = ∆U. График – адиабата, в осях P(V) идет круче изотермы.
В замкнутой системе A = 0, Q = 0, ∆U = 0, U = const-теплообмен внутри системы. ∆U = ∆U1 +∆U2+···+∆UN = 0; ∆U1 = Q1 и так далее.
Q1+Q2+·∙∙+QN = 0 – уравнение теплового баланса. Q = cm(T2-T1) –нагревание, охлаждение; c-удельная теплоёмкость вещества;
cm = C- теплоёмкость тела. В газах “c” зависит от процесса, ср>сv; cp = cv + R / M.
Q = ± λm, + плавление, –– кристаллизация. Q = ± rm; + парообразование, - конденсация. Q = qm – сгорание топлива.
Второй закон термодинамики – направление тепловых процессов.
Тепловые
двигатели. К.П.Д. тепловых двигателей
![]()
![]()
![]() T1-температура
нагревателя, T2-холодильника.
T1-температура
нагревателя, T2-холодильника.

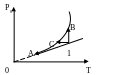 б).
Испарение,
кипение, влажность, насыщенный пар
– понятия. Р0-давление
насыщенного пара, не зависит от V,
а только Р0(T).
б).
Испарение,
кипение, влажность, насыщенный пар
– понятия. Р0-давление
насыщенного пара, не зависит от V,
а только Р0(T).
К ривизна
– за счёт испарения (p=nkT).
Переход ненасыщенного пара в насыщенный:
ривизна
– за счёт испарения (p=nkT).
Переход ненасыщенного пара в насыщенный:
1→А –изохорное охлаждение; 1→В – изотермическое сжатие;
1→С- изобарное охлаждение. Р (или ρ) – парциальное давление (или плотность) пара
в воздухе - абсолютная влажность, определяется по таблице по Тросы.
Р0 (или ρ0) – определяется по температуре воздуха.
Относительная
влажность
![]() %
или
%
или
![]() %
.
%
.
Кипение. р0=рвнешнее+ρgh; т.к. р0=nkT, то nkT=pвн+ρgh; Tкип.(рвн.).
в) Поверхностное
натяжение.
Fпов.
- сила поверхностного натяжения,
направлена вдоль поверхности жидкости,
перпендикулярно линии, ограничивающей
её поверхность: Fпов
= σl.
Коэффициент поверхностного натяжения
![]() .
Зависит от природы граничащих сред и Т
(с увеличением Т, σ уменьшается).
.
Зависит от природы граничащих сред и Т
(с увеличением Т, σ уменьшается).
Понятия: смачивание,
несмачивание, капиллярность.
![]() ;
ρ - плотность жидкости, r-
радиус капилляра, h – высота подъёма
(опускания ) жидкости в капилляре.
Поверхностная
энергия жидкости Еn
= σS.
;
ρ - плотность жидкости, r-
радиус капилляра, h – высота подъёма
(опускания ) жидкости в капилляре.
Поверхностная
энергия жидкости Еn
= σS.

 рафики
рафики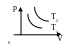 равнение
Менделеева-Клапейрона
равнение
Менделеева-Клапейрона