- •Кондуктометрія Питома та еквівалентна електропровідність розчинів
- •Константа кондуктометричної чарунки
- •Вплив концентрації електроліту на електропровідність
- •Поляризаційні явища в кондуктометрії. Поляризаційний опір rs
- •Пряма кондуктометрія
- •Селективна кондуктометрія
- •Апаратура кондуктометричного аналізу Вимірювання електропровідності розчину
- •Будова типових кондуктометричних чарунок
Пряма кондуктометрія
Концентрацію електроліту можна визначити за електропровідністю розчину за певних умов (переважно якщо за цих умов існує прямолінійна залежність між цими величинами). Метод широко використовують для визначення концентрації індивідуальних електролітів у розчині. Можливе також визначення електролітів у сумішах за умови, що вміст домішок у суміші залишається постійним.
Метод прямої кондуктометрії дає змогу вирішити безліч практичних задач і часто впроваджується в автоматичний неперервний контроль на різноманітних виробництвах. Широко використовують метод визначення концентрації розчинів солей за допомогою спеціальних приладів – солемірів. Кондуктометрію використовують для процесу контролю очистки води і, зокрема, для контролю якості дистильованої води, оцінки забруднення стічних вод, при визначенні загального вмісту солей у мінеральній, морській та річній воді. За допомогою методу прямої кондуктометрії здійснюють контроль операцій промивання осадів та регенерації іонітів. При використанні екстракції дистильованою водою визначають чистоту малорозчинних осадів або органічних препаратів. Кондуктометрична характеристика деяких матеріалів наведено на рис.5.2.
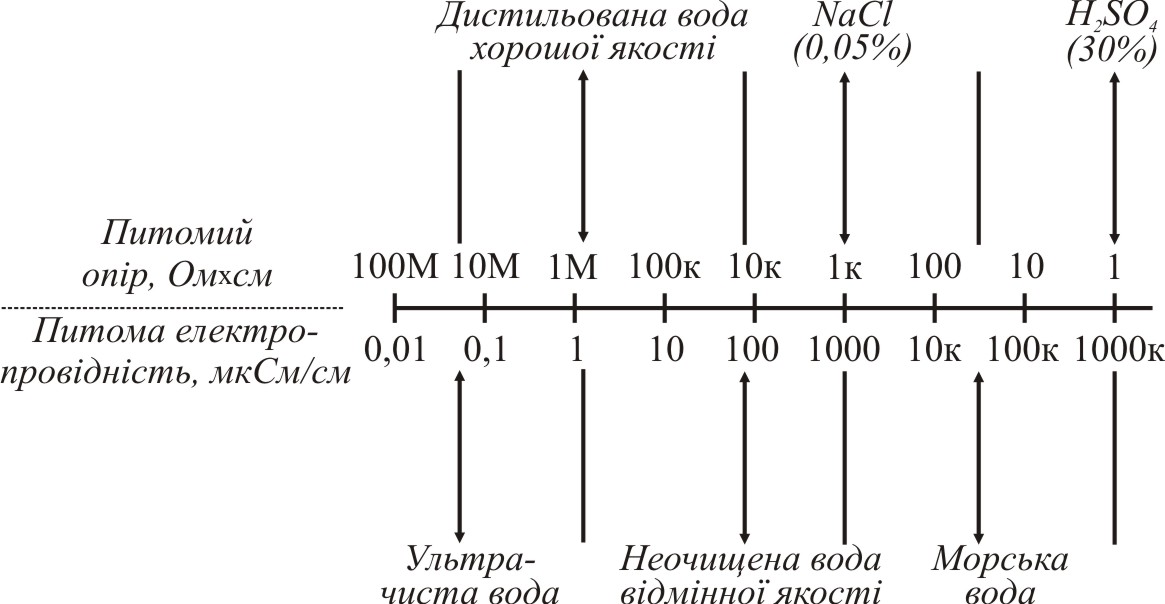
Рис. 5.2 Питомий опір та питома електропровідність деяких матеріалів.
Селективна кондуктометрія
Селективна кондуктометрія – це своєрідна комбінація методів прямої та непрямої кондуктометрії. У цьому методі визначають електропровідність досліджуваного розчину, який містить іон, що осаджується тим чи іншим реагентом. Наприклад, аналізований розчин містить SO42-- іони, які осаджують Ba2+- іонами. При додаванні до аналізованого розчину певного надлишку реагенту Ba(NO3)2 електропровідність розчину змінюється, і ця зміна залежатиме від концентрації у розчині визначуваного іона. Чим вища концентрація осаджуваного іона, тим меншим буде збільшення електропровідності після додавання реагенту.
Для виконання аналізу готують модельний розчин, який містить усі іони, що містяться в досліджуваному розчині, визначають його електропровідність l0, додають до нього певний об’єм реагенту і знову визначають його електропровідність lд. Потім здійснюють усі ці операції щодо досліджуваного розчину та одержують значення l0’ та lд’. З одержаних даних маємо рівняння:
|
(l0 -lд) – (l0’-lд’) = КС, |
(8) |
де С – концентрація осаджуваного іона. |
||
Зрозуміло, що в значення електропровідності розчинів необхідно вносити поправки на розведення розчину внаслідок додавання реагенту. Побудувавши калібрувальний графік за даними рівняння (8), можна порівняно просто визначити концентрацію осаджуваного іона. Метод характеризується вищою селективністю порівняно з методом прямої кондуктометрії і з методами непрямої кондуктометрії.
Апаратура кондуктометричного аналізу Вимірювання електропровідності розчину
Електропровідність розчину електроліту можна визначити, якщо виміряти активний опір між зануреними у нього електродами. Для вимірювання опору використовують змінний струм, оскільки постійний струм спричинює поляризацію електродів і процеси електролізу.
|
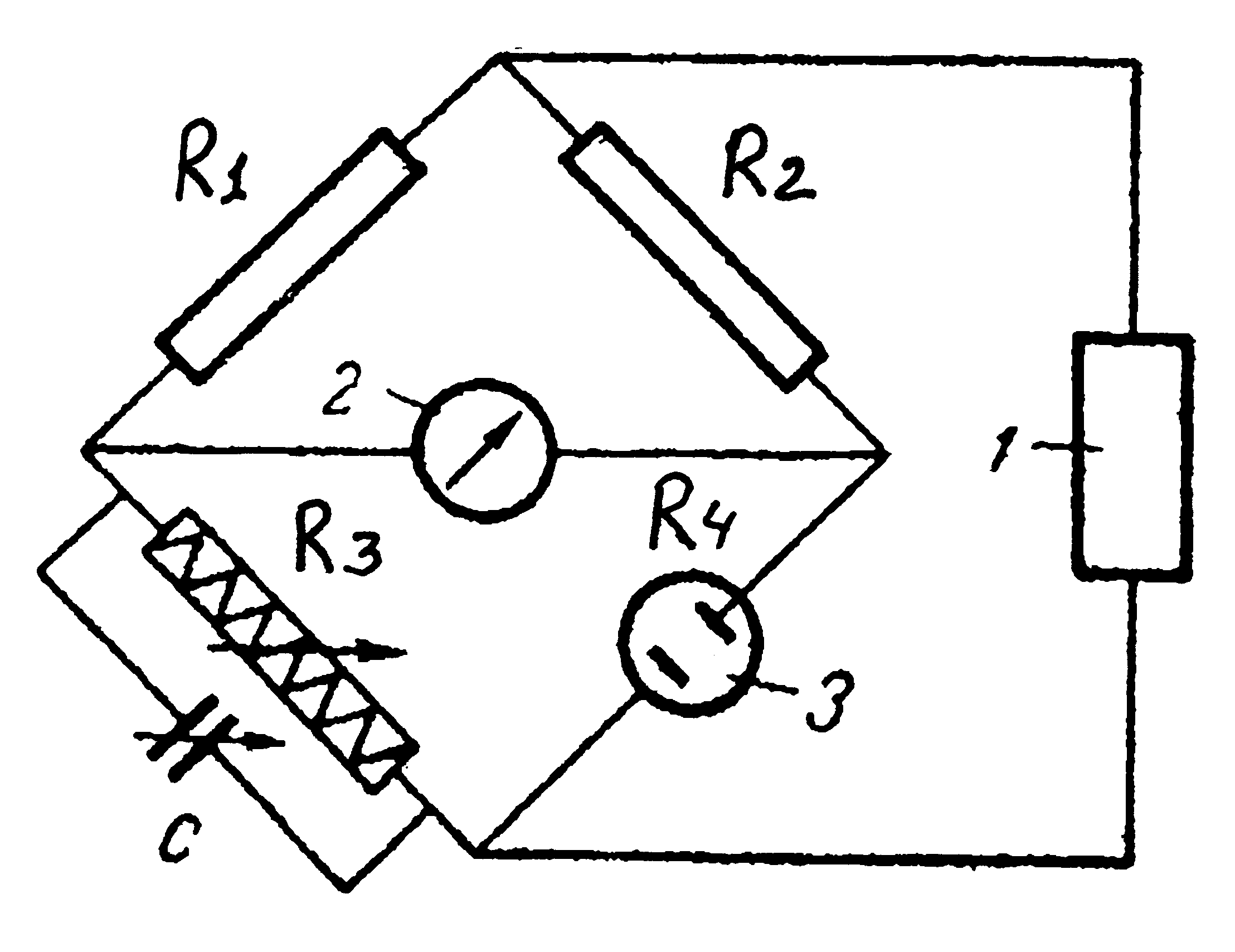
Рис. 5.34. Місток Уітсона: R1, R2, R3, R4 – плечі містка; С – змінна ємність; 1 – звуковий генератор; 2 – індикатор нуля; 3 – електролітична чарунка |
Опір розчину електроліту визначають шляхом порівняння з еталонним опором. Для цього використовують місток Уітсона (рис. 5.34). Опори R1, R2, R3 та R4 можна підібрати так, щоб струм по діагоналі містка був відсутнім, тобто опір його гілок був пропорційним один одному. Отже, вимірюваний опір R4 можна знайти за формулою:
|
|
(9) |
Опори R1 та R2 вибирають постійними (або зберігають постійним їхнє співвідношення), а R3 може змінюватись. Отож при регулюванні містка підбирають опір R3 та визначають опір R4.
|
|
|
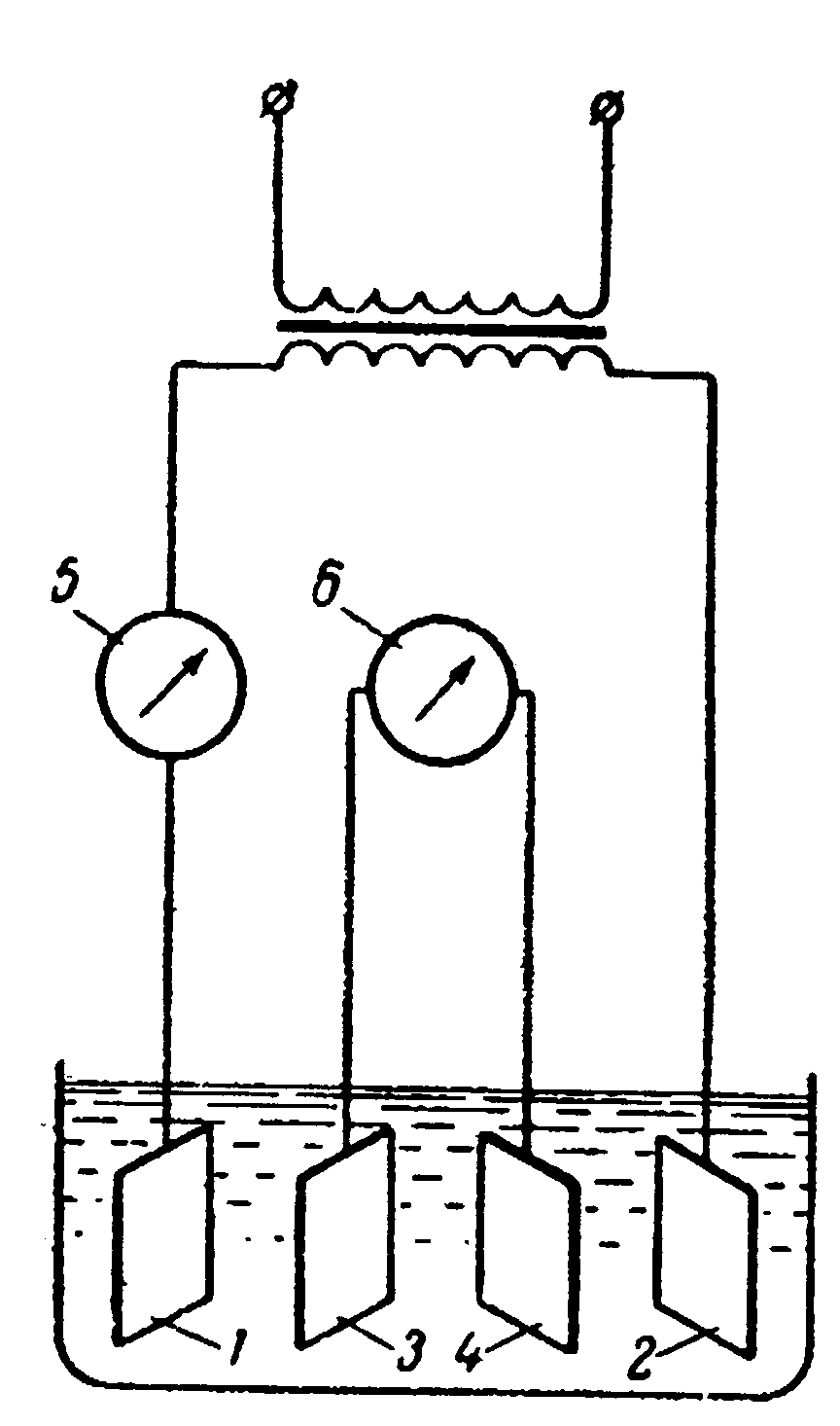
Рис. 5.35. Установка для кондуктометричного титрування у чотириелектродній чарунці: 1, 2 – зовнішні електроди; 3, 4 – внутрішні електроди; 5 – міліамперметр; 6 – мілівольтметр |
||
|
||
Рис. 5.36. Електрична еквівалентна схема чарунки: R – істинний опір розчину; Сг – геометрична ємність чарунки; СПЕШ – ємність подвійного електричного шару; СS та RS – ємність та опір поляризації; С1 та R1 – шунтуючі ємність та опір, які залежать від конструкції чарунки; С2 – ємність проводів |
||
Проте у містку змінного струму силу струму по діагоналі не можна звести до нуля, оскільки до активного опору додається ємнісний опір електролізера та електрохімічного ланцюга.
Нуль-інструментом слугують гальванометри (змінного чи постійного струму), осцилографи. Замість останніх (при автоматизації процесу) часто використовують променеві трубки моніторів при залученні комп’ютерної техніки для кондуктометричного аналізу.
Для визначення електропровідності розчину застосовують також потенціометричний метод детектування. З цією метою використовують чотириелектродну чарунку (рис. 5.35). На зовнішні електроди 1 і 2 подають змінний струм постійної сили, який вимірюють міліамперметром 5. Спад потенціалу на внутрішніх електродах 3 та 4 вимірюють мілівольтметром 6, за показами якого визначають зміну електропровідності розчину.
В електричну еквівалентну схему електролізера (рис. 5.36), окрім істинного активного опору розчину R, який залежить від концентрації іонів та їхньої еквівалентної електропровідності, входять додатково активні та реактивні опори, що виникають в електролізері при зміні опору. Електролізер, який містить електроліт і занурені у нього електроди, можна розглядати як конденсатор з електродною поверхнею S, електродною відстанню l та діелектричною проникністю розчину e. Ємнісний опір Cг (геометричний), який виникає між двома паралельними електродами, шунтує істинне значення опору електроліту у водних розчинах, та, зазвичай, є значно більшим від істинного опору розчину, отож не спричинює похибки вимірювання електропровідності. Проте, якщо істинний опір електроліту є дуже великим, ці величини можуть бути співмірними. Похибку, яка може виникнути внаслідок цього, можна зменшити шляхом зменшення частоти струму та збільшення константи електролізера.
На межі електрод/розчин електроліту виникає подвійний електричний шар. Ємність подвійного електричного шару впливає на зсув фаз між струмом і напругою та може спричинити до похибки вимірювання істинного опору розчину.
Похибки вимірювання можуть також залежать від електрохімічних процесів на електродах (відновленням або окисненням іонів на електродах), що спричинює зміну концентрації іонів поблизу поверхні електрода. Внаслідок повільної дифузії іонів до електрода спостерігається концентраційна поляризація, утворюються поляризаційна ємність СS і поляризаційний опір RS. Похибки, спричинені з поляризаційними явищами, зменшуються зі збільшенням частоти струму та збільшенням концентрації електроліту. Якщо частота струму сягає понад 1000 Гц, то вплив поляризації є незначним.
Похибки в кондуктометричному методі також можуть виникати внаслідок невдалої конструкції чарунки (близьке розташування проводів, які відходять від електрода; невдале розташування електродів щодо проводів; вплив ємності проводів тощо). Отже, чарунки для кондуктометричного титрування повинні відповідати певним вимогам:
мати оптимальні геометричні розміри міжелектродного простору;
поляризаційні явища на електродах повинні бути мінімізовані;
втрата струму за рахунок виникнення додаткових ємнісних зв’язків повинна бути мінімальною.
Ємнісним впливом не можна цілковито знехтувати, проте його можна компенсувати шляхом паралельного підключення конденсатора С (рис. 5.34) до плеча містка Уітсона R3. Внаслідок цього компенсаційне регулювання містка здійснюватиметься і за опором (R3) і за ємністю (С). Цілком усунути похибку вимірювання, яка може з’явитися при виникненні поляризаційного опору, на жаль не вдається. Цю помилку можна зменшити за рахунок використання платинованих електродів, оскільки зі збільшенням поверхні електрода зменшується густина струму.
Зазначимо, що за достатньо великої площі електродів помітної зміни концентрації поблизу них не спостерігається, отож опором на електродах можна знехтувати. Оскільки площа поверхні електрода S велика, а відстань між обкладками молекулярного конденсатора l мала (порядка радіуса іона), то зі співвідношень С ~ S/l та RC = 1/(wC) (С – ємність, w – частота змінного струму) випливає, що С – значна величина, а RC – мала. Отож можна знехтувати і ємностями на електродах.