
- •Биоорганическая химия как наука: определение, задачи, методы исследования. Значение в системе высшего медицинского образования.
- •Классификация органических веществ по строению углеродной цепи и природе функциональных групп.
- •Строение важнейших классов органических соединений: углеводородов, спиртов, тиоспиртов, фенолов, альдегидов, кетонов, карбоновых кислот, простых и сложных эфиров, аминов, амидов, нитросоединений.
- •Номенклатура органических соединений: тривиальная, рациональная, международная. Принципы образования названий органических соединений по номенклатуре июпак.
- •Природа химических связей в органических соединениях: электронное строение соединений углерода, гибридизация орбиталей.
- •Пространственное строение органических соединений. Конфигурация и конформация. Стереоизомеры: геометрические, оптические
- •Типы реакций в биоорганической химии: sr, se, sn, ae, an, e. Примеры
- •Углеводороды. Строение, химические свойства.
- •Спирты. Тиоспирты. Фенолы. Строение, химические свойства. Применение в медицине.
- •Применение спиртов в медицине
- •Карбонильные соединения в биоорганической химии. Строение, химические свойства, медикобиологическое значение альдегидов и кетонов.
- •Карбоновые кислоты в биоорганической химии. Строение, химические свойства. Функциональные производные карбоновых кислот: ангидриды, амиды, сложные эфиры. Реакции декарбоксилирования.
- •Строение и свойства дикарбоновых кислот.
- •Гирокси-, оксо-, фенолокислоты. Строение, свойства. Биологическая роль, применение в медицине.
- •Амины. Строение, свойства. Биологическое значение биогенных аминов (адреналина, триптамина, серотонина, гистамина) и полиаминов (путресцина, кадаверина).
- •Аминоспирты. Строение, свойства. Биологическое значение этаноламина (коламина), холина, ацетилхолина, сфингозина
- •Углеводы. Определение, классификация. Биологическая роль.
- •Моносахариды: триозы, тетрозы, пентозы, гексозы. Строение, открытые и циклические формы. Оптическая изомерия. Химические свойства глюкозы, фруктозы. Качественные реакции на глюкозу.
- •Олигосахариды: строение, свойства. Дисахариды: мальтоза, лактоза, целлобиоза, сахароза. Биологическая роль.
- •Гомополисахариды: крахмал, гликоген, целлюлоза, декстрины. Строение, свойства. Биологическая роль. Качественная реакция на крахмал.
- •Гетерополисахариды. Строение и биологическая роль гиалуроновой кислоты, хондроитинсульфатов, гепарина.
- •Липиды. Определение, классификация. Простые липиды. Строение, свойства, биологическая роль.
- •Функция теплоизоляции
- •Структурная функция
- •Регуляторная
- •Защитная (амортизационная)
- •Сложные липиды. Фосфолипиды. Сфинголипиды. Гликолипиды. Строение, биологическая роль.
- •Неомыляемые липиды. Холестерин. Строение, биороль. Стероидные гормоны
- •Гетероциклические соединения. Классификация, строение, медикобиологическое значение.
- •Нуклеозиды, нуклеотиды. Азотистые основания пиримидинового и пуринового ряда. Лактим-лактамная таутомерия.
- •Нуклеиновые кислоты: днк и рнк. Строение, биороль.
- •Аминокислоты. Классификация, строение, стереоизомерия, химические свойства. Реакции декарбоксилирования, дезаминирования, трансаминирования, поликонденсации. Биологическая роль α-аминокислот.
- •По радикалу
- •По функциональным группам
- •По классам аминоацил-тРнк-синтетаз По путям биосинтеза По способности организма синтезировать из предшественников
- •Пептиды. Белки. Определение, классификация, свойства. Цветные реакции.
- •Классификация по типу строения
- •Уровни организации белков: первичная, вторичная, третичная и четвертичная структуры. Виды химических связей. Уровни организации
- •Первичная структура
- •Вторичная структура
- •Третичная структура
- •Четвертичная структура
- •Витамины. Общая характеристика, биологическая роль. Строение и свойства витаминов а1, в1, в2, в6, рр, с.
Типы реакций в биоорганической химии: sr, se, sn, ae, an, e. Примеры
В настоящее время приняты три типа классификаций химических реакций.
1. По направлению реакции.
Этот тип делится на две большие группы. К первой группе относят реакции, протекающие без изменения структуры углеродного скелета (порядок соединения атомов углерода в молекуле продукта реакции аналогичен порядку соединения атомов углерода в исходном веществе). Ко
второй группе относят реакции, протекающие с изменением структуры углеродного скелета (порядок соединения атомов углерода в продукте реакции отличается от порядка соединения атомов углерода в исходном веществе). Первую группу реакций (I) составляют реакции замещения (S), присоединения (А), элиминирования или отщепления (Е), некоторые реакции перегруппировки и изомеризации. Вторую группу реакций (II) составляют реакции удлинения углеродной цепи, укорочения углеродной цепи, некоторые реакции изомеризации и перегруппировки, циклизации, раскрытия цикла, сжатия и расширения цикла и некоторые другие.
2. По характеру атакующих частиц – реагентов (по типу разрыва связей).
Бывают гомолитическими (или радикальными) и гетеролитическими (или полярными), которые рассмотрим ниже.
В реакциях принято различать атакуемое вещество – субстрат и атакующее вещество (или частицу) – реагент. В зависимости от характера реагента различают реакции нуклеофильные, радикальные и электрофильные. Часто эту классификацию сочетают с классификацией по направлению реакции, что обычно и используют в органической химии. Тогда говорят о реакциях радикального присоединения (AR), электрофильного присоединения (AE), нуклеофильного присоединения (AN), радикального замещения (SR), нуклеофильного замещения (SN), электрофильного замещения (SE), где A,S,E – тип реакции, а индексы R,N,E – тип атакующей частицы (реагента)
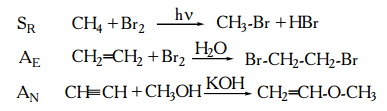
3. По молекулярности реакции.
«Молекулярность» реакции указывает на число молекул, в которых происходит изменение ковалентных связей в стадии, определяющей (лимитирующей) суммарную скорость реакции – самой медленной стадии реакции. Если в стадии, лимитирующей скорость реакции, участвует одна молекула, то реакцию считают мономолекулярной, если две – то бимолекулярной. Полимолекулярные реакции встречаются очень редко.
Углеводороды. Строение, химические свойства.
Углеводоро́ды — органические соединения, состоящие исключительно из атомов углерода и водорода. Углеводороды считаются базовыми соединениями органической химии, все остальные органические соединения рассматривают как их производные.
Углеводороды, как правило, не смешиваются с водой, поскольку атомы углерода и водорода имеют близкую электроотрицательность, и связи в углеводородах малополярны. Для предельных углеводородов характерны химические реакции замещения, а для непредельных — присоединения.
Ациклические (с открытой цепью) |
Карбоциклические (с замкнутой цепью) |
||||||
предельные |
непредельные |
предельные |
непредельные |
||||
с одинарной связью |
с двойной связью |
с тройной связью |
с двумя двойными связями |
с одинарной связью |
с бензольным кольцом |
||
ряд метана(алканы) |
ряд этилена(алкены) |
ряд ацетилена(алкины) |
ряд диеновых углеводородов |
ряд полиметиленов (нафтены) |
ряд бензола (ароматические углеводороды, или арены) |
||
