
- •Походження культури
- •Ботанічна характеристика сімейства бобові
- •Систематика виду
- •Ботанічна характеристика Церцису європейського
- •1.2. Хімічний склад листя т Церцису європейського
- •1.3. Фармакотерапевтичні властивості Церцису європейського
- •1.4. Народногосподарське значення Церцису європейського
- •2.1. Якісне дослідження біологічно активних сполук церцису європейського
- •2.1.2. Вільні органічні кислоти
- •Органічні кислоті листя церцису європейського
- •Виявлення речовин глікозидної природи
- •2.1.6. Фенольні сполуки
- •2.1.6.2. Кумарини
- •2.1.6.3. Флавоноїди
- •2.1.6.4. Дубильні речовини
- •2.1.7. Сапоніни
- •2.1.8. Загальне вивчення біологічно активних сполук Cercis siliquastrum
- •2.3. Визначення числових показників церцису європейського
- •2.3.1. Визначення вологості
- •Вміст вологи в листі церцису європейського
- •2.3.2. Визначення загальної золи
- •Результати зважувань (листя)
- •Вміст загальної золи в листі церцису європейського
- •2.4. Кількісне дослідження біологічно активних сполук церцису європейського
- •2.4.4. Кількісне визначення гідроксикоричних кислот
- •Вміст суми гідроксикоричних кислот в листі Cercis siliquastrum
- •2.4.1.Кількісне визначення суми фенольніх сполук
- •Вміст фенольних сполук у листі Cercis siliquastrum
- •2.4.5. Кількісне визначення флавоноїдів
- •Вміст суми флавоноїдів в листі Cercis siliquastrum
- •2.4.2. Кількісне визначення дубильних речовин методом перманганатометрії
- •Вміст дубильних речовин у листі Cercis siliquastrum
- •2.4.6. Макроелементний та мікроелементний склад листя церцису європейського
- •Елементний склад листя та квіток Albizzia julibrissin
Вміст суми гідроксикоричних кислот в листі Cercis siliquastrum
M |
|
Xi |
Хср |
S2 |
Scp |
P |
t(P, ) |
Довірчий інтервал |
ε_, % |
|||
1 |
2 |
|
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|||
5 |
4 |
3,95 |
3,95 |
0,000500 |
0,01 |
0,90 |
2,13 |
3,95 |
± |
0,02 |
0,54 |
|
3,92 |
||||||||||||
3,96 |
||||||||||||
3,98 |
||||||||||||
3,94 |
||||||||||||
Вміст суми гідроксикоричних кислот в листі церцису європейського складає 3,95%.
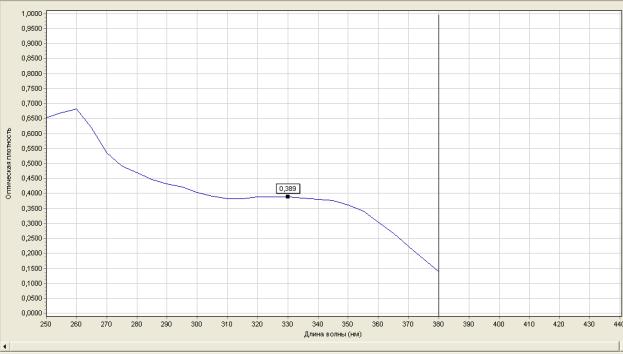
2.4.1.Кількісне визначення суми фенольніх сполук
Кількісний вміст суми фенольних сполук спектрофотометричним методом з наступною методикою [30, 91]. 10,0 г листя церцису європейського заливали 70 % етанолом у співвідношенні 1:10 два рази. Отримані спирто-водні розчини з’єднували і випарювали до водного залишку. УФ-спектри поглинання фенольних сполук і галової кислоти, що дозволило використати її як стандарт. Вміст суми фенольних сполук у перерахунку на галову кислоту і абсолютно суху сировину у відсотках (х) обчислювали за формулою:
 ,
,
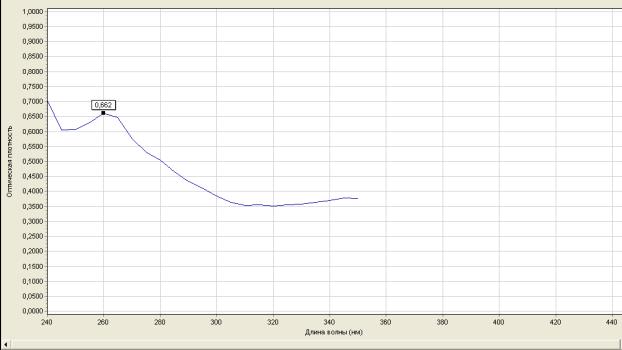
де A-оптична густина досліджуваного розчину,
Аo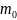 -
оптична густина стандартного розчину
(галової кислоти),
-
оптична густина стандартного розчину
(галової кислоти),
а- маса наважки сировини (г),
аo –маса наважки стандартного розчину (г),
w- втрата маси при висушуванні сировини (%) .
Результати визначення наведені в табл. 2.4.
Таблиця 2.4
Вміст фенольних сполук у листі Cercis siliquastrum
M |
|
Xi |
Хср |
S2 |
Scp |
P |
t(P, ) |
Довірчий інтервал |
ε_, % |
|||
1 |
2 |
|
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|||
5 |
4 |
7,74 |
7,72 |
0,012250 |
0,05 |
0,90 |
2,13 |
7,72 |
± |
0,11 |
1,37 |
|
7,72 |
||||||||||||
7,55 |
||||||||||||
7,73 |
||||||||||||
7,86 |
||||||||||||
Вміст суми фенольних сполук в листі церцису європейського складає 7,72%.
2.4.5. Кількісне визначення флавоноїдів
Для аналізу суми флавоноїдів застосовували спектрофотометричний метод на спектрофотометрі СФ-46 за відомою методикою з використанням реакції комплексоутворення флавоноїдів з хлоридом алюмінію.
Біля 1 г (точна наважка) подрібненої до розміру часток, що проходять крізь сито з отворами діаметром 1 мм сировини, вміщували в конічну плоскодонну колбу зі шліфом місткістю 100 мл, додавали 30 мл 70% спирту етилового та зважували (попередньо зважували порожню колбу). Колбу приєднували до зворотного холодильника, нагрівали на водяній бані до кипіння та підтримували слабке кипіння протягом 2-х годин. Після охолодження колбу зважували, нестачу в масі доповнювали 70% спиртом етиловим і настоювали протягом 1 години для досягнення рівноважної концентрації. Витяг фільтрували через сухий паперовий фільтр у суху колбу місткістю 50 мл (розчин А).
В мірну колбу місткістю 50 мл вміщували 1 мл розчину А, 1 мл 2% розчину алюмінію хлориду в 96% спирті етиловому і доводили об’єм розчину 96% спиртом етиловим до мітки. Через 40 хвилин вимірювали оптичну густину розчину на спектрофотометрі при довжині хвилі 405 нм в кюветі з товщиною шару 10 мм. В якості розчину порівняння використовували розчин, який складається з 1 мл витягу, 1 краплі розведеної оцтової кислоти і доведений 96% спиртом етиловим до позначки у мірній колбі місткістю 50 мл.
Паралельно вимірювали оптичну густину Державного стандартного зразку (ДСЗ) рутину, який готували аналогічно досліджуваного розчину [30].
Вміст суми флавоноїдів у перерахунку на рутин і абсолютно суху сировину розраховували за формулою:
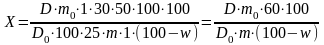 ,
,
де
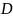 D
–
оптична густина досліджуваного розчину;
D
–
оптична густина досліджуваного розчину;
D0 – оптична густина розчину ДСЗ рутину;
m – маса сировини, г;
– маса наважки ДСЗ рутину, г;
w – втрата в масі при висушуванні сировини, %.
Результати наведені в табл. 2.5.
Таблиця 2.5
