
- •1. Наука гидрология и ее связь с другими науками
- •2. Вода на земле. Водные ресурсы
- •3. Основные свойства воды
- •4. Водные объекты. Круговорот воды в природе. Внутриматериковый влагооборот
- •5. Водосбор реки. Морфометрические характеристики водосбора
- •6. Водный баланс бассейна реки. Элементы водного баланса
- •6.1. Осадки. Перехват осадков растительностью
- •6.2. Испарение
- •7. Речной сток. Факторы формирование стока на водосборе
- •Факторы подстилающей поверхности:
- •7.1. Основные характеристики стока воды. Фазы водного режима. Гидрограф стока
- •7.2. Уровень воды. Уровенный режим
- •8. Подземные воды. Классификация подземных вод.
- •9. Река и речная система
- •Смоченный периметр (p, м) – часть периметра, по которой происходит соприкосновение потока с твёрдыми стенками (смотри рисунки 9б и 10).
- •10. Тепловой баланс бассейна реки. Термический и ледовый режим рек
- •11. Режим стока наносов. Гидрохимический режим рек
- •12. Морские устьевые области
- •I. Физические процессы
- •13. Озера. Классификация озер по происхождению. Морфометрические характеристики озер
- •14. Водный баланс озера. Режим уровня воды в озерах
- •15. Тепловой баланс озер и термический режим
- •16. Гидрохимический состав озерных вод и классификация по содержанию питательных веществ в озерных водах
- •17. Болота. Типы болот и их режим
- •18. Ледники. Определение. Образование, типы, строение. Движение ледников. Питание ледников. Баланс массы льда. Влияние на сток рек
- •Приложение
- •Содержание
3. Основные свойства воды
Вода – это светлая прозрачная жидкость, бесцветная в малых объемах и приобретающая голубовато-зеленоватую окраску своей толщи. Лед тоже прозрачен, так как коэффициент поглощения им света в видимой части спектра практически равен нулю, однако это не относится к ультрафиолетовой и инфракрасной областям. На сколах крупных глыб глетчерного и речного льда он, как и вода, имеет голубые и зеленоватые оттенки.
Свойства воды наложили отпечаток на систему физических констант и единиц измерения: температура замерзания воды – плавления льда принята
за 00С, а температура кипения воды за 1000С (то и другое при атмосферном давлении около 1013 мбар или гПа = 759,8 мм рт. ст.). Единица объема
в метрической системе выбрана из условия, что один кубический метр воды при температуре 3,980С имеет массу 1000 кг.
Каждая молекула воды имеет два атома водорода и две не поделенные электронные пары и, тем самым, может образовать четыре водородные связи. Последние осуществляются с участием атома водорода, расположенного либо между молекулами, либо между атомами внутри молекулы:

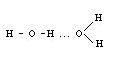
Будем воспринимать воду, как ассоциацию молекул, объединенных водородными связями. И если в жидкой воде содержатся отдельные ассоциаты ее молекул, то аналогичное расположение молекул характерно и для льда,
но упорядоченность распространяется уже на всю систему в целом, что,
в конечном счете, приводит к образованию характерной тетраэдрической структуры льда. Другими словами, кристаллы льда целиком построены только на одних водородных связях. Структура льда образно названа «весьма ажурной», ибо в ней молекулы упакованы менее плотно, чем в жидкой воде.
По сравнению с другими веществами, вода характеризуется наибольшей удельной теплоемкостью, которая при температуре 15°С составляет
4190 Дж/(кг*К).
Теплопроводность воды весьма незначительна, но зато вода обладает очень высокой скрытой теплотой плавления и испарения. Для того чтобы превратить 1 кг льда в воду (скрытая теплота плавления), необходимо затратить 330 000 Дж/кг, а при испарении 1 кг воды (скрытая теплота испарения) затрачивается 2260 Дж. Эти особенности воды имеют важное значение для теплового баланса Земли [4].
При замерзании вода расширяется на 9% по отношению
к первоначальному объему.
Из всех жидкостей, кроме ртути, вода имеет самое большое поверхностное натяжение.
Еще одно замечательное свойство воды – способность растворять многие вещества. Особо хорошо растворимы в воде те химические соединения, которые могут образовать с ней водородные связи. Мы в своей повседневной деятельности привыкли считать хорошими растворителями такие вещества, как спирт, бензин, эфир и многие другие, которые действительно хорошо растворяют жиры и вообще многую органику, но в них не растворяются, например, соли. Зато последние хорошо растворяются в воде, т.к. она обладает крайне высокой диэлектрической проницаемостью, и ее молекулы имеют тенденцию соединяться с ионами, превращая их в гидратированные ионы, что приводит к их стабилизации в растворе. Хорошая растворимость различных солей в воде очень важна для многих природных процессов.
