
- •Головний комплекс гістосумісності
- •Методи імунологічного дослідження
- •1) До орієнтувальних тестів (і рівня) належить визначення:
- •2) До уточнювальних тестів (іі рівня) належить визначення:
- •Вікові особливості функціонування імунної системи.
- •Матеріали, необхідні для самопідготовки
- •“Клінічна імунологія та алергологія” Підручник за ред. Проф. Г.М. Дранніка.–к.–Здоров’я, 2006.–888 с.
- •Андрейчин м.А., Чоп’як в.В., Господарський і.Я. Клінічна імунологія та алергологія.–Тернопіль: Укрмедкнига, 2005.–372 с.
- •Клінічні завдання для самопідготовки (тема – №2)
Змістовий модуль №1
«Клінічна імунологія та алергологія»
Методичні вказівки для проведення заняття зі студентами
Практичне заняття №2
«Головний комплекс гістосумісності. Імунологічні методи доcлідження. Вікова імунологія» – 4 год.
Актуальність
Учення про головний комплекс гістосумісності (ГКГ) є стрижневим у фундаментальній і прикладній імунології. Неодноразово згадувалося про молекули ГКГ, зокрема під час опису особливостей презентації чужорідного матеріалу для розпізнавання Т-лімфоцитам при розвитку імунної відповіді. Роль молекул ГКГ надзвичайно важлива. Набір цих молекул для кожної людини абсолютно індивідуальний.
Становлення імунної компетенції розпочинається на ранніх етапах ембріонального розвитку і є процесом генетично детермінованим.
Навчальні цілі:
ознайомити студентів з будовою, функцією та властивостями головного комплексу гістосумісності;
ознайомити студентів з лабораторними та інструментальними методами обстеження, які застосовують для оцінки імунної системи, показаннями для їх призначення, методикою виконання, діагностичною цінністю кожного з них;
ознайомити студентів з віковими особливостями функціонування імунної системи;
Що повинен знати студент:
Головний комплекс гістосумісності: будова, властивості, функція.
Інструментальні та лабораторні методи оцінки імунної системи.
Імунограма, інтерпретація результатів.
Вiковi особливостi функцiонування імунної системи.
Роль материнського органiзму в формуваннi iмунiтету дитини.
Тимус i старiння.
Iмунорегуляторнi процеси в похилому вiцi.
Iмуннi теорiї старiння.
Імунопатологiя у осіб похилого вiку.
Що повинен вміти студент:
назначати лабораторні та інструментальні методи обстежень;
інтерпретувати дані імунограми;
Зміст теми:
Головний комплекс гістосумісності
Перші роботи, що свідчать про існування у ссавців генів, які детермінують вираженість трансплантаційної реакції відторгнення, з'явилися понад 40 років тому, із початком активного пересаджування органів. Згодом ця група генів одержала назву «головний комплекс гістосумісності» (major histocompatibility complex — МНС). Самою назвою було підкреслено їх визначальну роль у розвитку трансплантаційного імунітету. У людини цей комплекс генів одержав назву системи НLA (human leukocyte antigen). Таким чином, абревіатури ГКГ, МНС і НLА для людини є синонімами позначення головного комплексу гістосумісності.
Дійсно, донедавна при вивченні проблем, пов'язаних з антигенами системи НLА (трансплантаційними, або тканинними, антигенами), керувалися переважно їх очевидним практичним значенням у пересаджуванні органів, насамперед нирки. Первинна біологічна функція трансплантаційних антигенів була невідома. Однак досягнення останніх років у дослідженні генетичної структури і біологічної ролі ГКГ дозволили визначити принаймі дві основні його функції, що мають загальнобіологічне значення. До них належать:
1) роль трансплантаційних антигенів у міжклітинних взаємодіях під час реалізації імунної відповіді; 2) функція НLА-регіону, пов'язана з імунологічною реактивністю організму в цілому. У першому випадку мова йде про те, що молекули ГКГ є тими структурами, за допомогою яких здійснюється презентація чужорідного антигенного матеріалу для наступного розпізнавання антигенрозпізнавальним Т-клітинним рецептором. У другому випадку мова йде про існування в НLА-регіоні спеціального гена імунної відповіді (Іr — immune response), наявність якого визначає здатність даного організму розвивати імунну відповідь на конкретний антиген; ця сама функція НLА-регіону пов'язана зі схильністю до низки захворювань.
Початком вивчення антигенів гістосумісності людини можна вважати працю G.Dausset (1957), у якій було описано перший антиген гістосумісності людини, названий МАС (нині це НLА-А2).
Деякі дослідники називають антигени ГКГ «імунним паспортом, групою білої крові», за допомогою яких імунна система здатна відрізняти «своє» — self від «чужого» — non-self. Індивідуальний набір і властивості молекул ГКГ багато в чому визначають силу імунної відповіді конкретної людини на конкретний антиген.
Помітивши, що клітини гомозиготних близнюків реагують із набором тест-сироваток однаково, а гетерозиготних — по-різному, G.Dausset висловив припущення, що згодом підтвердилося, про генетичну детермінованість антигенів гістосумісності: тобто про те, що кожний із генів, які входять у НLА-комплекс, має своє представництво у вигляді антигену гістосумісності, що експресує на мембрані клітини.
На сьогодні ГКГ (НLА) людини є одною із найбільш вивчених і водночас найскладніших генетичних структур у геномі людини.
Позначення НLА-специфічностей включає три компоненти: 1) абревіатуру всієї системи; 2) локус, що містить дану специфічність; 3) номер антигену (наприклад, НLА-В12). У тому разі, коли генетична позиція антигену ще недостатньо ясна або недостатньо уточнена, перед його порядковим номером ставлять символ «w» (workshop).
Встановлено, що гени НLА-системи розташовані на короткому плечі 6-ї хромосоми. Усіх їх поділено на три групи: гени гістосумісності класу І, класу II і класу III; також згруповані і молекули (антигени), контрольовані цими генами.
Нині гени системи НLА-класу І включають локуси В, С, Е, А, G, F (у напрямку до теломери). Частина з них — локуси В, С й А — відносять до так званих класичних, що кодують традиційні трансплантаційні антигени. Що стосується недавно відкритих локусів Е, F, G, то біологічна функція їх самих і їх продуктів уточнюється. Можливо, деякі з них беруть участь у презентації антигену для розпізнавання інтраепітеліальними Т-лімфоцитами-кілерами, які несуть γ, σ-ланцюги в антигенрозпізнавальному рецепторі; інші визначають взаємовідносини в системі «мати—плід» (наприклад, антигени локусу G).
У нормі «класичні» антигени системи НLА класу І присутні на всіх ядерних клітинах, розрізняючись лише за ступенем інтенсивності їх експресії. Доведено найнижчий вміст їх на міокардіоцитах, кісткових м'язах, ендотелії рогівки; не встановлено їх присутність на нитках трофобласту. Ступінь вираженості антигенів системи НLА як І, так і II класу — непостійний і залежить від впливу насамперед так званих ендогенних факторів модифікації імунної відповіді, до яких відносять інтерлейкіни, інтерферони, ПНФ, простагландини тощо.
Однією з найважливіших характеристик генів системи НLА є їх різноманітність і поліморфізм, тобто існування в межах кожного локусу великої кількості різних специфічностей НLА-генів (або множинних алельних варіантів), що різняться між собою за амінокислотними послідовностями, які входять у варіабельну ділянку ДНК, що визначає їх поліморфізм. Описано понад 40 специфічностей у локусі А, більше ніж 60 специфічностей у локусі В та приблизно 20 — у локусі С (R. Lechler, 1994). Крім того, показано, що деякі специфічності (гени) мають по декілька алельних варіантів. Так, наприклад, НLА-А2-специфічність має 12 алелів, В35 — 6, а В27 — 7 алелів. Наявність алельного поліморфізму НLА-молекул лежить в основі суворої індивідуалізації набору трансплантаційних антигенів у кожної конкретної людини, роблячи її неповторною в цьому плані.
Дуже важливим етапом у розвитку вчення про систему НLА і в розумінні функції молекул НLA класу І стали праці, у яких було описано їх тонку будову.
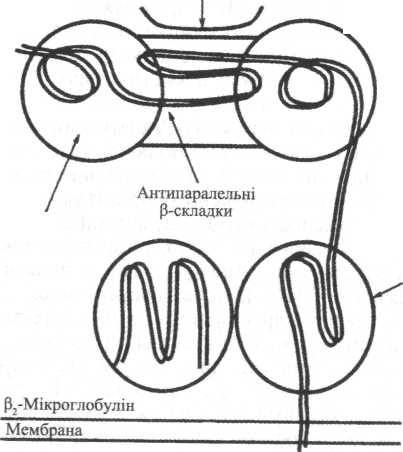
На мал. 1 подано схематичне зображення структури молекули (антигену) НLА класу I (І. Roitt, 1994). За сучасними уявленнями, молекула НLА класу І є гетеродимером, що складається з важкого α-поліпептидного ланцюга і нековалентно зв'язаного з ним легкого β-поліпептидного ланцюга.
Пептид, уміщений
у пептидзв'язувальну
а,-Домен
а2-Домен
а-Спіраль
а -Домен
Ділянка зв'язування з молекулою СБ8
борозенку
СООН (внутрішньо-плазматичний «хвіст»)
Мал.1. Схематичне відтворення молекули (антигену) HLA I класу(пояснення у тексті)
α-Ланцюги молекул класу І містять приблизно 340 амінокислотних залишків, що формують три позаклітинних домени (α1,α2,α3), одну трансмембранну частину і внутрішньоцитоплазматичний «хвіст». Вони кодуються генами локусів А, В й С комплексу НLА, розташованого на 6-й хромосомі, і, як уже згадувалося, є високополіморфними. β-Ланцюг молекули класу І — це β2-мікроглобулін, який складається з позаклітинного домену, що включає 100 амінокислотних залишків, він кодується геном, розташованим на 15-й хромосомі, і є неполіморфним.
Серія праць, створених P. Bjorkman та співавторами (1987), дала змогу зрозуміти природу просторової взаємодії НLА-молекул і антигенних пептидів.
З'ясували, що взаємне розташування α1 і α2-доменів у молекулі НLА класу І створює «жолоб», «кишеню», у формуванні якої беруть участь дві α-спіралі — «стіни» і антипаралельні β-складки - «дно»; ця структура одержала назву «пептидзв'язувальна борозна». Певна амінокислотна послідовність цієї борозни служить своєрідним «якорем» утримання в ній пептиду. Саме в такий спосіб НLА-молекула класу І презентує специфічний пептид для його подальшого розпізнавання α- і β-ланцюгами Т-клітинного антигенрозпізнавального рецептора.
Як згадувалося вище, пептид є процесованим антигеном (чужорідний або власний), що складається з невеликої кількості амінокислотних залишків. Так званий лінійний пептид, розміщений у пептидзв'язувальній борозні молекули НLА класу І, складається з 4—9 амінокислотних залишків. Трохи більше (до 20) містять пептиди, розташовані в «борознах» молекул класу II. По суті пептид — це антигенна детермінанта, епітоп. Складний антиген може містити сотні пептидів.
Як же утворюється пептид, як він потрапляє в пептидзв'язувальну борозну молекули гістосумісності класу І і як вона з'являється на поверхні клітини? Це стало зрозумілим після виявлення двох нових локусів — LМР і ТАР, віднесених до класу II .
Гени локусу LМР кодують великий пептидний комплекс, названий протеасомою. Протеасома є внутрішньоклітинним комплексом, залученим до протеолізу цитозольних білків, що забезпечує продукцію ендогенних пептидів.
У свою чергу ці пептиди за допомогою трансмембранних білків, контрольованих генами локусу ТАР, надходять до ендоплазматичної сітки і там «завантажуються» в антигензв'язувальну борозну антигенів системи НLА класу І, потім транспортуються на поверхню клітини і далі презентуються для розпізнавання попередникам Т-лімфоцитів-кілерів (супресорів; СD8+-клітини). Важливо пам'ятати, що до антигенів, які піддаються впливу протеасом, належать не лише власні цитозольні білки, а й продукти багатьох вірусних, бактеріальних або протозойних патогенів, що індукують розвиток клітинної відповіді і дозрівання Т-лімфоцитів-кілерів (СD8+-клітини).
Таким чином, пептиди, презентовані молекулами НLA класу І, несуть інформацію про всі цитозольні ендогенні білки як нормальні, так і змінені, або в результаті мутації, або внаслідок модифікації вірусами, а також іншими внутрішньоклітинними паразитами. Оскільки «класичні» антигени ГКГ класу І наявні, як уже згадувалося, на всіх клітинах організму, стає зрозумілим, наскільки важливий подібний цензорний механізм за зміненими клітинами, що індукують активацію цитотоксичних Т-лімфоцитів-кілерів (СD8+-клітини).
Гени системи НLА класу II розташовані безпосередньо поблизу центромери і включають декілька локусів, частину з яких — DR, DP, DQ — можна віднести до «класичних», трансплантаційних або таких, що беруть безпосередню участь у презентації чужорідного антигену під час його розпізнавання; інші виконують хоч і надзвичайно важливу, але все ж допоміжну функцію.
Антигени, кодовані генами системи HLA ккласу ІІ локусів DR, DP, DQ, експресуються на противагу молекулам HLA класу І не настільки широко. Їх виявлено в нормі лише на В-лімфоцитах, макрофагах, і дендритних клітинах (тобто на клітинах, здатних презентувати антиген). У разі впливу таких цитокінів, як γ-інтерферон, молекули HLA класу ІІ можуть експресуватися і на інших клітинах.
У пептидзв'язувальних борознах антигенів системи НLА класу II також є пептиди, але в основі їх утворення (продукції) лежить принципово інший внутрішньоклітинний механізм. У цьому разі пептиди надходять з екзогенних антигенів, поглинених АПК за допомогою, наприклад ендоцитозу.
Після ендоцитозу чужорідний антиген піддається деградації (протеолізу) у ранніх і пізніх ендосомах (лізосомах), у результаті чого утворюються пептиди. Однак «завантаження» цих пептидів у пептидзв'язувальну борозну молекул НLА класу II відбувається не в ендоплазматичній сітці. Справа в тому, що хоча збирання молекул HLA класу II і відбувається в ендоплазматичній сітці, але в цьому компартменті клітини зазначені молекули мають додатковий ланцюг, який має назву інваріантний ланцюг (ІЛ), що ніби «прикриває» собою пептидзв'язувальну борозну. Такий комплекс — молекули HLA класу II + ІЛ — транспортується через комплекс Гольджі в ендосомний компартмент клітини, де міститься пептид, що утворився з чужорідного антигену. Тут під впливом катепсинів В і D відбувається руйнування ІЛ і «завантаження» пептидів у пептидзв'язувальну борозну, що відкрилася. На наступному етапі комплекс, що утворився, — молекула НLА класу II + пептид - транспортується на поверхню клітини і презентується для розпізнавання Т-лімфоцитам-хелперам (СD4+-клітинам). Активовані в такий спосіб Т-лімфоцити-хелпери в свою чергу беруть участь у реалізації імунної відповіді.
Говорячи про основну роль молекул НLА класу І і II у реалізації імунної відповіді, варто підкреслити їх необхідність для антигенної активації Т-клітин. На відміну від В-клітин, що безпосередньо розпізнають антиген за рахунок своїх імуноглобулінових рецепторів, Т-клітини можуть розпізнавати його лише тоді, коли антиген у вигляді пептиду експресовано на клітинній мембрані в комплексі з власною НLА-молекулою — феномен НLА-рестрикції (обмеження розпізнавання антигенних пептидів молекулами НLА). За відкриття феномена HLA-рестрикції американським ученим Дохерті і Цинкернагель було присуджено Нобелівську премію.
Установлено, що субпопуляція Т-лімфоцитів-хелперів (СD4+-клітини) розпізнає чужорідний пептид, презентований молекулами НLА класу II, а субпопуляція Т-лімфоцитів-кілерів (супресорів; СD8+-клітини) розпізнає пептид, презентований молекулами НLА класу І, тому говорять, що функція Т-хелперів обмежена (рестриктована) молекулами НLА класу II, а функція Т-кілерів (супресорів) — молекулами НLА класу І. Доведено, що структури СD4 і СD8, наявні на Т-хелперах і Т-кілерах (супресорах) відповідно, є додатковими адгезивними молекулами, що стабілізують приєднання Т-клітин-хелперів і кілерів до АПК за допомогою специфічної взаємодії з неполіморфними частинами відповідно до молекул НLА класу II (β2-домен) і класу І (α3-домен). Вони специфічно розпізнають аутологічні молекули ГКГ і ніби «утримують» разом АПК і Т-лімфоцит, забезпечуючи тим самим достатній контакт клітин у процесі розпізнавання. Крім того, СD4 і СD8 молекули належать до так званих костимуляційних молекул, які сприяють трансдукції сигналу всередину Т-лімфоцита. Ще одним важливим костимуляційним сигналом для активації Т-лімфоцита є взаємодія його рецептора СD28 із білками на поверхні АПК із родини молекул СD80. У процесі цієї взаємодії відбувається передача сигналу всередину Т-лімфоцита, у результаті чого відбувається його активація. Без костимуляційних сигналів активація Т-лімфоцитів не настане; можливою є його загибель за механізмами апоптозу.
Гени системи НLА класу III займають на 6-й хромосомі проміжне положення між генами класів І і II. Вони не кодують класичні антигени гістосумісності, але їх продукти виконують цілу низку найважливіших біологічних функцій.
Одним із генів системи НLА класу IIІ, що привертають найбільшу увагу, є ген CYR21, основна функція якого — контроль за активністю ферментів цитохрому Р450. Дефект цього гена призводить до розвитку синдрому конгенетальної адреналової гіперплазії, частота якого в популяції європеоїдів становить 1/10 000. «Нормальну» функцію ферментів кодує ген СYR21; тоді як СYR21Р є псевдогеном.
Гени С4 (С4А і С4В) кодують 4-й компонент комплементу.
У популяції європеоїдів наявність «С4А нульового алелю» здебільшого асоційована зі схильністю до системного червоного вовчака й іншої автоімунної патології. Що стосується асоціації системного червоного вовчака з НLА-гаплотипом (сукупність генів, розташованих на одній хромосомі) у цілому, то найсильніший зв'язок зі схильністю до системного червоного вовчака встановлено для гаплотипу НLА-А1, В8, Cw4, DR3.
Ген В (Вf) функціонує значною мірою разом із геном С2, беручи участь у «запуску» альтернативного шляху активації. Дефіцит гена В описано тільки в гетерозиготі. У гомозиготі дефіцит цього гена не описано і він, мабуть, має летальний характер.
Дефіцит С2 є найчастішою формою недостатності системи комплементу в людини (частота відсутності С2 в гомозиготі 1: 10 000). У 40 % хворих на системний червоний вовчак виявлено дефіцит С2.
Наступним після локусу С2 в бік від центромери є локус генів теплового шоку 70 (НSР70). Білкові продукти цих генів виконують протективну функцію під час розвитку так званого клітинного стресу (підвищення температури тіла, зміна рН і осмотичності внутрішньо- і позаклітинного середовища). Не виключено, що продукти цих генів можуть зумовлювати асоціацію певних алельних варіантів НLА-генів із захворюваннями людини.
Крайнім у бік теломери серед генів системи НLА класу III є локус ПНФ (TNF), який складається з двох генів — А і В, що кодують ПНФ-α й ПНФ-β. Обидва білки секретуються активованими макрофагами і Т-лімфоцитами і справляють плейотропну дію на різні типи клітин, включаючи різні субпопуляції лімфоцитів, нейтрофіли й ендотеліоцити судин.
Зазначені механізми дії білків ПНФ, а також їх вплив на запальний процес, опосередкований ними цитолітичний і цитотоксичний ефект проти ракових клітин забезпечують найважливішу біологічну функцію ПНФ. Крім цього, білки ПНФ беруть участь у регуляції експресії антигенів НLА класу І на ендотелії судин, що свідчить про участь ПНФ у розвитку автоімунної патології і реакції відторгнення трансплантації.
НLА-гени успадковуються за кодомінантним типом, що означає однаковий прояв у гібридів алоантигенів, зумовлених обома батьківськими алелями даного локусу. Оскільки кожний індивідуум одержує від своїх батьків по одній хромосомі, у людини є два гаплотипи, що в сукупності формують генотип.
Антигени, виявлені під час вивчення клітин конкретної людини, формують її фенотип; таке лабораторне обстеження називають фенотипуванням. На відміну від фенотипу, в генотипі відома послідовність розташування генів на хромосомі. Генотип (два гаплотипи) може бути визначений за допомогою родинних досліджень, під час яких виявляють фенотипи батьків і дітей (рідні сестри і брати — сибси). Таким чином, визначаючи фенотипи членів родини, можна встановити гаплотипи.
