
- •12 (8). Способы разделения и очистки белков.
- •37.Генные мутации и соответствующие мутагенные факторы.37
- •52.Структура и функции дыхательной цепи. Роль дыхательной цепи в создании и поддержании протонного электрохимического градиента.Градиент как носитель энергии.
- •53.Механизмы окислительного фосфорилирования, локализация пунктов фосфорилирования в дых.Цепи, сопряжение и разобщение дыхания и фосфорилирования.
- •56. Гликолиз. Р-ции. Регуляция.
56. Гликолиз. Р-ции. Регуляция.
Реакции:
1)2ПВК+2АТФ+2СО2->(пируваткарбоксилаза)2 оксалоацетат+2фосфат неорганич.+2 АТФ
2)2 ацелоацетат+ 2 НАДН(Н+)->(малатдегидрогеназа) 2 малат+2НАД+
3)2 малат +2НАД+->(малатдегидрогеназа)2 ацелоацетат+2НАДН(Н+)
4)2 оксалоацетат+2 ГТФ->(фосфоенол-пируват-карбоксикиназа)2 фосфоенол-пируват+2ГТФ
5)2 фосфоенол-пируват->(енолаза)2 фосфоглицерат
6)2 фосфоглицерат->(фосфоглицератмутаза) 2 3-фосфоглицерат
7)2 3-фосфоглицерат +2АТФ->(фосфоглицераткиназа)2 1,3-дифосфоглицерат +2 АДФ
8)2 1,3-дифосфоглицерат +2 НАДН(Н+)->(глицеральдегид-3-фосфат-дегидрогеназа) 2 глицеральдегид-3-фосфат+2 фосфат нерганич.
9)Глицеральдегид-3-фосфат->(триозофосфат-изомераза) дигидрокси ацетон фосфат
10)Глицеральдегид-3-фосфат+дигидрокси-ацетон-фосфат->(фруктозодифосфат-альдалаза) фруктозо-1,6-дифосфат
11)Фруктозо-1,6-дифосфат+Н2О->(фруктозодифосфатаза) фруктозо-6-фосфат+фосфат неорганич.
12)Фруктозо-6-фосфат->(фосфоглико-изомераза) глюкозо-6-фосфат
13)Глюкозо-6-фосфат + Н2О->(глюкозо-6-фосфатаза) глюкоза+ фосфат неоганич.
Регуляция гликолиза: гликолиз стимулир-ся инсулином, повышающим кол-во молекул гексокиназы, фосфофруктокиназы, пируваткиназы. В печени активность глюкокиназы регулир-ся гормонами: активацию вызывает инсулин и андрогены, подавляют ее активность глюкокортикоиды и эстрогены.
57. Пентозофосфатный путь (ПФП)-это альтернативный путь окисл-я гл-зы в печени, мол.ж-зе и жир.тк. Фер-ты этого пути распол-ны в цит-ме. Сост.из 2 этапов: окисл-го и неокисл-го. В завис-ти от необх-ти он может осущ-ся по циклич-му или шунтирующему пути. Один из вариантов стехиометрии предпол., что из 3 мол-л гл-зо-6-фосфатов образ-ся 3 мол-лыCO2 и 3 мол-лы пяти углеродн.сахаров. Пентоза превр-ся 2 мол-лы глюкозо-6-фосфата и 1 мол-лу глицеральдегид фосфат. Акцептором протонов и электронов служит НАД. Р-ции:1)Гл-зо-6-фосфат при участии фермента гл-зо-6-фосфат дегидрогеназа в присутствии НАДФ и кофакторовMn2+или Ca2+ обратимо превр-ся в 6-глюконолактон. Из него образ-ся 6-фосфоглюконат (фермент глюконолактонгидролаза). Кофакторы те же. 2)6-фосфоглюконат окисл-ся 6 фосфоглюконатдегидрогеназой кофермент НАДФ, кофакторыMn2+, Ca2+. В обратим.р-ции до 3-кето-6-фосфоглюконата, при декарбоксилировании которого обр-ся рибулоза-5-фосфат.3)Фермент рибулозо-5-фосфат эпимераза изм-т конфигурации мол-лы в обл.3 углер.атома превращая рибулозо-5 фосфат в ксилулозо-5-фосфат (обрат.р-ция). Альтер-но фермент рибозо-5-фосфат кетоизомераза обратимо превращает в рибулозо-5-фосфат в рибозо-5-фосфат.4)Транскетолаза при помощи тиаминпирофосфата и Mg2+переносят 1 и 2 атомы углерода. Ксилозо-5-фосфат на рибозо-5-фосфат, в рез-те чего образ-ся седогетулозо-7-фосфат и глицеральдегид-6-фосфат.5)Трансальдолаза катализирует перенос 3-х углер.части седогептулозо-7-фосфат на глицеральдегид-3-фосфат с образованием фруктозо-6-фосфата и эритрозо-4фосфата.6)Транскетолаза при помощи тиамин пирофосфата и Mg2+ переносит 1-й и 2-ой атомы углерода ксилулозо-5-фосфата на эритрозо-4-фосфат с образованием фр-зо-6-фосфата и глицеральдегид-3- фосфата. Значение ПФП:1.Он является главным источником восстановит-го экв-та НАДФН(Н+),который исполь-ся в биосинтезах,а также в реакциях нейтромирации активн.форм кислорода. 2.В ходе р-ций обр-ся рибоза-5-фосфат,который исп-ся для синтеза нукл к-т и носителей Е.(нуклеотидов). 3.В неокислит.части обр-ся сложн.сахара используемые при образование компонента межклеточного матрикса, углеводных компонентов рецептора и тд.
58. Биосинтез углеводов в тканях. Реакции глюконеогенеза и гликогеногенеза, углеводные и неуглеводные источники для глюконеогенеза, взаимоотношение процессов синтеза и распада гликогена. Биосинтез углеводов в тканях происходит аэробным (с доступом кислорода) и анаэробным (без доступа кислорода) путями. Анаэробный путь- гликолиз и гликогенолиз. Гликолиз- процесс распада глюкозы, протекающий без потребления О2 .Конечный продукт- молочная к-та. В процесс гли-за образуется АТР. Суммарное ур-ие гли-за:C6H12+2АДФ+2Фн ->2CH3CH(OH)COOH+2H2O. Благодаря гликолизу организм человека опред-ый период может осуществлять ряд физиологических ф-ий в условиях недостаточности О2. Его ферменты способны связываться с мышечными белками. Гликогенолиз- расщепление начинается с гликогена. Начальная реакция - фосфорилиз гликогена- расщепление с присоединением фосфор. к-ты. В печени и почках имеется фермент- глюкоза-6- фосфотаза. Образовавшаяся глюкоза выходит из клетки в кровь. Это заключит. Стадия гликогенолиза в печени, приводящего к повышению содержания глюкозы в крови. Аэробный путь - окисление глюкозы до СО2 и Н2О, пируват проникает в митохондрии, где полностью окисляется до СО2 и Н2О. Если содержание кислорода недостаточно, то пируват превращается в лактат. Аэробный распад глюкозы можно выразить суммарным уравнением: С6Н12О6 + 6 О2 → 6 СО2 + Н2О + 2820 кДж/моль. Глюконеогенез - это образование глюкозы из таких неуглеводных предшественников лактата, циклокарбоновых к-т, глицерола, пропиата. Состоит из 10 р-ций- необратимые: 1,4,11,13, остальные обратимые.
1)2ПВК+2АТФ+2СО2->(пируваткарбоксилаза)2 оксалоацетат+2фосфат неорганич.+2 АТФ
2)2 ацелоацетат+ 2 НАДН(Н+)->(малатдегидрогеназа) 2 малат+2НАД+
3)2 малат +2НАД+->(малатдегидрогеназа)2 ацелоацетат+2НАДН(Н+)
4)2 оксалоацетат+2 ГТФ->(фосфоенол-пируват-карбоксикиназа)2 фосфоенол-пируват+2ГТФ
5)2 фосфоенол-пируват->(енолаза)2 фосфоглицерат
6)2 фосфоглицерат->(фосфоглицератмутаза) 2 3-фосфоглицерат
7)2 3-фосфоглицерат +2АТФ->(фосфоглицераткиназа)2 1,3-дифосфоглицерат +2 АДФ
8)2 1,3-дифосфоглицерат +2 НАДН(Н+)->(глицеральдегид-3-фосфат-дегидрогеназа) 2 глицеральдегид-3-фосфат+2 фосфат нерганич.
9)Глицеральдегид-3-фосфат->(триозофосфат-изомераза) дигидрокси ацетон фосфат
10)Глицеральдегид-3-фосфат+дигидрокси-ацетон-фосфат->(фруктозодифосфат-альдалаза) фруктозо-1,6-дифосфат
11)Фруктозо-1,6-дифосфат+Н2О->(фруктозодифосфатаза) фруктозо-6-фосфат+фосфат неорганич.
12)Фруктозо-6-фосфат->(фосфоглико-изомераза) глюкозо-6-фосфат
13)Глюкозо-6-фосфат + Н2О->(глюкозо-6-фосфатаза) глюкоза+ фосфат неоганич.
59. Биосинтез и распад гликогена. Регуляция обмена гликогена. Гликоген- разветвлённый полимер глюкозы. Наибольшая его концентрация обнаружена в печени и мышцах. Поскольку мышечная масса организма человека велика, то большая часть гликогена организма содержится в мышцах. Глюкоза из крови легко проникает в клетки органов и тканей, проходя ч/з биологические мембраны клеток. Как только глюкоза поступает в клетку, она метаболизируется в ней в результате первой химической реакции. Фосфорилирование глюкозы происходит в присутствии АТФ и фермента - гексокиназы. Глюкоза превращается в глюкозо-6-фосфат . Этот эфир глюкозы теперь будет использоваться в анаболических и катаболических реакциях. Глюкоза из клетки может выйти только после реакции гидролиза при участии глюкозо-6-фосфатазы. Этот фермент есть в печени, почках, эпителии кишечника. В других органах, тканях его нет. Процесс биосинтеза гликогена протекает в 4 стадии. Ферменты: 1) фосфорилаза, 2) фосфоглюкомутаза, 3) глюкоза-6-фосфатаза, 4) глюкокиназа, 5) глюкозо-1-фосфатуридил трансфелаза, 6) гликоген-синтетаза. Основная часть гликогена нах-ся в печени и истощается за сутки. Фермент гликогенсинтетаза катал-ся присоединением глюкозы. И сущ-ет в 2 формах: А) активная (дефосфолирована). Б) неактивная (фосфолирована). Фосфолирование катал-ся протеинкиназами, там присоединяется АМФ, синтез которой стим-ся адреналином и глюкагоном. Переход из активной формы в неактиную актив-ся гидрокартизоном, инсулином, глюкозой и ИНГИБИРУЕТСЯ гликогеном. Глюкоза подвергается фосфолированию при участии фермента гексокиназы, а в печени- глюкокиназы. глюкозо-6-фосфат->(фосфоглюкомутазыа) глюкозо-1-фос-фат. Сущ-ет 2 стадии- 1)Стадия синтеза глюкозо-1-фосфата: глюкозо-1-фосфат+УТФ (уридинтрифосфат)-> (УДФ-глюкоза) + пирофосфат. 2)стадия образования гликогена. C6H12O6->(гексокиназа)глюкоза-6-фосфат->(фосфомутаза)глюкоза-1-фосфат. Распад- это процесс расщепления гликогена. Сущ-ет 2 пути распада: 1)Гидролитический- осуществ-ся под действием фермента амилазы в печени в присутствии воды и выделяется свободная глюкоза. 2) Фосфоролитический- катализ-ся ферментом фосфорилазой. Это расщепление энергетически выгодно, т.к освободжается фосфолиривонная глюкоза. Главные ферменты, контролирующие метаболизм гликогена –гликогенфосфорилаза и гликогенсинтаза.
60. Глюконеогенез Регуляция. Реакции и роль в обмене вещ-в. Глюконеогенез -это образование глюкозы из таких неуглеводных предшественников,как лактата,промеж.продукты циклокарбон. К-т,глицерола,пропиата.
Реакции: Необратимые: 1,4,11,13 !!!!
1)2ПВК+2АТФ+2СО2->(пируваткарбоксилаза)2 оксалоацетат+2фосфат неорганич.+2 АДФ
2)2 ацелоацетат+ 2 НАДН(Н+)->(малатдегидрогеназа) 2 малат+2НАД+
3)2 малат +2НАД+->(малатдегидрогеназа)2 ацелоацетат+2НАДН(Н+)
4)2 оксалоацетат+2 ГТФ->(фосфоенол-пируват-карбоксикиназа)2 фосфоенол-пируват+2ГДФ
5)2 фосфоенол-пируват->(енолаза)2 фосфоглицерат
6)2 фосфоглицерат->(фосфоглицератмутаза) 2 3-фосфоглицерат
7)2 3-фосфоглицерат +2АТФ->(фосфоглицераткиназа)2 1,3-дифосфоглицерат +2 АДФ
8)2 1,3-дифосфоглицерат +2 НАДН(Н+)->(глицеральдегид-3-фосфат-дегидрогеназа) 2 глицеральдегид-3-фосфат+2 фосфат нерганич.
9)Глицеральдегид-3-фосфат->(триозофосфат-изомераза) дигидрокси ацетон фосфат
10)Глицеральдегид-3-фосфат+дигидрокси-ацетон-фосфат->(фруктозодифосфат-альдалаза) фруктозо-1,6-дифосфат
11)Фруктозо-1,6-дифосфат+Н2О->(фруктозодифосфатаза) фруктозо-6-фосфат+фосфат неорганич.
12)Фруктозо-6-фосфат->(фосфоглико-изомераза) глюкозо-6-фосфат
13)Глюкозо-6-фосфат + Н2О->(глюкозо-6-фосфатаза) глюкоза+ фосфат неорганич.
Регуляция глюконеогенеза: Превращение метаболитов в глюконеогенезе связаны так,что один процесс активен,а второй неактивен. А вообще термодинамически выгодна их одновременная активация. 1.Ацетил-КоАактивирует,а АДФ ингибирует пируваткарбоксилазу(первый фермент глюконеогенеза). Когда в клетке накапливается митохондриальный ацетил-КоА,биосинтез глюкозы из пируватаусиливается.,одновременно подавляются окислительные декарбоксилирования пирувата. Скорость глюконеогенеза зависит от концентрации лактата и других предшественников глюкозы 2. Фруктоза-1,6-бисфосфотаза ингибируется АМФ. В тоже время АМФ является аллостерическим
активатором фосфофруктокиназы. При низкой концентрации АМФ и высокой концентрации АТФ происходит стимуляция глюконеогенеза. А когда величина АМФ низкая,в клетке наблюдается расщепление глюкозы. Фруктозо-2,6-бисфосфатаза активирует фосфо-фруктокиназу и ингибирует фруктозодифосфатазу
Роль глюконеогенеза в обмене углеводов: глюконеогенез не только обеспечивает органы и ткани глюкозой, но еще и перерабатывает образующийся в тканях лактат, препятствуя тем самым развитию лактат-ацидоза.
61. Нарушение обмена углеводов.Выделяют след.основныенарушения обмена угл-ов:1.гипер-и гипогликимия.2.болезни накопления гликогена. 3.гликозурия. 4.галактозимия. 5.лактозурия .6.мальтозурия. 7.фруктозурия-причиной может быть:а)фруктозная нагрузка;б)дефицит фруктокиназы (неспособность потреблять фруктозу);в)недостаток или частич. Неактивность фруктозодифосфатальдолазы в печени;следствие накопление фруктозо-1-фофата блокирующего потребление глюкозы.
Норм.конц.глюкозы в крови 3,3-6 ммоль/л.Гипергликимия может быть вызвана избыт.кол-ом глюкозы в пищи или сах.диабетом.Сах.диабет бывает первичн. или вторичный. 1.Первичный (идиопатический) подраздел.на: а)потенциальный(фамильная предрасположенность); б)латентный (скрытый)-проявл.при лечении картизоном, острых инфекциях, беременности;характерен диабетический тип кривой сахарной нагрузки; в)асимптоматический (химич) г)клинический-делится на:-первого типа-инсулинзависимый (ювенильный)-проявл.в первые 40 лет жизни и хар-ся резким снижением секреции инсулина вследствие атрофии бета-клеток.-второго типа-инсулин-независимый. Поражает людей тарше 40 лет,хар-сянекот.снижениемсекреции инсулина. 2.Вторичный. Причины: а)поврежд.поджел. железа, прихронич. панкреатите,опухолях и др.очевидныхзаболеваниях; б)присутствие антаганистовинсулина: избыточная секреция гормона роста или глюкокартикоидов; в)ингибирование секреции инсулина:секреция инсулина бета-клетками может подавляться при избыт.продуктахнорадреналина,что приводит к мобилизации гликогена в печени.Адреналин и норадреналин блокируют секрецию инсулина.Др.причины диабелта:1.частичное нарушение норм.структуры инсулина;2.повыш.уровень секреции инсулиназы; 3.частичн. наруш.норм. структуры инсулиновых рецепторов. Гипогликимия делится на: а)гипогликимияголодание. Причины: инсулинсекретирующие опухоли (поджел.железа), недостаточн.ф-ии гипофиза и надпочечников,болезни печени и болезни накопления гликогена.б)реактивная гипогликимия. Причины: передоз. инсулина, физич.нагрузка,прием лекарственных препаратов, приемалкоголя, частичная реакция желудка. Такое состояние может вызвать сульфанилмочевина. Глюкозурия делится на:1.алиментарная(избыток глюкозы в пище);2.эмарганальная(стресс).Др.причины.1.действие хим. препаратов(морфин,хлороформ); 2.диабет;3.низкий порог ренальной реабсорбции;4.остр.инфекции,сотряс.мозга.
62. Гликогенозы, причины, сущность, проявления заболевания. Значение нарушений активности глюкозо-6-фосфотазы, кислой альфа-глюкозидазы, фосфорилазы, фосфоглюкомутазы, фосфофруктокиназы. Болезнь Гирке. Гликогеноз - группа наслед. Заболеваний, харктеризующихся отложением в тканях либо большим кол-вом гликогена, либо необычным его видом. Сущ-ет 7 типов болезней гликогеноза: 1тип- болезнь Гирке- в печени, почках много гликогена, отсутствует повышение уровня глюкозы в крови. В печени, почках, кишечнике либо отсутствует либо низкое содержание глюкозо-6-фосфотазы. 2тип- болезнь Помпа- отсуствует глюкозидаза- она предотвращает накопление в лизосомах. 3тип- болезнь Форбса или Кори. 4тип- болезнь Андерсена- наступает летальный исход от печеночной недостаточности в первый год жизни. 5тип- синдром МакАрдля- невыносливость к физич. нагрузкам, в крови почти нету лактата. 6тип- недостаточ. фосфорилазы в печени. 7тип- недостаточ. фосфофруктокиназы в печени.
63. Сахарный диабет: причины, типы, сущность нарушений углеводного, липидного, белкового обменов. Принципы диагностики и лечения, осложнения. Сах.диабет – это хрон. заболевание, приводящее к нарушениям углеводного, белкового и липидного обмена в результате недостатка гормона инсулина или неправильного его действия. Сахарный диабет бывает первичным или вторичным: 1.Первичный (идиопатический) подразделен на: а)потенциальный; б)латентный проявляется. при лечении картизоном, острых инфекциях, беременности; характерен диабетический тип кривой сахарной нагрузки; в) асимптоматический (химический) ; г) клинический - делится на: «первого типа» инсулинзависимый -проявляется в характеризуется резким снижением секреции инсулина вследствие атрофии бета-клеток и «второго типа» инсулин-независимый. характеризуется некоторым снижением секреции инсулина. 2.Вторичный. Причины :а)повреждение поджелуд .ж-зы при хроническом панкреатите, опухолях и др. заболеваниях; б)присутствие антагонистов инсулина: избыточная секреция гормона роста или глюкокартикоидов; Другие причины диабета: 1.частичное нарушение нормальной структуры инсулина; 2.повыш. уровень секреции инсулиназы; 3. частичное нарушение структуры инсулиновых рецепторов. Различают 2 группы симптомов: основные и второстепенные. К основным симптомам относятся: Полиурия — усиленное выделение мочи, вызванное повышением осмотического давления мочи за счёт растворённой в ней глюкозы. Полидипсия (постоянная неутолимая жажда) — обусловлена значительными потерями воды с мочой и повышением осмотического давления крови. Полифагия — постоянный неутолимый голод, вызван нарушением обмена веществ при диабете, неспособностью клеток поглощать и перерабатывать глюкозу в отсутствие инсулина. Похудание - обусловлено повышенным катаболизмом белков и жиров из-за выключения глюкозы из энергетического обмена клеток. К вторичным симптомам относятся: зуд кожи и слизистых оболочек, сухость во рту, общая мышечная слабость, головная боль, нарушение зрения. Осложнения: Диабетический кетоацидоз — тяжёлое состояние, развивающееся вследствие накопления в крови продуктов промежуточного метаболизма жиров. Возникает при— инфекциях, травмах, операциях, при недостаточном питании. Гипогликемия — снижение уровня глюкозы в крови ниже нормального значения (обычно ниже 3,3 ммоль/л), происходит из-за передозировки сахароснижающих препаратов, сопутствующих заболеваний или недостаточного питании, приёма крепкого алкоголя. Гиперосмолярная кома , Встречается у пожилых больных с диабетом 2-го типа в анамнезе или без него и всегда связана с сильным обезвоживанием. Лактацидотическая кома - обусловлена накоплением в крови молочной кислоты и чаще возникает на фоне сердечно-сосудистой, печеночной и почечной недостаточности, как следствие этого, накопления в тканях молочной кислоты. Основной причиной развития лактацидотической комы является резкое смещение кислотно-основного равновесия в кислую сторону; обезвоживания, как правило, при этом виде комы не наблюдается.
64. Галактоземия. Причины. Сущность проявления заболевания. Галактоземия - редкое генетическое нарушение обмена веществ, при котором изменяется нормальный процесс метаболизма углеводов (сахаров) галактозы. Причины возникновения. При нормальном метаболизме, лактоза, содержащаяся в продуктах питания, под действием фермента лактазы, расщепляется, образуя глюкозу и галактозу. У людей, больных галактоземией, ферменты, необходимые для преобразования галактозы или отсутствуют, или же их уровень очень низок, что приводит к накоплению токсического галактозо-1-фосфата в различных тканях, эти процессы приводят к гепатомегалии (увеличение печени), циррозу печени, почечной недостаточности, катаракте, повреждениям головного мозга и яичников. Без лечения, смертность детей грудного возраста с диагнозом галактоземия составляет около 75%.
65. Переваривание и всасыв липидов в ЖКТ. транспорт в кровотоке. Пища ч-ка содержит простые липиды, слож.липиды, а также эфиры холестерола (ацетат, олеат, пальментат и стеорат). Переваривание липидов осущ-ся в тонком кишечнике при помощи желчи и панкреатического сока, у детей вырабатывается фермент слюны-язычная липаза, которая активна в желудке. В желудке липиды подвергаются кислому гидролизу,в результате чего образуется некоторое кол-во свобод. жирных кислот.При поступлении в тонкий кишечник происходит нейтрализация пищи при помощи бикарбонатов панкреатического сока. Далее в результате действия липаз происходит дальнейшее расщепление липидов. Желчные кислоты эмульгируют липиды, резко увеличивает площадь поверхности контакта водной и жировой фазы. Это необходимо, потому что липазы водорастворимы. При их действии образуется: свободные жиров.к-ты, лизолицетины, свободный холестерол.
66. Классы липопротеинов, их состав и ф-ции в транспорте липидов. Перенос триацилглицерола и холестерола в клетки. Липопротеины — сложные соединения, молекулы которых построены из липидов и белков, связанных между собой посредством гидрофобных и электростатических взаимодействий. Они входят в состав всех живых организмов, выполняют ф-цию транспорта и запасания липидов. Основные липопротеины плазмы: хиломикроны (образуются в клетках кишечника, богаты триглицеридами), липопротеины очень низкой (являются транспортной формой эндогенных триглицеридов), промежуточной, низкой (наиболее атерогенные липопротеины крови) и высокой плотности (самые мелкие, образуются в печени и кишечнике в виде незрелых дисковидных частиц). Холестерол поступает в клетки из крови в основном в составе лпнп, поступает в ткани путем эндоцитоза ЛП, некоторое количество холестерола поступает в клетки путём диффузии из ЛПНП и других ЛП при их контакте с мембранами клеток.
67. β-окисление жирных кислот. Окисление ненасыщенных жирных кислот с четным и нечетным числом углеродных атомов. Попадая в клетки триглицнриды подвергаются действию эстераз, которые отщипляют жирные кислоты. Образуется глицерол фосфорилируется превращается в дигидроксиацетонфосфат и включается в гликолиз. Жирные кислоты из цитоплазмы перемещаются в митохондрии, где происходит их расщепление. В зависимости от необходимости клетки отщепляют одно, двух-, трех углеродные фрагменты. Но в большинстве случаев клетке требуется клетке 2-х углеродный фрагмент. Перемещение жирных кислот осуществляется в три этапа: рис 1.

Далее в матриксе осуществляется расщепление жирных кислоты на 2-х углеродные фрагменты: рис 2. Окисление ненасыщенных жирной кислоты включает 2 этапа: 1. Выравнивание конфигурации за счет переноса группы СО из цис- в трансположение. 2. Гидратация присоединение OH-группы по 2-й связи и далее обычно. Окисление жирной кислоты с нечетным числом атомов углерода, обычное расщепление 2-х углеродных фрагментов дает в конце пропионил СоА, он карбоксилируется и изомеризуется, происходит внутримолекулярная перестройка –образуется сукцинил СоА.

68. НАРУШЕНИЯ ОБМЕНА ЛИПИДОВ Патологические состояния, связанные с отклонениями от нормального режима протекания метаболических процессов с участием липидов, вызываются, в первую очередь, нарушениями их переваривания и всасывания в организме. Первым симптомом нарушения обмена липидов является стеанорея, т.е. появление липидов в кале. Различают 3 основных типа стеанореи: 1) панкреатогеннаястеанорея, которая обусловлена низкой скоростью синтеза панкреатической липазы, что, в свою очередь, приводит к снижению интенсивности гидролиза триацилглицеринов в кишечном соке; 2) гепатогенная стеанорея, которая связана с нарушением поступления желчи в двенадцатиперстную кишку, в результате чего не происходит эмульгирования жиров, а, следовательно, и их гидролиза липазой; 3) энтерогенная стеанорея, которая обусловлена снижением метаболической активности слизистой оболочки тонкого отдела кишечника, в котором происходит ресинтез липидов.Увелич-е концентрации липопротеинов в крови приводит к возникновению гиперлипопротеинемии, а понижение - к гипопротеинемии. Гиперлипопротеинемии обусловлены замедлением расщепления липопротеиновых комплексов вследствие недостаточности липопротеинлипазы или в результате гиперинсулинизма, индуцирующего в печени усиленный синтез триацилглицеринов из углеводов. Гиперлипопротеинемия наряду с гиперхолестеролемией (увеличением содержания в крови холестерина) является основной причиной атеросклероза. Гиполипопротеинемии связаны как с нарушением переваривания и всасывания жиров в тонком отделе кишечника в результате дефицита липазы, а также с нарушениями продукции и поступления желчи. Кроме того, увелич-е содерж-я тиреоидных гормонов (гипертиреоз) приводит к усилению катаболизма сывороточных липидов.При атеросклерозе (отложение холестерина в стенках артерий) в стенках сосудов (преимущественно крупных артерий) откладываются жиры и прорастает соединительная ткань. Такие очаги разрешения сосудов называются атеросклеротическими бляшками. Атеросклеротические бляшки являются причиной сужения просвета сосудов и деформации участка кровеносного сосуда, что в свою очередь приводит к нарушениям циркуляции крови во внутренних органах.Сфинголипидозы - врожденные нарушения метаболизма липидов, главным образомсфинголипидов , обусловленные отсутствием лизосомных ферментов , катализирующих процессы распада сфинголипидов.Основу молекуулярной структуры сфинголипидов составляет церамид - продукт соединения через аминогруппу аминоспиртасфингозина и жирной кислоты. Разнообразие сфинголипидов связано с присоединением к церамиду более простых молекулярных групп, главным образом гексоз.Сфинголипиды являются важнейшими структурными компонентами клеточных мембран, в частности миелиновых оболочек нервных волокон, поэтому нарушение постоянно протекающего в организме их обновления, их распада в лизосомах клеток создает патологическую картину поражения большинства жизненно важных органов, включая серое и белое вещества головного мозга. Дефекты деградации сфинголипидов связаны с недостаточностью соответствующих ферментов специфических для каждого типа сфинголипидов.
![]() 69.
БИОСИНТЕЗ ЖИРНЫХ КИСЛОТ. Биосинтез
жирных к-т и липидов играет важную роль
в жизнед-тиорг-мов. Именно в виде жирных
к-т и триацилглицериновотклад-ся основные
кол-ва энерг-х ресурсов орг-мов животных,
в то время как энергоресурсы, откладываемые
в форме углеводов, незначительны.В
клетках орг-зма жирные к-ты синтез-тся
из ацетил-КоА, образующегося из избыточной
глюкозы пищи, которая не была использована
организмом на энергетические нужды. В
качестве восстановителя в биосинтезе
жирных к-т принимает участие НАДФН,
синтезируемый, в основном, в пентофосфатном
пути распада углеводов. Нужно отметить,
что хотя все реакции β-окисления
жирных кислот обратимы, этот путь не
используется организмом с целью их
синтеза. Биосинтез жирных кислот
осуществляется в цитоплазме клеток и
катализируется целым полиферментным
надмолекулярным ансамблем -
пальмитилсинтетазой,
состоящей из семи ферментов.Суммарная
реакция биосинтеза жирных кислот в
цитоплазме имеет следующий вид (Е -
пальмитилсинтетаза):
69.
БИОСИНТЕЗ ЖИРНЫХ КИСЛОТ. Биосинтез
жирных к-т и липидов играет важную роль
в жизнед-тиорг-мов. Именно в виде жирных
к-т и триацилглицериновотклад-ся основные
кол-ва энерг-х ресурсов орг-мов животных,
в то время как энергоресурсы, откладываемые
в форме углеводов, незначительны.В
клетках орг-зма жирные к-ты синтез-тся
из ацетил-КоА, образующегося из избыточной
глюкозы пищи, которая не была использована
организмом на энергетические нужды. В
качестве восстановителя в биосинтезе
жирных к-т принимает участие НАДФН,
синтезируемый, в основном, в пентофосфатном
пути распада углеводов. Нужно отметить,
что хотя все реакции β-окисления
жирных кислот обратимы, этот путь не
используется организмом с целью их
синтеза. Биосинтез жирных кислот
осуществляется в цитоплазме клеток и
катализируется целым полиферментным
надмолекулярным ансамблем -
пальмитилсинтетазой,
состоящей из семи ферментов.Суммарная
реакция биосинтеза жирных кислот в
цитоплазме имеет следующий вид (Е -
пальмитилсинтетаза):
Из данного уравнения можно видеть, что для синтеза жирной кислоты требуется всего одна молекула ацетил-КоА, служащая «затравкой». Непосредственным источником синтеза является малонил-КоА, который образуется из ацетил-КоА по реакции:
![]()
Эта реакция катализируется биотинзависимым ферментом - ацетил-КоА- карбоксилазой. Функция биотина сводится к переносу диоксида углерода на субстрат.Пальмитилсинтетаза представляет собой многофункциональный ансамбль белков: в центре полиферментного ансамбля находится ацилпереносящий белок (АПБ), содержащий свободную SH-группу; шесть остальных ферментов располагаются по периметру, причем один из них также содержит SH- группу. Поэтому пальмитилсинтетазу можно обозначить как:
![]()
Процесс синтеза жирной кислоты описывается рядом последовательных реакций:1. Перенос ацетила с ацетил-КоА на синтетазу:

2. Перенос малонила с малонил-КоА на синтетазу:

3. Конденсация ацетила с малонилом и декарбоксилирование образовавшегося продукта:

4. Первое восстановление промежуточного продукта с участием НАДФН:

5. Дегидратация промежуточного продукта:

6. Второе восстановление промежуточного продукта с участием НАДФН:

Затем синтезированный бутирил перемещается на ту SH-группу, с которой был связан затравочный ацетил, а на освободившуюся SH-группу поступает новый малонильный остаток из малонил-КоА. Далее цикл повторяется снова; после семи оборотов цикла синтезируется пальмитил-Е, который при участии пальмитилдеацилазыгидролизуется до пальмитиновой кислоты и фермента (Е). Пальмитиновая кислота - это основной продукт биосинтеза, однако в небольших количествах могут образовываться и другие жирные кислоты.Жирные кислоты с разветвленной углеродной цепью синтезируются из продуктов метаболизма аминокислот с разветвленной цепью (валин, изолейцин и лейцин) через ацильные производные КоА путем удлинения цепи и при участии АПБ. Особенности биосинтеза полиненасыщенных жирных кислот представляют интерес в связи с их витаминоподобными функциями. Некоторые полиеновые кислоты могут синтезироваться из олеиновой кислоты с помощью ряда последовательных реакций. Однако, синтез полиненасыщенных кислот, содержащих двойные связи, расположенные между конечным метилом и седьмым атомом углерода, невозможен, поэтому они и являются незаменимыми в пищевом рационе.Т.о., биосинтез и поступление с пищей - два основных источника жирных кислот для организма человека и животных.Биосинтез триацилглицеринов. Образующиеся в результате биосинтеза жирные кислоты в организмах животных и человека в свободном виде встречаются лишь в незначительных количествах, а присутствуют главным образом в виде триацилглицеринов. Синтез триацилглицеринов происходит в печени и жировой ткани из КоА-производных жирных кислот через фосфатидную кислоту по реакции:

Фосфорилирование глицерина осуществляется глицеролкиназой за счет энергии АТФ. Глицерол-3-фосфат может образовываться и при восстановлении диоксиацетонфосфата.Гидролиз фосфатидной кислоты фосфатазой приводит к образованию 1,2-диацилглицерина, который, реагируя с другой молекулой ацил-КоА, образует нейтральный триацилглицерин.В слизистой кишечника триацилглицерины синтезируются из свободных кислот, моно- и диацилглицеринов, но эти процессы характерны только для слизистой оболочки кишечника. Перенос остатка жирной кислоты происходит через ацильноепроизводноеКоА.
70. Синтез кетоновых тел. Роль кетоновых тел. Биосинтез холестерина и его производных. Роль холестерина в организме. Кетоновые тела- способ транспорта ацетильной группы. К кетоновым телам относятся: ацетоацетат, 3- гидроксибутират и ацетон. Синтез ацетоацетата происходит в митохондриях печени. Затем он восстанавливается до 3- гидроксибутирата, либо расщепляется до ацетона. Далее все 3 соединения поступают в кровь и разносятся по тканям. Кетоновые тела выделяются с мочой. Кетоновые тела используются клетками всех тканей, за исключением эритроцитов и печени. Роль холестерина- в организме человека холестерин присутствует во всех клетках и тканях организма. С его участием происходят процессы выработки витамина D, стероидных гормонов коры надпочечников, женских и мужских половых гормонов, транспорт веществ через клеточные мембраны, поддерживается уровень воды в клетках. Продукты- яичный желток, печень, почки, икра, масло, сметана и др. жирные молочные продукты. Биосинтез холестерина- образование органического спирта холестерина. Синтез холестерина происходит в клетках печени, кишечнике и коже. Биосинтез холестер включает: Превращение трёх молекул активного ацетата в пятиуглеродный мевалонат. Превращение мевалоната в изопентенилпирофосфат. Образование тридцатиуглеродного изопреноида сквалена. Циклизация сквалена в ланостерин. Превращение ланостерина в холестерин.
71. Причины и типы гипо и гиперлипротеинемий. Атеросклероз,этапы атерогенеза. Функции холестерина в организме человека. Профилактика атеросклероза. Гиперлипротеинемия- повышенный уровень липидов в крови человека. Гиперлипопротеинемия I типа очень редка, резко усиливается после приема жира и снижается после строгого его ограничения. Клинические проявления возникают в возрасте до 10 лет; часто наблюдаются боли в животе, панкреатит, развитие атеросклероза не характерно. Гиперлипопротеинемия II типа составляет около 30% случаев гиперлипопротеинемий, связана со снижением катаболизма. Характерны образования желтых пятен в области ахиллова сухожилия, сухожилий разгибателей стоп и кистей. Гиполипопротеинемия- состояние, при котором понижено содержание жиров в крови. Увеличивается риск развития атеросклероза, нарушение всасывания жиров в кишечнике, плохой аппетит. Атеросклероз- хроническое заболевание, при котором периодически обостряется процесс повреждения сосудов, характеризующийся нарушением холестеринового обмена. Этапы атерогенеза: 1.Первичное повреждение эндотелия 2.Миграция моноцитов и Т-лимфоцитов 3.Активация тромбоцитов, пролиферация гладкомышечных клеток 4. Образование жировых полосок 5.Формирование атеросклеротических бляшек. Профилактика: Значительную роль в защите от угрозы атеросклероза играют женские половые гормоны эстрогены, способствующие уменьшению содержания в крови веществ, которые принимают участие в образовании опасных наростов на стенках сосудов. Поэтому риск развития атеросклероза у женщин возрастает после климакса. Атеросклероз может развиваться и в течении 10 лет, а может и быстро. Предотвратить быстрое развитие атеросклероза можно например теплыми ваннами из отваров, применением лекарствен препаратов растит. Происхождения, с витамином С, а также употребление петрушки, мяты, чеснока. Роль холестерина- в организме человека холестерин присутствует во всех клетках и тканях организма. С его участием происходят процессы выработки витамина D, стероидных гормонов коры надпочечников, женских и мужских половых гормонов, транспорт веществ через клеточные мембраны, поддерживается уровень воды в клетках.
72. Переваривание белков в ЖКТ Переваривание пищи начинается в ротовой полости,где ферменты L и B(бетта) амилазы отщепляют углеводные компаненты от сложных белков.Далее в желудке белки подвергаются действию HCL и пепсина.HCL выполняет следующие функции:-обеззараживает пищу, активирует профермент пепсиногена,превращая его в активный пепсин., способствует частичной денатурации белков,делая их более доступными для пепсина., обеспечивает оптимальный pH для действия пепсина.Пепсин синтезируется главными клетками желудочных желез в виде профермента пепсиногена.В полости желудка отщепляется 47 аминокислотных остатков с N конца и олбразуется активный пепсин,который далее сам активирует предшественник. Пепсин яв-сяэндопептидазой и расщепляют белки на более короткие момент.Далее пища поступает в тонкий кишечник,где нейтрализуется при помощи бикарбонатов,содержащихся в панкретаическом соке.В верхнем отделе тонкого кишечника на белки воздействует фермент трипсин, эластаза, химотрипсин.Предшественники этих ферментов синтезируются в поджелудочной железе и секретируются в просвет кишечника.Энтероциты секретируют фермент энтеропептидазу,активирующюю предшественники.В результате действия фермента образуются короткие полипетиды,на которые воздействует фермент карбоксидипептидаза,отщепляющий аминокислоты с «С» конца.Окончательное расщепление до аминокислот обеспечивает аминодипептидаза(отщепляет остатки с N конца). Всасывание и транспорт амин.к-т.Всас-е осущ-ся в тонк.кишкеmax концентр-я аминк-т в крови достигается ч/з 30-50 мин.после потреб-я белка.Энтероциты имеют 4 системы источн-ка для трансп-та аминк-т: 1.нейтральных ак-т,2.основных ак-т,3.кислыхак-т.4.для транспорта глицина и аминк-т(пролина и гидроксипролина).D-аминк-ты всасываются при помощи прост.диффузии.Работапереносщиков L-аминок-т требует затрат E и сопряж-но с деят-тьюNa+ K+ АТФазы. Мех-м напоминает всасывание глюкозы. Пример: симпорт с Na,затем удал-е Na из кл-киактивн.транспортом. В процессе уч-ет также витамин В6.Универсальным мех-змомтрансп-та аминк-т явл-ся гамма-глутамильныйцикл.В нем участ-ет 6 ферментов(1-мембрансвязанный,а остальные в цитозоли) и 3-пептидглутатион(гамма-глутанилцистеинилглицин). Ключевым ферментом яв-ся гамма-глутамилтранф-за, которая катализирует перенос глутамин-го остатка от глутатиола на переносимую к-ту.Образ-сяглутамил-аминок-та и цистиниилглицин.Они перенос-ся в цит-му,гдерасщ-ся ферм-ом глутамил-аминотрансферазой до свободной аминок-ты и 5-оксопролина. Одновременно происходит гидролиз дипептинаглутатион в ходе 3х послед-х р-ций,при этом затраг-ся 3 малекулы АТФ на 1 мал-луглутациона.В тонкой кишке в малом кол-ве могут всас-сяолигопептиды и некоторые нативныебелки.Этим об-сявозн-е аллерг-х р-ций поскольку антигенами могут быть только интактные белки. Всасываемыеаминок-ты попадают в портальный кровоток->печень->общ.кровоток.Наиболее интенсивно аминк-ты поглащ-ся печенью и почками,ткани мозга избирательно поглащают метионин, глетидин, глицин, оргинин,глутамин,тирозин(быстро);а так же медлено:лейцин,лизин,пролин.
73. Общие пути катаболизма аминокислот. Значение реакций дезаминирования, трансаминирования, декарбоксилирования. Диагностическое знаачение трансамилаз в сыворотке крови. Общие пути обмена аминокислот. Общие пути превращения аминокислот включают реакции дезаминирования, трансаминирования, декарбоксилирования, биосинтеза. Дезаминирование аминок-т. Первая стадия является ферментативной и завершается образованием неустойчивого промежуточного продукта, который на второй стадии в присутствии воды распадается на аммиак и α-кетокислоту. Трансаминирование аминокислот- реакции межмолекулярного переноса аминогруппы от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Реакции являются обратимыми и универсальными для всех живых организмов, протекают при участии специфических ферментов (аминофераз). Специфичность трансаминаз обеспечивается белковым компонентом. Ферменты трансаминирования катализируют перенос NH2-группы не на α-кетокислоту, а сначала на кофермент перидоксальфосфат. Образовавшееся промежуточное соединение подвергается внутримолекулярным превращениям, приводящим к освобождению α-кетокислоты и пиридоксаминфосфата; последний на второй стадии реакции реагирует с любой другой α-кетокислотой, это приводит к синтезу новой аминок-ты и освобождению пиридоксальфосфата. Декарбоксилирование аминокислот. Процесс отщепления карбоксильной группы аминокислот в виде СО2. Образующиеся продукты р-ции – биогенные амины – оказывают сильное фармакологическое действие на множество физиологических функций человека и животных. В живых организмах 4 типа декарбоксилирования аминокислот: 1. α-Декарбоксилирование, характерное для тканей животных; 2. ω-Декарбоксилирование, свойственное микроорганизмам. 3. Декарбоксилирование, связанное с реакцией трансаминирования. 4. Декарбоксилирование, связанное с реакцией конденсации двух молекул.
74. Окислительный катаболизм аминокислот: возможные пути расщепления углеводного скелета, утилизация аминного азота. Углеродные скелеты аминок-т обр-ся из продуктов обмена, аминогруппы вводятся путем прямого аминирования или трансаминирования, лишь немногие из аминок-т обр-ся в рез-те прямого аминирования свободными ионами NH4+. Из свободных аминокислот в цитоплазме количественно преобладает глутаминовая к-та(более 50% пула) Расщепление амин-т включает 2 типа реакций 1)Связанные с удалением и дальнейшим превращением аминогруппы (дезаминирование, переаминирование, включается в состав мочевины). 2)превращение углеродного скелета. Превращение углер. скелета в аэробных условиях приводят к соединениям, включающимся в ЦТК. Удаление аминогруппы происходит переаминированием. Аланин и аспартат обр-ся путем трансаминирования соответственно из пирувата и аксалоацетата.
Тирозин обр-ся при гидроксилировании фенилаланина, цистеин синтез-ся из метионина и серина в сложн. последовательности реакций с образованием в качестве промежуточных продуктов S-аденозилметионина и цистатеонина. Углеродн.скелет серина происходит от 3-фосфоглицерата. Серин явл-ся предшественником глицина;-углеродный атом серина переносится тетрагидропалатом,явл-ся переносчиком одноуглеродных групп. Конечные продукты, образующимся в рез-те катаболизма амин-ты делят на 3 гр: 1)Глюкогенные (аланин,аргинин,аспарагин,аспарагин.к-та,валин,глутамин.к-та, глицин, гистидин, метионин,пролин,серин,треонин,триптофан,цистеин) 2)Кетогенные (образуют кетоновые тела) лейцин,лизин,триптофан 3)Смешанные (кетогенные и глюкогенные)тирозин,фенилаланин. Сера с серосодержащих амин-т передается на др.серосодержащие амин-ты при их образовании с цистеина на цистеин или с метионина на метионин или отщепляются в виде SO4,из которого затем в цепи реакций возникают SO4 ,лишняя S выводится из организма с мочой в 3х формах: а)неорганические сульфаты 80%, б)сера в составе эфиров, в)органическая S в составе амин-т.Ароматические циклы расщепляются при действии оксидаз или передаются вновь синтезируемой амин-те. Повышение уровня трансаминаз в сыворотке крови отмечено при некоторых заболеваниях мышц, при обширных травмах и прогрессивной мышечной дистрофии.
75. Обмен одноуглеродных групп как способ углеродного скелета при биосинтезе аминокислот и нуклеотидов. Обмен серина, глицина и треонина. Углеродные скелеты аминок-т обр-ся из продуктов обмена, аминогруппы вводятся путем прямого аминирования или трансаминирования, лишь немногие из аминок-т обр-ся в рез-те прямого аминирования свободными ионами NH4+.В первичной ассимиляции аммиака участвуют L-глутаматдегидрогеназа,L-аланиндегидрогенеаза, кот.осуществ-ют восстановительное аминирование кетокислот без участия АТФ. Обр-ие глутамина из глутамата, катализируется глутаминсинтетазой при участии АТФ,фермент активен даже при низк.конц-ях NH4+.Большенство др.аминокислот получают аминогруппу в рез-те трансаминирования. Из свободных аминокислот в цитоплазме количественно преобладает глутаминовая к-та(более 50% пула).Аланин и аспартат обр-ся путем трансаминирования соответственно из пирувата и аксалоацетата. Тирозин обр-ся при гидроксилировании фенилаланина, цистеин синтез-ся из метионина и серина в сложн. последовательности реакций с образованием в качестве промежуточных продуктов S-аденозилметионина и цистатеонина.Углеродн.скелет серина происходит от 3-фосфоглицерата.Серин явл-ся предшественником глицина;-углеродный атом серина переносится тетрагидропалатом,явл-ся переносчиком одноуглеродных групп (метильная, формильная,гидроксиметильная). Аллостерич. регуляция биосинтеза аминокислот осущ.по принципу обратной связи, при этом регуляторным явл-ся первый фермент цепи реакций.

76. Обмен фенилаланина и тирозина. Фенилкетонурия. Фенилаланин – незаменимая к-та. Основной его путь превращения начинается с его гидроксилирования в тирозин. Реакция катализируется специфической фенилаланин-4-монооксигеназой, которая в качестве кофермента содержит тетрагидробиоптерин. Блокирование этой реакции приводит к развитию тяжелой наследственной болезни – фенилкетонурии (фенилпировиноградная олигофрения). В процессе трансаминирования тирозин превращается в n-оксифенилпировиноградную кислоту, которая под действием специфической оксидазы подвергается окислению, декарбоксилированию, гидроксилированию и внутримолекулярному перемещению боковой цепи с образованием гомогентизиновой кислоты; эта реакция требует присутствия аскорбиновой к-ты, роль которой пока не выяснена. Дальнейшее превращение гомогентизиновой кислоты в малеилацетоуксусную к-ту катализируется оксидазой гомогентизиновой кислоты. Малеилацетоуксусная к-та под действием специфической изомеразы в присутствии глутатиона превращается в фумарилацетоуксусную к-ту, подвергающуюся гидролизу с образованием фумаровой и ацетоуксусной кислот. Фенилаланин и тирозин являются также предшественниками меланинов. Фенилкетонурия - наследственное заболевание, в основе которого лежит аномалия аминокислотного обмена вследствие отсутствия или резкого снижения активности фермента фенилаланингидроксилазы. Фермент сохраняет только около 5% активности, в связи с чем нарушается обмен фенилаланина и вследствие этого – тирозина, триптофана и др., накапливаются промежуточные продукты обмена – фенилэтиламин, фенилпировиноградная кислота и др. и возникает дефицит метаболитов, необходимых для нормального функционирования организма. Фенилкетонурия проявляется выраженной олигофренией (идиотией или имбецильностью). Диагностируется в первые дни жизни ребёнка с помощью микробиологических или биохимических методов.
77. Метаболизм метионина. Метионин – незаменимая аминок-та, которая не синтезируется в орг-зме ч-ка. Поэтому метионин должен постоянно поступать в орг-зм вместе с пищей. Метионин входит в состав белка. В метаболизме роль метионина связана с тем, что она содержит подвижную метильную группу (-СНз), которая может передаваться на другие соединения. Способностью метионина отдавать метильную группу обусловлен его липотропный эффект (удаление из печени избытка жира). Отдавая подвижную метильную группу, метионин способствует синтезу холина, с недостаточным образованием которого связаны нарушение синтеза фосфолипидов из жиров и отложение в печени нейтрального жира. Метионин участвует в синтезе адреналина, креатина и других биологически важных соединений; активирует действие гормонов, витаминов (В 12 , аскорбиновой и фолиевой кислот), ферментов. Если нарушается метаболизм, то организм человека «теряет равновесие», что неотвратимо приводит к расстройствам и заболеваниям. Путем метилирования (отдачи -CH3-группы) метионин обезвреживает токсичные продукты. Применяют метионин для лечения и предупреждения заболеваний и токсических поражений печени, а также при хроническом алкоголизме, сахарном диабете и др. Эффект более выражен при жировой инфильтрации клеток печени. При вирусном гепатите применять метионин не рекомендуется. Метионин назначают для лечения дистрофии, возникающей в результате белковой недостаточности у детей и взрослых после дизентерии и других хронических инфекционных заболеваний. Метионин способствует снижению содержания холестерина в крови, уменьшению отложения жира в печени и улучшению функции печени, может оказывать умеренное антидепрессивное действие.
78. Метаболизм гистидина. Дезаминирование гистидина происходит в печени и коже под действием фермента гистидазы с образованием уроканиновой к-ты, которая затем в печени превращается в имидазолонпропионовую к-ту под действием уроканиназы. Дальнейшее превращение в ходе серии р-ций имидазолонпропионовой кислоты приводит к образованию аммиака, глутамата и одноуглеродного фрагмента, соединённого с тетрагидофолиевой кислотой. Реакция декарбоксилирования гистидина имеет большое физиологическое значение, так как является источником образования биологически активного вещества — гистамина, который играет важную роль в процессе воспаления и развития некоторых аллергических р-ций. Декарбоксилирование происходит большей частью в тучных клетках соединительной ткани практически всех органов. Эта р-ция протекает при участии фермента гистидиндекарбоксилазы. Известно связанное с дефектом гистидиназы наследственное заболевание гистидинемия, при котором характерно повышенное содержание гистидина в тканях и задержка умственного и физического развития.
79. Биогенные амины. Явл. продуктами декарбоксилирования аминок-т и обладают повышенной биолог. активностью. К группе относятся многие нейромедиаторы: 1)гамма-аминомаслянная кислота-образ-ся при декарбоксилировании глутаминовой к-ты (ферм. – глутамандекарбоксилаза, коферм.- передоксальфосфат). Основное место синтеза-ткань головного мозга, главный тормозный медиатор в ЦНС, вызывает гиперполяризацию постсинаптической мембраны вследствие обратного транспорта ионов CL и накопл-е в клетке Са. Поэтому сигнал от возбуждающегося нерва не достигает порогового уровня. Распад гамма-аминомаслянной к-ты происходит в рез-те переаминирования с альфа-кетоглутарата, т.к. образуется сукцинат и глутамат. Тормозным медиатором в спинном мозге и в стволе-глицин(антагонист стрихнин). 2)Гистамин образ-ся при декарбоксилировании гистидина, катализируемого специфической декарбоксилазой. Основное место синтеза –тучные клетки, в которых он находится в виде белково-гистаминового комплекса. Освобожд-ся при действии спец. факторов (либераторов). Гистамин активирует секрецию пепсиногена и НCL в слизистой желудка и является сильным сосудорасширяющим агентом и медиатором аллергических реакций. В большых кол-вах освобождается из ДЕПО при травматическом шоке и зоне воспаления, распадается под действием диаминооксидазы. 3)Серотонин образ-ся из триптофана, при гидроксилировании, (фермент триптофан-5-моно-оксигеназа), (кофермент-тетрагидроптередин).С последующим декарбоксилированием образ-ся с нейронами гипоталамуса и ствола мозга и явл. медиатором этих нейронов. Сильный сосудосуживающий агент, повышает свертываемость крови. Разруш-ся моноаминооксидазой, образ-ся оксиэндолилуксусная к-та, которая выводится из орг-ма с мочой. 4)Дофамин производное тирозина. Под действием тирозиназы тирозин гидроксилируется до 3,4-диоксифенилаланина(ДОФА) . ДОФА декарбоксилир-ся до дофамина (в почках, надпочечниках, в симпатических ганглиях и нервах).Медиатор ингибированного типа одного из проводящих путей (в черной субстанции верхнего отдела ствола мозга и в полосатом теле явл-ся предшественником меланина, норадреналина и адреналина. 5)Норадреналин Медиатор в постганглионарных волокнах симпатической нервной системы, активирует аденилациназу. Это приводит к увеличению уровня синтеза циклической АМФ и активации протеинкиназ, что повышает активность ферментов в клетке. Образ-ся при гидроксилировании ДОФА при помощи фермента дофамин-бета-монооксикеназы, также как и адреналин явл-ся гормоном надпочечников. 6)Адреналин образуется в рез-те азотметилированного норадреналина, (фермент-фенилэтанолфолин-азот-метилтрансфераза),усиливает мобилизацию гликогена. 7)Таурин образ-ся из цистеина, синтезируется во многих органах и тканях, выполняет медиаторную ф-цию на уровне синапсов. Участвует в образовании коньюгированных жирных к-т.
81. Общие принципы обмена аминок-т. Нарушение обмена белков и аминок-т .Белковая недостат-ть развив-ся у ч-ка как при полном, так и при частичном голодании, так и при приеме однообразных белков в питании. Когда в диете преоблад. растит. белки - биологич.ценность которых ниже животных белков, результат-отриц. азотистый баланс (кол-во поступающего азота меньше кол-ва выводимого из орг-ма). Гипопротеинемии (понижение концентрации белков в сыворотке до 30-50гр/л. Нарушение коллоидно-осмотического и водно-солевого обмена(развитие отеков). При тяжелых формах пицеварительной дистрофии наблюдается поражение печени, остановка роста, резкое снижение иммуного столбца, отечность, атомия м-ц. При белковой недостаточности резко понижается интенсивность процессов дезаминирования, трансаминирование и биосинтез аминок-т, а также активность цикла мочевины в печени из-за недостаточного синтеза нужных ферментов, следует аминоацидурия до 10-20 г/сутки (в норме 1г в сутки), повышение концентрации свободных аминок-т в крови и снижение экскреции мочевины .Увелич-ся уровень распада белков. Гипераминоацидурия делится на 1)почечную (связана с приобретенным или врожденным дефектом реабсорбции аминок-т в почки ); 2)Внепочечную (связана с повышенной концентрацией аминок-т в крови). Причины почечной аминоацидурии служат -Хронич. нефрит, нефрозы, наследств.заболевания такие как цистиноз (врожден.нарушение реабсорбции почти всех аминокислот-повыш-е в 5-10 раз экскреции всех аминок-т в 20-30 раз цистина и цистеина, отложении цистина в клетках РЭС, селезенки, печени и роговицы глаза) и цистинурия( наруш-е реабсорбции и повышения выведения мочой цистина, аргинина, лизина, орнитина в 50 раз, повыш-ся вероятность образования камней в почках.Некоторые энзимопатии
|
Заболевание |
фермент |
|
альбинизм |
Тирозин-3-монооксигеназа |
|
алкаптонурия |
Гомогентизат-1,2-диоксигеназа |
|
оргининосукцинатацидемия |
Оргинино-сукцинат лиаза |
|
гомоцистинурия |
Цистотиамин-бета-синтаза |
|
Болезнь Клинового сиропа(лейциноз) |
Дегидрогеназа альфа-кетокислот с развлетвленной цепью |
|
Фенилкетонурия |
Фенилаланин-4-монооксигеназа |
|
гипервалинемия |
Валинтрансаминаза |
Аминокислоты широко используются в современной фармакологии. Являясь не только структурными элементами белков и других соединений, они имеют большое значение. Некоторые из них выступают в качестве нейромедиаторных веществ (глутаминовая, аспарагиновая кислоты, глицин, таурин, Ag -аминомасляная кислота и др.). Фенилаланин и тирозин являются предшественниками в биосинтезе дофамина, норадреналина, адреналина; триптофан — предшественником серотонина; гистидин — предшественником гистамина. Производными аминокислот являются энкефалины, эндорфины, динорфины и другие нейропептиды, а также высвобождающие факторы(рилизинг-факторы) гипоталамуса, гормоны гипофиза и т. д. Некоторые аминокислоты (глутаминовая, Ag -аминомасляная, метионин, глицин и др.) нашли самостоятельное применение в качестве лекарственных средств. Расширяется круг новых лекарственных препаратов, синтезируемых с использованием остатков аминокислот (см. Даларгин, Каптоприл, Тимоген и др.). Специальное значение имеют смеси аминокислот, используемые в качестве средств для парентерального питания.
83. Реутилизация пуриновых оснований. Гиперурикемия. Синдром Леша-Нихана. Подагра, причины и сущность заболевания принципы лечения. Реутилизация пуриновых оснований- процесс повторного их использования. Актуален в быстрорастущих тканях, когда активно идет процесс синтеза нуклеин.к-т и недопустима потеря их предшественников. Сущ-ет 2 способа реутилизации: 1способ- заключается в присоединении рибозо-5-фосфата к свобод.основаниям гуанину, аденину или гипоксантину с образованием АМФ, ГМФ или ИМФ

2 способ: реутилизируются пуриновые рибонуклеозиды или дезоксирибонуклеозиды. Для этого сущ-ет фермент аденозинкиназа и дезоксицитидинкиназа. Гиперурекимия-повышенное содержание моч.к-ты в крови.
Причиной такого повышения яв-ся 2 фактора: нарушение выведения почками мочевой кислоты- почечная гиперурекимия; избыточное её образование-обменная гиперурекимия. Гиперурекимия вызывается: ускоренным образованием моч.к-ты из-за участия пурина в обмене в-в; из-за ослабленной работы почек; из-за повышенного содержания фруктозы в пище. Гиперурекимия также вызывает голодание и потребление высококалорийной пищи. Одним из способов лечения яв-ся потребление пищевой соды-она понижает содержание кислотной мочи. Синдром Леша-Нихана. Сопровождается проявлением подагры. Основной фактор-дефект гипоксантина, гуанига, фосфорибозилтрансферазы,катализир.превращением гипоксантина и гуанина в инозинмонофосфат и ГМФ. При этом гуанин и гипоксантин превращаются в мочев.к-ту и не испол-ся повторно в синтезе мононуклеотидов. Заболев-е отмечается у лиц мужского пола. Характерным признаком болезни являются аутоагрессивные действия. Диагноз синдрома Лёша-Нихена ставится по трём элементам: повышенная продукция мочевой к-ты, неврологическая дисфункция, поведенческие нарушения. Подозрения могут возникнуть из-за задержки развития, сопровождающейся гиперурикемией. Также, возможно образование камней в почках (нефролитиаз) или наличие крови в моче (гематурия). Зачастую подозрения на синдром Лёша-Нихена возникают с появлением наносимых самому себе ранений у больного. Подагра -это болезнь обмена веществ, при котором соли мочевой кислоты(ураты) откладываются в суставах. Обусловлена 3 факторами: Повышением синтеза мочев к-ты; Снижением содержания в плазме урат связывающих белков; Уменьшением ренальной фильтрации и соответственно замедлением выведения моч к-ты. В развитии подагры 4 стадии: 1)Бессимптомная гиперурекимия - повышенное содержание мочевой кислоты в крови без каких-либо признаков отложения кристаллов . 2)Острый приступ - развивается обычно через несколько лет бессимптомной гиперурикемии; 3)Стадия межприступной подагры-чередование 1 и 2 стадии. Приступы становятся более тяжелыми, захватывают «новые» суставы. Наблюдается воспаление связок, суставных сумок, часто образуются единичные, обычно безболезненные тофусы. 4)Хроническая тофусная подагра-характеризуется наличием тофусов, хронического артрита, поражением почек, нефролитиазом. Тофусы локализуются обычно подкожно или внутрикожно в области пальцев кистей и стоп, коленных и локтевых суставов, на ушных раковинах. Над тофусами кожа может изъязвляться с выделением содержимого в виде пастообразной белой массы. При подагре возрастает частота сахарного диабета, атеросклеротического поражения сосудов. Лечение: противовоспалительные препараты (индометацин,аллопуринол); снизить содержание мочевой кислоты в крови; потребление адекватного объема жидкости; исключение приема лекарственных препаратов, повышающих уровень мочевой кислоты в крови (в первую очередь диуретиков); Диетотерапия- исключение из рациона пищевых продуктов, содержащих большое количество пуринов!
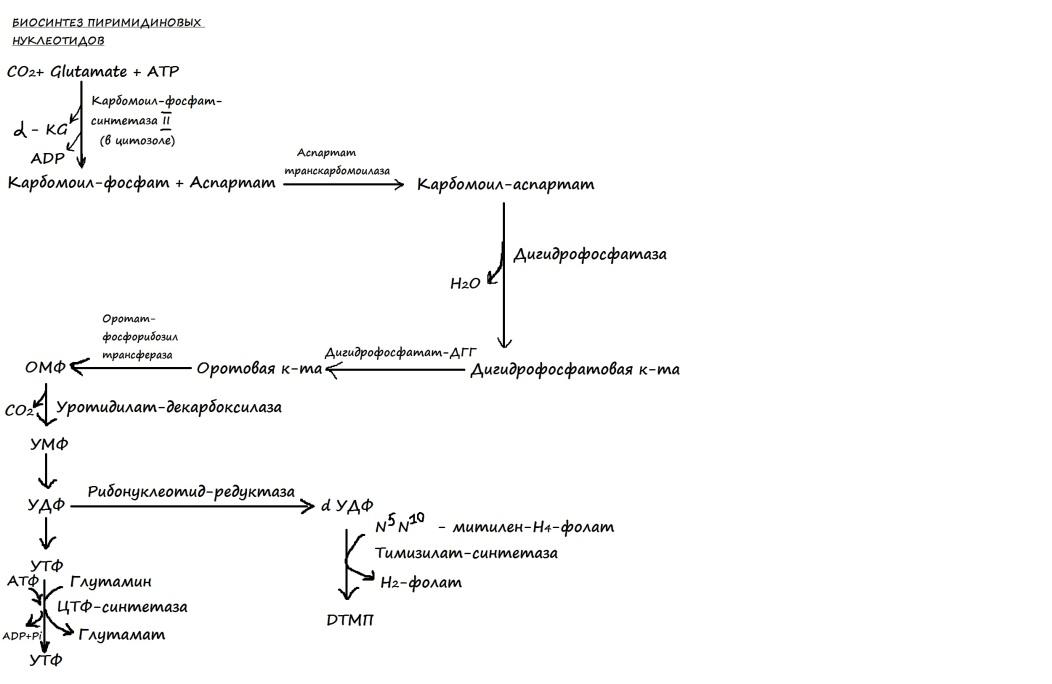
84. Биосинтез и распад пиримидиновых нуклеотидов: этапы, регуляция. Оротацидурия. Биосинтез. Исходным соединением в синтезе пиримидиновых нукл-в явл. карбамоилфосфат, который конденсируясь с аспарагиновой кислотой образует карбамоил-аспарагиновую к-ту, возникающую при замыкании цикла и последовательном окислении оротат реагирует с фофорибозилпирофосфатом, образуя оротидиловую к-ту. Декарбоксилирование оротидилата дает уридилат, который далее превращается в уридил-3-фосфат. Присоединение аминогруппы от глутамина приводит к образованию цитидин-3-фосфата.Скорость биосинтетических реакций регулируется на уровне первой реакции. Регулятором служит фермент аспартаттранскарбамоилаза. Тимидиновые нукл-ды образуются из дезоксидилмонофосфата при помощи тимидилатсинтетазы. Распад. Распад пиримидинов протекает по одному из нескольких механизмов, обнаруженных у разных видов организмов. Например, у человека реализуется такой механизм, который включает дефосфорилирование и отщепление углеводного компонента от нуклеотидов с образованием тимина или урацила; затем происходит восстановление тимина или урацила с образованием полностью гидрированного гетероцикла. Расщепление цитозина происходит аналогично после того, как он дезаминируется в урацил. Раскрытие кольца в промежуточном продукте приводит к образованию карбомоил-аланина, который далее гидролизуется до СО2, NH3 и β-аланина. Все продукты либо выводятся из организма, либо повторно утилизируются в других метаболических процессах. Например, β-аланин может повторно быть использован в биосинтезе кофермента А. Нарушение обмена пиримидиновых нуклеотидов проявляется в виде наследственного заболевания-оротацидурии. С мочой выделяется оротовая к-та в кол-ве превышающем норму. Причина: дефицит дегидрогеназы. Происходит накопление оротата и в результате наблюдается недостаточность пиримидина=>отставание физического и умственного развития. Лечение: устранение пиримидиновой недостаточности путём введения уридина.
85. Биосинтез декарбоксирибонуклеотидов. Дезоксирибонуклеотиды обр-ся из рибонуклеотидов за счет восст-я остатка рибозы. донором протонов и электронов служит низкомолекулярный белок тироредуксин. Ингибиторы синтеза дезоксирибонуклеотидов тормозят деление клетки. Дезоксирибонуклеотиды образ-ся из рибонеклеотидов, за счет восстановл-я остатка рибозы: донором протонов и электронов служит тиоредоксин (содержит в SH группе), после окисления вновь восст-ся при помощи НАДФН(Н+). Общий путь синтеза: ХДФ-> дХДФ-> дХТФ. Исключение дезокси ТТФ, который образ-ся из УДФ. УДФ-> дезокси УДФ-> дезокси УТФ-> дезокси УМФ-> дезокси ТНФ-> дезокси ТДФ-> дезокси ТТФ. Синтез дезоксирибонукл-в в покоящих клетках минимален. Его активация набл-ся на стадиях, предшествующих делению кл.ингибиторы синтеза дезоксирибонукл-в тормозят репликацию и деление клетки.
86. Биосинтез тимидиловых нуклеотидов. Тимидиловые нуклеотиды входят в состав ДНК, содержащей дезоксирибозу. При помощи метода меченых атомов было показано, что этот синтез начинается не со свободнойдезоксирибозы, а путем прямого восстановления рибонуклеотидов у 2-го атома углерода. Химический смысл превращения рибонуклеотидов в дезоксирибо-нуклеотиды сводится к элементарному акту – восстановлению рибозы в 2-дезоксирибозу, требующему наличия двух атомов водорода. Непосредственным источником оказался восстановленный термостабильный белок тиоредоксин, содержащий две свободные SH-группы. Тиоредоксин легко окисляется, превращаясь в дисульфидную S-S-форму.
87.Пути регуляция активности ферментов.Метаболическая регуляция. Регуляция активности ферментов-ферменты являются регулируемыми катализаторами. В качестве регуляторов могут выступать метаболиты, яды. Различают:- активаторы – вещества, увеличивающие скорость реакции; - ингибиторы – вещества, уменьшающие скорость реакции. Активация ферментов. Различные активаторы могут связываться либо с активным центром фермента, либо вне его. К группе активаторов, влияющих на активный центр, относятся: ионы металла, коферменты, сами субстраты. Активация с помощью металлов протекает по различным механизмам: металл входит в состав каталитического участка активного центра; металл с субстратом образуют комплекс; за счет металла образуется мосты между субстратом и активным центром фермента. Субстраты также являются активаторами. При увеличении концентрации субстрата скорость реакции повышается. По достижению концентрации насыщения субстрата эта скорость не изменяется. Синтез ферментов, контролирующих скорость метаболических путей, может изменяться под действием гормонов. Поскольку в этом случае происходит синтез новых белковых молекул, изменение активности происходит сравнительно медленно и чаще всего в ответ на изменение количества и состава поступающей пищи. Гормоны могут действовать как индукторы или репрессоры синтеза мРНК в ядре или как стимуляторы стадии трансляции белкового синтеза на уровне рибосом.
88. Гормональная регуляция метаболизма. Понятия о гормонах, их биологическое значение. Классификация гормонов. Для нормального функционирования многоклеточного организма необходима взаимосвязь между отдельными клетками, тканями и органами. Эту взаимосвязь осуществляют 4 основные системы регуляции: ЦНС и ПНС, эндокринная и паракринная системы, иммунная система через белки. Регуляторными механизмами метаболизма в разных органах, являются гормоны, а также низкомолекулярные белковые соединения – цитокины- они синтезируются в процессе иммунитета, действуют как факторы роста. Все гормоны классифицируют по химическому строению, биологическим функциям и механизму действия. По хим. строению гормоны делят на 3 группы: пептидные-белковые (адренокортикотропный, соматотропонин, тиреотропный, окситоцин), стероидные (альдостерон, кортизол, прогестерон) и непептидные (адреналин, норадреналин, тироксин). По биологич-м функциям. Инсулин, кортизол, соматотропонин- регулируют обмен углеводов,аминокис-т. Альдостерон- водно-солевой обмен. Тропные гормоны- синтез щитовидки.
89. Роль гормонов в обеспечении межклеточной сигнализации. Трансмембранная передача сигналов в клетке. Мембранные и внутриклеточные рецепторы. Сигнал передается ч/з жидкие среды организма (кровь, лимфу, межклеточную жидкость). Это гуморальная система связи. Иначе она называется эндокринная сигнализация. Эндокринные клетки выделяют гормоны. Гормон - Это химические вещ-ва, служащие сигналами для других клеток, расположенных на расстоянии. При получении сигнала клетки изменяют режим функционирования. Эндокринные клетки обычно собраны в специальные железы и выделяют гормоны во внеклеточную жид-ть, окружающую все клетки в тканях. Гормоны с кровотоком разносятся по всему телу. Реакция на него будет только тогда, когда он будет захвачен рецептором клетки, специфически для этого предназначенным. При его приеме происходит запуск определенного специфического процесса, который и приводит к корректировке работы организма. Работа эндокринных желез построена по системе каскада. Центральный сигнал приводит к запуску процессов через систему эндокринных желез. Гормоны в крови и в межклеточной жид-ти очень сильно разбавляются и способны действовать в чрезвычайно низких концентрациях. Несмотря на широкий спектр гормонов, продуцируемых эндокринной системой, все рецепторы на основании их локализации можно разделить па две обширные группы: 1) мембранные или поверхностные и 2) внутриклеточные рецепторы. Мембранные рецепторы располагаются в плазматической мембране клетки-мишени и взаимодействуют с белково-пептидными гормонами и катехоламинами. Внутриклеточные рецепторы находятся внутри клетки и взаимодействуют со стероидными и тиреоидпыми гормонами, которые представляют собой небольшие липофильные молекулы, с легкостью проникающие в клетку через плазматическую мембрану.
90. Механизмы действия пептидных гормонов. Роль и виды вторичных посредников. Пептидные гормоны – это водораствор. гормоны, вырабатываемые железами внутренней секреции для контроля различных функций организма. Кортиколиберин- в гипоталамусе, кортикотропин- в коре надпочечников. Соматостатин - в поджелудоч. железе и гипоталамусе. Инсулин- в поджелудоч. железе, участв в регуляции уровня сахара в крови. Тиреотропонин- в перед доле гипофиза, в щитовидке, повышает йод. Эритропоэтин- в почках, в печени, стимулир. образование эритроцитов. Выделяют 3 вида вторич. посредников: 1.циклические нуклеотиды- Цамф- участвует в действии кортикотропонина, дофамина, адреналина, гистамина, глюкагона. Повыш. содержание стимулирует распад молекул, усиливает секрецию HCL в желудке. 2. Метаболиты фосфатидилинозитола- связаны фосфолипазой С. Сущ-ет два вторич. посредника- инозитол-1,4,5-трифосфат и 1,2-диацилглицерол-активирует протеинкиназу С- ее длительная активация нарушает рост и деление клеток. 3. Ионы Ca- связывается с белком кальмодулином- активирует мембранную АТФазу, которая откачив. кальций из цитозоля.
91. Структура, ф-ции и мех-зм действия стероидных гормонов. Исх. соединением явл ацитил КоА. 1 этап: синтез мевалоновой к-ты. Ацитил КоА –> ацитоацитил КоА -> В-окси-В-митилглутарил КоА -> меволоновая к-та. Синтез мевалоновой к-ты происх.в цитоплазм. Она явл предш-ком для синтеза изопреноидов, витаминов А и К, убихинона, фитола. 2 этап: образ-е активного изопрена и его последовательная конденсация в сквален . При этом происх.замыкание в циклическую структуру типа циклопентанпергидрофенантрен. В этих реакциях затрачивается НАД(Н+), ф-ция происходит в цитоплазме без участия О2. 3 этап: превращение сквалена в холестерин. В ходе этих р-ций происх.дальнейшая циклизация в стероидную структуру и отщепление СО2. Р-ции идут на поверх-ти ЭПР. Образовавшийся холестерин может транспортир-ся в митохондрии и там превращ-ся в первичную и вторичную желчн.к-ты (фолиевую, холановую, хенодезоксихолевую, гликохолевую и таурохолевую). 4 этап: синтез стероидн.гормонов происх.в ЭПР. Холестерин превр-ся в прогестерон, а прогестерон синтезир-ся в глюкокартикоиды и минералкортикоиды. Муж. Половые гормоны синтезир-ся из прогестерона под действием индивидуальных гидроксилаз, из тестостерона синтезир-ся эстрон и вся группа жен.половых гормонов. Катаболизм гормонов. Белково-пептидные гормоны подвергаются протеолизу, распадаются до отдельных аминок-т. Эти аминок-ты вступают в р-ции дезаминирования, декарбоксилирования, трансаминирования и распадаются до конечных продуктов: NH3, CO2 и Н2О.
92. Гормоны гипоталамуса: Кортиколиберин (стимулир. образование трофина и кортикотрофина), тириолиберин (стимулирует секрецию пролактина и териотропина), соматолиберин (ингибирует секрецию гормона роста и териотропина), пролактостатин (ингибирует выделение пролактина), меланолиберин (стимулир.секрецию меланоцит-стимулирующего гормона), гонадолиберин (стимулир-т образование лютропина и фоллитропина), пролактолиберин (способствует выделению пролактина), меланостатин (ингибир-т секрецию меланоцит-стимулирующего гормона). Нейроны гипоталамуса синтез-ют гормоны и секретир-т их в капиллярн.сеть, доставляющую гормоны к клеткам гипофиза, где они в свою очередь тормозят или стимулир-т синтез тропных гормонов. Либерины действуют на кл.гипофиза с 7-ТМС рецепторами с реализацией аденилатциклазной системы или инозитолтрифосфатного мех-зма.
93. Гормоны гипофиза. Гормоны аденогипофиза: соматотропин (стимулир-т рост орг-ма, синтез белка в клетках, образ-е глюкозы и распад липидов), пролактин (регулир-т лактацию млекопит-х, инстинкт выхаживания потомства, дифференцировка различных тканей), тириотропин ( регулир-т биосинтез и секрецию гормонов щ/ж-зы), кортикотропин (регулир-т секрецию коры надпочечников), фолликуло- стимулирующий гормон (оказывает действие на фолликулы и кл.Лейдига, действию лютоинизирующего гормона, стимулир-т сперматогенез), лютоинизирующий гормон (регулир-т синтез жен.и муж.половых гормонов, стимулир-т рост и созревание фолликулов, овуляцию, образ-е и функционирование желтого тела яичника). Гормоны задн.доли гипофиза: окситоцин и вазопрессин принято считать гормонами задн.доли, хотя они образ-ся и секретир-ся нейронами гипоталамуса. Вазопрессин обеспечив-т сохранение воды в организме, стимулируя ее реабсобцию почечных канальцев. Окситоцин увелич-т сокращ-е матки во время родов, стимулир-т лактацию, регулирующую поведенческую активность связанную с беременностью, лактацией и уходом за потомством. Главными стимулами в освобождении окситоцина явл эстрогены и нервные импульсы, возникающие при раздражении грудных сосков. Прогестерон ингибир-т продукцию окситоцина.юУ мужщин окситоцин стимулир-т семявыносящие протоки, влияет на половую активность. Недостаточность вазопрессина – удельный вес мочи низкий.т.к. большое кол-во глюкозы не выдел-ся с мочой.
94. Регуляция водно-солевого обмена . Нарушение ВСО.В его регуляции приним.участие такие гормоны как: антидиуретический (вазопрессин), альдостерон,атрионатрийуретический,ренин-ангеотензивная система.При регуляции используются 2 принципа:1.регуляция осмотического давления 2.регуляция объема жидкости.Вазопрессин вырабатывается в гипоталамусе. Воздействия:1.увеличение реабсорбции воды в канальц.аппарате 2.вызывает сужение сосудов,особенно артериол и капилляров 3.уменьшает диурез и вызывает жажду. Вазопрессин-пептидный гормон,второй посредник циклический АМФ,он снижает осмотическое давление,но оно же влияет на реабсорбцию Na и Cl.Сигналом для синтеза явл повышен. осмотич. давление, при этом вырабатыв.рецепторы в гипоталамусе,где и синтез-ся вазопрессин.Далее он перемещается в заднюю долю гипофиза,где запас-ся в виде гранул и синтезируется по мере надобности.Атрионатрий уретический гормон образуется в клетках Пуркинье сердечой мышцы.Он действует подобно вазопрессину,способствует выведению Na,изменении клубочковой фильтрации. Нарушения водно-солевого обмена (ВСО) Они бывают: 1.Нарушения баланса (не соответствие м/д поступл-ем и вывед-ем), 2.Нарушения распределения (м\д внеклет-ым и внутрикл-ым пространством). В зависимости от содержания жид. в орг-ме и осматич. давления плазмы (ОДП) различают 6 состояний связанных с увеличением кол-ва внекл. жид-ти (гипергидратация) и его уменьшением (дегидратация): 1. Гипертонич. дегидратация: абсолютный или преобладающий дефицит жид-ти с повышением ОДП (потеря жид-ти, пневмония); 2. Гипотонич. дегидратация: дефицит воды и растворенных в ней в-в с понижением ОДП (хронич. пиелонефрит, прием дистил. воды); 3. Изотонич. дегидратация: дефицит воды и растворенных в ней в-в при норм. ОДП (рвота, диарея, кишечн. непроходимость, кровопотеря, ожоги, прием диуретиков); 4. Гипертонич. гипергидратация: избыток воды и растворенных в-в с повышением ОДП, клетки обезвоживаются с потерей калия (причины: параэнтеральное введение изотонич. или гипертонич. р-ров при недостаточности ф-ий почек, питье морской воды); 5. Изотонич. гепергидратация: избыток воды и растворенных в-в при норм. ОДП, появл-ся переферич. отеки, происходит задержка Na, гиперальдостраниум (причины: чрезмерное введение р-ров при заболев-х почек, цирроз печени с асцитом); 6. Гипотонич. гипергидратация: пересыщение водой с понижением ОДП (причины: чрезмерное введение ж-ти или безсолевых р-ов сахаров, безсолевая диета, прим-е диуретиков. Нарушения могут быть вызваны гормональным дисбалансом, наруш-м всасывания ионов в ЖКТ, наруш-я соотношений фильтрации реобсорбции и секреции ионов в почках.
95. Гормональная регуляция мочеобразования. На работу почек оказывают влияние многие гормоны, главными из которых являются антидиуретический гормон (АДГ), или вазопрессин, и альдостерон. Антидиуретический гормон (АДГ), или вазопрессин, способствует реабсорбции воды в дистальных отделах нефрона путем увеличения проницаемости для воды стенок дистальных извитых канальцев и собирательных трубочек. Мех-зм действия АДГ заключается в активации фермента аденилатциклазы, который участвует в образовании цАМФ из АТФ. При избытке АДГ может наступить полное прекращение мочеобразования. Уменьшение секреции АДГ вызывает развитие тяж. заболевания несахарного диабета. При этом заболевании выделяется большое кол-во светлой мочи с незначительной относительной плотностью. АДГ имеет важное значение в поддержании осмотического давления крови. Альдостерон увелич-т реабсорбцию ионов натрия и секрецию ионов калия и водорода клетками почечных канальцев. Одновременно возрастает реабсорбция воды, которая всасывается пассивно по осмотическому градиенту, что приводит к уменьшению диуреза. Гормон уменьшает реабсорбцию кальция и магния в проксимальных отделах канальцев. Натрийуретический гормон усиливает выведение ионов натрия с мочой. Паратгормон стимулирует реабсорбцию кальция и тормозит реабсорбцию фосфатов. Кальцитонин тормозит реабсорбцию кальция и фосфата. Адреналин суживает просвет выносящих артериол, в результате чего повышается гидростатическое давление, увеличиваются фильтрация и диурез. Инсулин. Недостаток этого гормона приводит к гипергликемии, глюкозурии, увеличению осмотического давления мочи и увеличению диуреза. Тироксин усиливает обменные процессы, в рез-те возрастает кол-во осмотически активных веществ, что приводит к увеличению диуреза. Простагландины угнетают реабсорбцию натрия, стимулируют кровоток в мозговом веществе почки, увеличивают диурез.
96. Регуляция обмена углеводов в организме. Все эти обмены связаны м/д собой ч/з промежуточные продукты. Так, при расщпл-ии гл-зы образ ацетил-коА который далее может использ-ся для синтеза жирных к-т и липидов, а также аминок-т и белков. Т.о. стимул распада углеводов вызывает активацию синтеза белков и жиров. Активация гликолиза или распада аминок-т может стимулир-ть глюконеогенез. Следоват-но обмен углеводов ,белков и жиров регул-т один и тот же набор гормонов. 1)Соматотропный гормон (анаболический, усиливает приток в клетку амикнок-т, и увел. синтез белка). Он действ-т липолетически. Высвобождающиеся жирн.к-ты использ-ся как источник углерода и Е для синтеза белков, увелич. чувств-тьадипоцитов к липолетическому действию катехоламинов. Действие СПГ на углев. обмен, явл бимодальным: может действ-ть на Б-клетки подж/ж-зы и стимул-т секрецию инсулина. Т.о. в 1 фазу наблюд-ся инсулиноподобное действие на углеводн. обмен, во 2 фазу гормон явл контринсулярным; распад и захват гл-зы тормозится, запуск-ся глюконеогенез стимулир-ся гликолиз(диабетическое действие). 2)Глюкокартикоиды (кортизол, кортикостероиды). Кортизол стимулир. в печени глюконогенез, тормозит транспорт гл-зы и ее утилизацию, повыш-т ее концентр-ю в крови. Глюкокортикоиды стимул-т расщепления белков, катаболически действ-т на м-цы, лимф ткань, кожу и кости. У картизола липолетическое действие, что повыш-т концентр-ю свобод-х жир к-т, тормозится утилизация гл-зы и липогенез. Секреция кортикостероидов регул-ся гипофизарным гормоном АКТГ. Глюкортикоиды снижают имунный статус, ослабляют клеточн. иммунитет, блокир-ся высвобождение цитокина и тормозят все воспал. процессы. 3)Гормоны щитов/ж-зы. Усилив общий обмен в-в, увел потребл-е кислорода, Т3 –стимул-т все этапы обмена углеводов: всасыв-е в ЖКТ гликогенолиз, глюконеогенез в печени, жир-й тк. и в мышцах , поддерж-т гликолиз, способствуют липогенезу печени. 4)Инсулин пониж концентрацию гл-зы в крови и явл запасающ гормоном в орг-ме. Инсулин ингибирует гормон чувствит-ю липазу, высвобождающиеся жир к-ты накаплив-ся в печени в составе триглицерина ,что и объясн-т ожирение печени при сахарн. диабте, сниж-ся бета-окисление, повыш-ся синтез жиров. 5)амилин- пептидный гормон (37 аминок-т), синтез-ся в Б-клетках с инсулином и имеет сходный мех-зм секреции (стимулир-ся глюкозой), замедл-сяпоступл-е гл-зы в кровь после приема пищи и подавляет секрецию глюкагона. 6)глюкагон-явл.прямым антагонистом инсулина в печени и частично в жировой ткани. Синтез-ся в А-клетках островков Лангерганса. Выдел-ся при поддержании концентрации глюкозы в крови, обеспечив. снабжение ткани, особенно мозга глюкозой и кетоновыми телами. 7)Катехоламины - индуцируют расщепл-е гликогена в печени и мышцах. Способствуют глюконеогенезу в печени ,стимулир-т липолиз в жировой ткани и протеолиз в печени. Угнетают секрецию инсулина, тормозят все инсулин зависимые процессы, повыш-ся уровень гл-зы в крови. Гипергликемия - симптом, обозначающий увеличение содержания глюкозы в сыворотке крови по сравнению с нормой в 3,3—5,5 ммоль/л. Гипогликемия - состояние, при котором содержание сахара (глюкозы) в крови ниже нормы.
97. Гормональная регуляция обмена углеводов, белков и жиров. Все эти обмены связаны м/д собой ч/з промежуточные продукты. Так, при расщпл-ии гл-зы образ ацетил-коА который далее может использ-ся для синтеза жирных к-т и липидов, а также аминок-т и белков. Т.о. стимул распада углеводов вызывает активацию синтеза белков и жиров. Активация гликолиза или распада аминок-т может стимулир-ть глюконеогенез. Следоват-но обмен углеводов ,белков и жиров регул-т один и тот же набор гормонов. 1)Соматотропный гормон (анаболический,усиливает приток в клетку амикнок-т, и увел. синтез белка). Его недостаток во взрослом состоянии влияет на развитие атеросклероза ,на мышцы, распределение жира, жировой обмен. Он действ-т липолетически. Высвобождающиеся жирн.к-ты использ-ся как источник углерода и Е для синтеза белков, н увелич. Чувств-ть адипоцитов к липолетическому действию катехоламинов. Действие СПГ на углев. обмен, явл бимодальным: может действ-ть на Б-клетки подж/ж-зы и стимул-т секрецию инсулина. Т.о. в 1 фазу наблюд-ся инсулиноподобное действие на углеводн.обмен, во 2 фазу гормон явл контринсулярным; распад и захват гл-зы тормозится, запуск-ся глюконеогенез. Стимулир-ся гликолиз(диабетическое действие). 2)Глюкокартикоиды (кортизол, кортикостероиды). Кортизол составл 95% глюкокортикоидн актив-ти. Они стимулир. в печени глюконогенез, тормозят транспорт гл-зы и ее утилизацию, повыш-т ее концентр-ю в крови. Глюкокортикоиды стимул-т расщепления белков, катаболически действ-т на м-цы, лимф ткань, кожу и кости. Образующиеся аминок-ты вовлекаются в глюконеогенез печени. У картизола липолетическое действие, что повыш-т концентр-ю свобод-х жир к-т, тормозится утилизация гл-зы и липогенез. Секреция кортикостероидов регул-ся гипофизарным гормоном АКТГ. Глюкортикоиды снижают имунный статус, ослабляют клеточн. Иммунитет, блокир-ся высвобождение цитокина и тормозят все воспал. процессы. 3)Гормоны щитов/ж-зы. Усилив общий обмен в-в, увел потребл-е кислорода, Т3 –стимул-т все этапы обмена углеводов: всасыв-е в ЖКТ гликогенолиз, глюконеогенез в печени, жир-й тк. и в мышцах , дополн-но поддерж-т гликолиз, способствуют липогенезу печени). 4)Инсулин пониж концентрацию гл-зы в крови и явл запасающ гормоном в орг-ме. В печени из главных эффектов явл.активации глюкокиназы, актив-ся фосфофруктокиназа и гликогенсинтетаза. Ингибир-ся ферменты расщепления гликогена (фосфорилазы), в мышцах инсулин активирует транспорт гл-зы. Нервн. клетки не зависят от инсулина, что и объясняет гликогликемический шок (0,5-0,2 г/л при норме 0,8-1 г/л) . Инсулин ингибирует гормон чувствит-ю липазу, высвобождающиеся жир к-ты накаплив-ся в печени в составе триглицерина ,что и объясн-т ожирение печени при сахарн. диабте, сниж-ся бета-окисление, повыш-ся синтез жиров. Побочный эффект – стимуляция транспорта аминок-т. Отдаленый эффект – повышение уровня транскрипции ферментов, катализирующих распад гл-зы. 5)амилин- пептидный гормон (37 аминок-т), синтез-ся в Б-клетках с инсулином и имеет сходный мех-зм секреции (стимулир-ся глюкозой), замедл-ся поступл-е гл-зы в кровь после приема пищи и подавляет секрецию глюкагона. 6)глюкагон-явл.прямым антагонистом инсулина в печени и частично в жировой ткани. Синтез-ся в А-клетках островков Лангерганса. Выдел-ся при поддержании концентрации глюкозы в крови, обеспечив. снабжение ткани, особенно мозга глюкозой и кетоновыми телами. Мех-зм действия аденилатцеклазой системы явл кетогенным и гипергликемическим гормоном, активирует гликогенфосфорилазу, ингибирует глюкогенсинтетазу, активирует глюконеогенез, стимулир-т бета-окисл-е в печени и жировой ткани. 7)Катехоламины - индуцируют расщепл-е гликогена в печени и мышцах. Способствуют глюконеогенезу в печени ,стимулир-т липолиз в жировой ткани и протеолиз в печени. Угнетают секрецию инсулина, тормозят все инсулин зависимые процессы, повыш-ся уровень гл-зы в крови.
98.Гормоны щитовидной ж-зы и паражитовидных желез. Синтезир-ся главные клетки из аминок-т тирозина, поступают строем по многичеслен.капиллярам, образующим сеть вокруг скопления тиреоцитов. В тироцитах происходит синтез тироглобулина-белка предшеств. Тироциты поглощают йод. Тиреоглобулин перемещается в полость фолликула. Там происходит йодирование остатков тирозина и образование монойодтиронина и дийодтиронина. Затем происходит перенос одного йодированного остатка на другой. В таком виде белок образует коллоид и накапливается в фолликуле. По мере необходимости из коллоида захватывается часть белкового комплекса и путем эндоцитоза переносится в лизосомы, в котор. происходит отщепление йодированных остатков и образование активных форм гормона. Активная форма транспортируется в капилляры, секретируется в кровоток и присоединяется к транспортному тиронин-связывающему белку.Гормоны щит. ж-зы необходимы для норм.развития человека. Действие гормонов щ/ ж-зы. В перината/льном периоде-формируется НС и скелет. В перинатальном и постнатальном периоде: 1.Увелич-е потребления О2 в тканях, кроме мозга, селезенки и яичек. 2.Регул-я деятельности дых.центра. 3.Стимул-я эритропоэза. 4. Повыш-е теплопродукции. 5. Положит-е хронотропное действие на миокард(отриц. действует на фермент АТФазу, обычно перекачивающий Na из клетки,а H-в клетку. Вследствие обратного тока иона происходит накопл-е Ca в клетке, активация сокращения, сужение комплекса УРСТ на ЭКГ. 6. Повыш-е чувствительности к котехоламинам. 7. Повыш-е кол-ва котехолов. Рецепторов в организме. 8. Повыш-е оборота костной ткани(стимуляция и реабсорбция и образование кости). 9. Стимулирует функцию желтого тела(поддержание беременности на ранних сроках). Синтез гормонов щ/ж-зы регулируется при помощи гипоталамо-гипофизар. системы. В гипоталамусе синтез-ся тиреоглобулин,перемещаемый при помощи гипоталам-аденогипофизарной трансп-та в переднюю долю гипофиза,где активируется синтез тиреотропонина. Он с кровью перемещается к тироцитам и активирует синтез Т3 и Т4. Секреция териолибирина регул-ся по мех-зму отрицательнообратной связи. Гипотиреоз - заболевание, возникающее, в результате недостаточного обеспечения органов и тканей гормонами щитовидной железы из-за снижения уровня продукции тиреоидных гормонов. Различают первичный (при поражении щитовидной железы) и вторичный (при поражении гипофиза и/или гипоталамуса) гипотиреоз. Симптомы: снижение АД, отечность кожи, снижение аппетита, бледное лицо, нарушение нервн.системы. Гипертиреоз или тиреотоксикоз – это синдром, вызванный гиперфункцией щитовидной железы, т.е. избыточной выработкой тиреоидных гормонов. Симптомы: истонченная, потливая кожа; одышка, выпячивание глазн.яблока, расстройства ЖКТ, учащенное мочеиспускание. Гормоны паращитовидных желез: паратгормон и кальцитонин. Кальцитонин - одноцепочный полипептид, содержащий 32 аминокислотных остатка. Секреция зависит от концентрации кальция в крови. Мишень гормона – костная ткань. Посредник действия – кальцийзависимая АТФаза. Через нее гормон изменяет работу кальциевого насоса. Кальцитонин понижает концентрацию кальция в крови, подавляя его выход из костной ткани. Паратгормон - одноцепочный полипептид, состоящий из 84 аминокислотных остатков. Мишени гормона – почки, костная ткань, ЖКТ. Гормон понижает содержание фосфора и повышает содержание кальция в крови, способствует высвобождению кальция из костной ткани.
99. Половые гормоны: биосинтез, регуляция биосинтеза. Половой цикл. Половые гормоны - Это гормоны гонад. Главные ф-ции гонад – синтез гормонов и обр-е половых кл. Ф-ции пол.гормонов: 1)регул-я гаметогенеза, 2)регул-я развития вторичных половых признаков, 3)половая диф-ка, 4)регул-я анаболич-х процессов. В яичниках обр-ся яйцекл-ки и жен. пол. Гормоны (ЖПГ) – эстрогены и прогестероны(прогестин – гормон желт. тела), а в семенниках – сперматозоиды и муж. пол. гормоны – андрогены. Андрогены синтез-ся клетками Лейдига в интерстиц-й тк. Кровь содержит как муж, так и ЖПГ, но в разных соотн-х у муж и жен. У муж-н с момента рожд-я до 1 года преоблад-т тестостерон, затем их синтез прекр-ся и начин-ся синтез-ся андростерон. В период пол.созр-я способность семенников синтез-ть тестостерон восст-=ся и до конца жизни он явл основным МПГ. Если во время созревания плода половая диф-ка осущ-сь по жен.типу, то с периода пол.созревания возн-т цикл-ть выработки гормнов. Эстрадиол – синтез-ся в созревшем фолликуле яичника, а прогестерон в желт.теле и плаценте. Совместное действие этих гормонов регул-т половой цикл у жен-н. Синтез и секреция пол.гормонов регул-ся при помощи сложной системы отриц.обратн. связи. В гипоталамусе синтез-ся гонадолибирины (люлибирин и фолибирин) котрые влияя на гипофиз активир-т синтез гонадотропных гормонов: 1)фолликулостимулир-й гормон – гликопротеид, состоящий из 2 субъед-ц. Его синтез в аденогипофизе стимул-ся фоллибирином, ингиб-ся эстрагенами (отрицат. обратная связь). Мишени: у жен-н -яичники, где он инициирует развитие фолликулов, клетки внутр-го слоя которых начин-т продуцировать эстрагены. У муж-н – семенники, где он стимул-т развитие эпителия семявыносящих протоков, появл-е большого числа сперматоцитов на всех стадиях развития, включая зрелые (стимул-я сперматогенеза). 2)Лютеинизирующих гормон – гликопротеид. Состоящий из 2 субъед-ц. Синтез актив-ся люлиберином и тормоз-ся по принципу обратной связи прогестерона. Мишени: у жен-н - зрелый фолликул (графов пузырек), ЛГ обеспечив.окончат-е созр-е, овуляцию и обр-е желт тела. У муж-н -клетки Лейдига, где ЛГ стимул-т обр-е тестостерона и семенники, где он стимул-т рост интерстиц-х клеток. Кроме фолликулостимул-го и лютоинизирующего??? гормонов. К гонадотропным гормонам относят пролактин и хорионич-й гонадотропин (ХГЧ). Т.о. синтез тестестерона актив-ся ЛГ, а тормоз-ся прогистероном, который отриц-но действует на синтез люлиберина. Синтиез эстрадиола ктив-ся фолликулостимул-м гормоном, а тормоз-ся эстрагенами (в том числе с самим эстрадиолом по мех-зму отриц.обратн.связи за счет послед-го тормож-я синтеза ФСГ и фолибирина). Синтез прогестерона актив-ся и ФСГ и ЛГ, а тормоз-ся прогестероном по мех-зму отриц. обратн. связи, за счет торможения синтеза ЛГ в гипофизе и люлиберина в гипоталамусе. Регул-я полового цикла. У жен-н уровень секреции образ-ся в яичниках стероидов меняется в различных фазах менстр-го цикла и зависит от скорости их обр-я в яичниках. Менстр-й цикл (МЦ) обусл-ся сложным взаимодействием гипоталамуса, гипофиза и яичниками. В норме продолж-ть цикла от 30-35 дней ( в ср 28 дней). Его подразд-т на: 1)фолликулярную фазу, 2)лютеинизирующая фаза, 3)менструация. 1 фаза- происх-т рост фолликула, стимулируя ФСГ и ЛГ. Рост осущ-ся под влиянием ФСГ, фолликул синтез-т эстрадиол, который в свою очередь по мех-зму полож. обратн. связи стимулир-т синтез и массированную секрецию ЛГ и переходит к след-й фазе. Содерж-е прогестерона очень мало. 2 фаза после овуляции клетки- гранулезы лопнувшего фолликула лютеиниз-ся и обр-т желтое тело, которое синтез-т прогестерон - основной гормон этой фазы и эстрадиол. Прогестерон необх-м для формир-я эндометрия, обесп-х нужное условие для развития имплантирующего бластоциста. До имплантации интенс-ть синтеза прогестерона желт тела обеспеч-ся за счет действия ЛГ, а если имплантация произошла, то дальнейший стимул прогестерона стимул-ся гормоном плаценты ХГЧ. ХГЧ поддерж-т синтез прогестерона желт тела, до тех пор, пока плацента сама не начнет синтез-ть большое кол-во прогестеронов. При отсутствии имплантации желт тело деградир-т и наступает 3 фаза – менструация. После отторж-я эндометрия наступает нов. цикл, разруш-е пол. гормонов происх-т в печени (обр-ся гидроксистероиды), продукты распада удал-ся с мочой, тестостерон превр-ся в андростерон, эстрадиол в эстрол, прогестерон в прегнандиол.
100. Роль кальция (Са) в процессах жизнед-ти. Регуляция обмена Са и фосфатов. Нарушение обмена Са и фосфатов. Орган-зм взросл. чел. содержит примерно 1 кг. Са, из кот. 99% входит в состав скелета, во внеклет. жид-ти 20-20,5 ммоль Са. Скорость обмена м/д костн. тк.и внеклет. жид-ю 500 ммоль/сут. Min сут. потреб-ть 12,5 ммоль/сут, увел-ся период роста, беремен.и лактации. Ф-ии: 1. Структурная( кости, зубы), входит в сост. гидроксиаппатита для формир-я кости необх-ма секретируемая остеобластами-щелочная фосфатаза, отщепляющая фосфат от пирофосфата. Кости – основное депо Са. 2. Нейромышечная: контроль возбуд-ти, выделение нейромедиаторов, инициация и эффективность мыш. сокращения. 3. Фемент-ая: кофактор фермента свертываемости крови. 4. Сигнальная: внутрикл. вторичн. посредник, разобщитель дых-я и окислительного фосфорилирования. Регуляция конц-ии Са и фосфатов происх-т при помощи 3 гормонов: паратгормонов, кальцитриола, кальцитонина. Паратгормон синтез-ся кл-ми паращит. ж-зы в ответ на снижение конц-ии плазмы в крови. Мишенью действия этого гормона явл. кости и канальц. аппарат почек. В костях он стимул-т мобилиз-ю Са, действуя на остеобласты. В прям. отделе проксим-го канальца паратерин снижает реобсорбцию Са и Na, за пределами проксим. канальца реасорбц. Са усил-ся. Действие паратерина: 1.Кости: а)быстрое высвобожд-е Са; б)остеобластная резорбция. Рез-т: повыш-ая. конц. Са в плазме. 2. Почки: а)повыш-ая реабсорбц. Са. Следствие : повыш-ие Са в плазме; б)сниж-ие реабсорбц. фосфата. Следствие: снижение фосфата в плазме; в)сниж-е реабсорбц. декарбонатов. Следствие: ацидоз. Синергистом паратгормонов явл. кальцитриол, мишени те же. В костях стимул-ся обр-ие гидроксиаппатита в канальцах усил-ся реабсорбц. Са, стимул-ся всасывание из ЖКТ. Рез-т: повыш-е конц-ии Са и фосфатов в плазме. Антагонист кальцитомин, синтез-й парафоликул. кл. щит. ж-зы. В костях способствует транспорту Са из крови в кости. В почках тормозит реабсорбцию и увелич. Вывед-е Са. Активирует остеоциты, всасыв-е фосфатов в кнальцевом аппарате, тормозится паратерином и кальцитомином. Усиливаетс кальцитриолом соматотропином. Наруш-я обмена Са и фосфатов. Наиболее частой причиной гиперкальциимии явл. первичный гиперпаратериоз, вызванный аденомой гиперплозией паращитовидных желез, а так же злокач-е новообраз-я с метастазами в кости и без них, включая миелому. Др. причины- саркоидоз, передоз-ка вит.Д или его производных. Гипокальциимия вызывает гипервозбудимость мыш. волокон и нервов, что приводит к спазму м-ц, а в тяжелых случаях- судорога. Причиной гиперкальциимии явл.недост-ть вит Д и гипопаратериоз. Дефицит витамина Д может вызвать нарушения всасывания и может иметь алиментарную причину усиленную недостатком солн. освещения(сниж-ся синтез витамина). Недостаток вит.Д приводит к остеомаляции у взрослых и рахиту у детей(наруш. минерализации костн. тк.), у пожилых болезнь Педжита- значит усиление резорбции кости, стимуляция обр-ия нов. костн. тк, имеющую аномальную структуру. Следствие: деформация костей, патологические переломы.
101. Простаноиды: биосинтез, влияние на обменные процессы и физиологическую функцию внутренних органов, применение в медицине. Простаноиды- группа высокоактивных веществ-регуляторов короткодистанционного действия, синтезируемых из арахидоновой кислоты при участии фермента циклооксигеназы. Биосинтез простаноида из арахидоновой кислоты осуществляется двумя ферментами: 1.простагландин – Н синтаза (циклооксигеназа)- осуществляет синтез промежуточного простагландина Н2. 2. простагландин-Н-конвертазы. В группу простаноидов входят простагландины, тромбоксанами, простациклины. Они способны изменять активность ферментов, влиять на синтез гормонов и корректировать их действие на различные органы и ткани. В тканях дыхательных путей образуются простагландины F2 и E2, в плазме и сыворотке крови обычно содержатся все простагландины- поддерживают тонус сосудов и АД, необходимый кровоток в сердце, мозге, почках, легких. Также обнаруживаются в мозговой ткани, в ЦНС. Применение в медицине. простагландины E2 и F2 - для стимуляции родовой деятельности и прерывания беременности. Также простоглан. Применяют для лечения сердечно-сосудистых заболеваний, некоторых форм бронхиальной астмы. Наиболее яркое применение в медицине находит простагландин E1- он блокирует агрегацию тромбоцитов- первую стадию ССЗ: инфарктов, инсультов.
102. Биохимические процессы обеспечивающие мочеобразование. Регуляция мочеобразовательной функции. Нарушения, причины, проявления. Особенности биохимии почек. Мочеобразование - процесс образования мочи в почках. Этапы: 1)Фильтрация-образование первичной мочи в результате фильтрации плазмы крови сквозь почечные клубочки. Давление в капсуле немного выше, чем в сосуде. 2)Реарбсорбция. Фильтрат проходит через стенки почечных каналов и отдает большую часть воды, аминокислоты и др. вещества 3)Канальцевая секреция-образование конечной мочи. 4)Регуляторно-гомеостатическая - поддержание водно-солевого баланса, регул-я кислотно-щелочного равновесия, содержания электролитов, препятствие превышению нормы количества воды. Гормон-я регуляция: 1)Клубочковая фильтрация а)увеличив (простагландины,атриопептид,прогестерон,глюкокортикоиды,окситоцин,глюкагон,Т3,Т4,паратерин б)уменьш.(вазопрессин,ангиотензин,норадреналин,адреналин,лейкотриены) 2)канальцевая реарбсорция а)увелич (вазопрессин,пролактин,ангиотензин-2, инсулин, эстрагены, хорионич.гонадотропин б)уменьш (простагландины, атриопептид, кинины, паратерин) Потере воды способствуют: прогестерон, простагландины, кинины). Задержке воды способств-ют: вазопрессин, хореонический гонадотропин, ангиотензин-2. Нарушение клубочковой фильтрации: снижение (причины: пониж-е фильтрац-го давления при гипотензивных состояниях, ишемии почки); уменьш.площади клубочкового фильтрата (при некрозе почки, миеломной болезни); Снижение прониц-ти фильтрационного; Увеличение клубочковой фильтрации (причины: повышение фильтрационного давления , увелич.проницаемости фильтрационного). Основной функцией почек является выведение из организма воды и водорастворимых веществ. Кроме того, почки выполняют эндокринную функцию, принимая непосредственное участие в синтезе многих , участвуют в процессах промежуточного метаболизма, особенно в глюконеогенезе и расщеплении пептидов и аминокислот.
103. Общие свойства мочи (кол-во, цвет, плотность, реакция) изменение при патологии. Основные химические компоненты мочи,их возможные изменения при заболеваниях. Факторы, способствующие образованию мочевых камней. Диурез - кол-во мочи, выделяемой за сутки взрослым здоровым человеком, колеблется от 1000 до 2000 мл. Полиурия - состояние, при котором диурез превышает 2 л, отмечается при обильном питье, сахарном и несахарном диабете и у больных нефросклерозом. Олигоурия - выделении за сутки менее 500 мл. Анурия, или полное отсутствие выделения мочи, наблюдается при тяжелых поражениях почек, острой почечной недостаточности. Изменение как объема, так и состава мочи также может сопровождать переохлаждение и физическое или психическое перенапряжение. Относительная плотность мочи (удельный вес) определяется концентрацией находящейся в ней элементов (белка, глюкозы, мочевины, солей натрия и т.д.). Реакция мочи (рН) определяется с использованием индикаторных тест-полосок. У здоровых людей она составляет 5,00—7,00. Белок в моче Обнаруживается у больных с поражениями почек или мочевыводящих путей. При резком повышении проницаемости почечного фильтра концентрация белка в моче возрастает (это называется протеинурией). По количеству белка в суточной моче различают три степени протеинурии: слабо выраженную, умеренную, выраженную. Глюкоза в моче. Ее выявляют при потреблении избыточных количеств углеводов с пищей. Появление глюкозы в моче — глюкозурия - нарушение работы ряда эндокринных органов: например, инсулярного аппарата поджелудочной железы (сахарный диабет) или щитовидной железы (базедова болезнь). Содержание пигментов в моче. Билирубин. Появляется в случаях механической желтухи и воспалительных процессов в печени. Уробилин. В свеже выпущенной моче содержится уроби-линоген, при стоянии превращающийся в уробилин. Камни мочевых путей образ-ся из кристаллов солей щавелевой кислоты, Са3(РО4), MgNН4РО4, СаСО3, мочевой кислоты, цистина. Факторы: обезвоживание, инфекции мочевыводящ.путей, щелочная моча, гиперурикозурия, гиперксалурия, застой мочи.
104. Кровь, составные компоненты, ф-ции и их хар-ка. КРОВЬ - жид-ть, циркулирующая в кровеносной системе и переносящая газы и др. растворенные вещества, необходимые для метаболизма. Состоит из плазмы и клеточных элементов (эритроциты, лейкоциты и тромбоциты). Хар-ка белков плазмы: 1) преальбумины – выполн.транспортную ф-цию (тирозин, ретинол). Норм конц-я 0,18-0,37 г/л сыворотки. 2) альбумины – главный класс транспортных белков (ионы, гормоны. Свободные жирн.к-ты, стероиды, лек.в-ва). Норм конц-я 37-55 г/л. 3) α-глобулины: а) α-антитрепсин – ингибитор ряда протеиназ, в том числе каллекреина и плазмина. Обеспечив-т около 90% антитрепсинной активности. Норм конц-я 2-5 г/л. б) α-гликопротеин –обеспеч-т транспорт прогестерона и тестостерона. Норм конц-я 0,5-1,4 г/л. 4) α2- глобулины: а) α2 – макроглобулин - цинк- содержащий белок, ингибитор протеиназ, в том числе плазмина и тромбина. Синтезир-ся вне печени. Норм конц-я 1,5-4,2 г/л. б)гаптоглобин – сложный белок, состоящий из 2 субъединиц по 4 полипептидной цепи в каждой. Связывает и транспортирует свободн.гемоглобин-А в клетках ретикула эндотелиальной системы. Норм конц-я 0-0,35 г/л. в) церулоплазмин – медь-содержащий белок, имеет голубую окраску, проявляет оксидазную активность. Превращ-т железо из активной формы Fe2+ в в транспортную и запасающую Fe3+, что обеспечив-т транспорт ж-зом, трансферином. Норм конц-я 0,25-0,45 г/л. 5) β-глобулины: а) трансферин – обеспечив-т транспорт железа. В норм условиях железом насыщено 1/3 белка. Норм конц-я 2-4 г/л. б) гемопексин – обеспечив-т транспорт свободного гема, порфиринов, связывающих гемин-содержащие хромопротеиды (гемоглобин, миоглобин, каталазу), и транспортирует их в клетки res-печени, что снижает потерю ж-за. Ф-ции крови: дыхат-я (транспорт O2 и Co2), трофическая (обеспеч-т все клетки орг-зма питат-ми веществами), транспортная (транспортирует газы и питательные вещ-ва), терморегуляторная (охлаждает внутр.органы и переносит тепло к органам теплоотдачи), поддержание и регуляция ВСО, поддержание кислотно-основного состояния, осуществление креаторных связей (связь м/д органами и тканями), гуморальная – доставка гормонов, пептидов, ионов и др. вещ-в от мест их синтеза к клеткам орг-зма, гомеостатическая – поддержание постоянства внутр. среды орг-зма.
105. Характеристика белковых фракций крови. Содержание альбумина 35-50 г/л, глобулина 20-30 г/л. По форме молекулы это глобулярные белки. Альбумины растворимы как в воде, так и в солевых растворах. Глобулины плохо растворимы в воде, но хорошо в солевых растворах. Методы разделения белков:1. Высаливание – разделение на основе различной растворимости альбуминов и глобулинов. Осаждение белков обычно производят сульфатом аммония (NH4)2SO4. В насыщенном растворе этого реактива осаждаются альбумины, а в полунасыщенном – глобулины. 2. Электрофорез – разделение белков при движении в электрическом поле за счет разности их заряда. Основные белки сыворотки крови делятся на несколько фракций. Глобулины делятся на 4 фракции. В крови определяется общий белок. Проламины и глютелины. Это основные растительные белки. Они не растворяются ни в водных растворах, ни в свободном этаноле, но растворяются в 65% растворе этанола. Протеиноиды. Они не растворяются ни в воде, ни в солевых растворах. Это фибриллярные белки опорных тканей. Входят в состав сухожилий, костной, хрящевой тканей и др. К ним относятся: кератины – белки волос, ногтей; коллагены – белки соединительной ткани; эластины – белки, входящие в состав связок. Белковый состав крови: Функции белков крови: 1. поддерживают онкотическое давление; 2. определяют вязкость плазмы крови; 3. определяют устойчивость форменных элементов в кровотоке; 4. участвуют в поддержании кислотно-щелочного равновесия, образуя белковую буферную систему; 5. транспортируют метаболиты, биорегуляторы, микроэлементы, ксенобиотики;6. участвуют в регуляции гемостаза, являясь компонентами свертывающей и противосвертывающей систем; 7. участвуют в реакциях иммунитета; 8. являются резервом аминокислот. Общий белок. В норме общий белок крови 65-85 г/л. Общий белок – это сумма всех белковых веществ крови.Альбумины.В норме 35-50 г/л. Глобулины в норме 20-30 г/л.
107. Синтез гемоглобина и его регуляция. Нормальные и аномальные формы гемоглобина. Гемоглобинопатии, порфирии. Трансферрины и ферритин. Биосинтез гема (простетич.группа гемоглобина) предшественник порфобилиноген, ферменты, учавствующие в биосинтезе гемма локализованы в печени, костном мозге, слиз. кишечника, почках. Далее 4 молек. Порфобилиногена конденсируются ,образуется уропорфириноген 3.Он подвергается пятикратному окислению и двукратному декарбоксилированию-формир-ся протопорфирин 9.Затем в молекулу протопорфирина9 включается ион железа и образ-ся гем. Регуляция: реакцию синтеза гема катализирует пиридоксальзависимый фермент аминолевулинатсинтаза. Аллостерическим ингибитором и корепрессором синтеза аминолевулинатсинтазы является гем. Нормальные формы гемоглобина: HbP(примитивный, встречается в эмбрионе) HbF(фетальный,появл-ся ч/з 12 недель внутриутробного развития) HbA(98%,появл-ся ч/з 3 месяца жизни) HbA2(2%) HbО2(оксигемоглобин) HbCO2(карбгемоглобин).Аномальные:HbS(гемоглобин серповидноклеточной анемии) MedHb(метгемоглобин) Hb-СО (карбоксигемоглобин) HbA1c(гликозилированный). Гемоглобинопатии – наследственные изменения структуры какой-либо цепи нормального гемоглобина вследствие точечных мутаций генов (серповидноклеточная анемия,гемоглобин-М). Порфирии - это группа наследственных заболеваний, обусловленных нарушениями синтеза гема с повышением содержания промежуточных продуктов порфиринов в крови и тканях.Трансферрин-гликопротеин плазмы крови,имеет 2 центра связывания железа,функция-перенос железа с током кровик местам депонирования и использования.Ферритин-крупный белок,содержит 24 протомера.В оболочке имеется 6каналов ч/з которые проникают ионы железа,образуя железное ядро.Функция-депонирование железа.
108. Современные представления о механизмах свертывания крови и фибринолиза. Причины и проявления гемофилий и тромбозов, принципы лечения. Процесс свертывания крови проходит в 5 этапов, участвует 13плазменных факторов и 12 факторов форменных элементов. 2 механизма: сосудистотромбоцитарный и коагуляционный. Сосудистотромбоцитарный(гемостаз мелких сосудов) 1)кратковременный спазм сосуда 2)адгезия 3)обратимая агрегация 4)необратимая агрегация 5)ретракция тромбоцитарного тромба. Коагуляционный (при ранении крупных сосудов) Фазы: 1)протромбиназообразование (многоступенчатый процесс, в результате которого в крови накапливается комплекс факторов, способных превратить протромбин) 2)тромбинообразование (протромбиназа вместе с факторами коагуляции V, VII, X и IV переводит неактивный фактор II (протромбин) в активный фактор IIа – тромбин 3)фибринообразование( тромбин отщепляет от молекулы фибриногена два пептида А и В, переводит его в фибрин – мономер, который под воздействием других факторов превращается в медленно и ограниченно растворимую форму, составляющую основу кровяного сгустка). Система фибринолиза – ферментативная система, расщепляющая нити фибрина, которые образовались в процессе свертывания крови, ограничивает распространение свертывания крови по сосудам, регулирует проницаемость сосудов, восстанавливает их проходимость и обеспечивает жидкое состояние крови в сосудистом русле. Компоненты: фибринолизин, активаторы плазминогена, ингибиторы фибринолиза.Фазы: I фаза -лизокиназы, поступая в кровь, приводят проактиватор плазминогена в активное состояние. Эта реакция осуществляется в результате отщепления от проактиватора ряда аминокислот.II фаза – превращение плазминогена в плазмин за счет отщепления липидного ингибитора под действием активатора.III фаза-под влиянием плазмина происходит расщепление фибрина до полипептидов и аминокислот.2 вида фибринолиза – ферментативный и неферментативный. Гемофилией называют наследственную болезнь, характеризующуюся недостатком факторов свертывания крови, при котором процесс сворачивания крови замедляется и увеличивается время кровотечения (гемофилия А-отс 8 фактор,гемофилия В-отс 9 фактор,гемофилия С-отс 11) симптомами:- длительными кровотечениями- появлением крупных синяков (гематом) после незначительных травм;- частыми носовыми кровотечениями;- внутрисуставными кровотечениями (гемартрозами- наличием крови в кале и в моче. Тромбоз – это патологическое состояние, при котором нарушается нормальный ток крови по венам, вследствие образования тромбов (кровяных сгустков).Причины 1. стаз крови — замедление кровотока; 2. гиперкоагуляция и ингибирование фибринолиза 3. повреждение эндотелия сосудистой стенки. симптомы: 1. Отеки; 2. Боли распирающего характера в пораженной области; 3. Боль при ощупывании, которая усиливается по ходу пораженной вены; 4. Синюшность кожи в пораженной области; 5. Гипертермия в месте образования тромба; 6. Набухание поверхностных вен;
109. Буферная система крови, нарушения кислотно - основного состояния (ацидоз и алкалоз), причины их проявления. Буферные системы крови и тканей: а) карбонатный буфер; б)фосфатный буфер; в) белковый буфер.
1. Буферные системы крови и тканей состоят из кислоты и сопряженного основания. При взаимодействии с кислотами последние нейтрализуются щелочным компонентом буфера, при контакте с основаниями их избыток связывается с кислотным компонентом. Бикарбонатный буфер является основным и состоит из слабой угольной кислоты и ее натриевой соли - натрия бикарбоната в качестве сопряженного основания. Фосфатный буфер состоит из одноосновного фосфата натрия, играющего роль кислоты, и двухосновного фосфата натрия, выступающего в роли сопряженного основания. Белковый буфер. Буферные свойства белков плазмы (альбумина и др.) и гемоглобина эритроцитов связаны с тем, что входящие в их состав аминокислоты содержат как кислые (СООН), так и основные (NH2) группы и могут диссоциировать с образованием как водородных, так и гидроксильных ионов в зависимости от реакции среды. Большая часть буферной емкости белковой системы приходится на долю гемоглобина. Нереспмраторный ацидоз - это самая частая и наиболее тяжелая форма нарушения кислотно-основного состояния. В основе нереспираторного ацидоза лежит накопление в крови так называемых нелетучих кислот или потеря организмом буферных оснований. Непосредственными причинами нереспираторного ацидоза являются: Избыточное образование органических кислот при патологических состояниях; Заболевания почек, сопровождающиеся преимущественным поражением почечных канальцев, что ведет к нарушению экскреции водородных ионов и реабсорбции. Респираторный ацидоз развивается при тяжелых нарушениях легочной вентиляции. Причинами респираторного ацидоза являются: 1. Тяжелая дыхательная недостаточность (обструктивные заболевания легких, пневмонии, рак легкого, эмфизема легких, гиповентиляция вследствие поражениякостного скелета, нейромышечные заболевания, тромбоэмболия легочной артерии, гиповентиляция вследствие поражения ЦНС и др. заболевания). Нересператорный алкалоз - является следствием избыточного образования в организме оснований. Причинами метаболического алкалоза являются: 1. Потеря больших количеств ионов Н+ с желудочным соком; 2. Гипокалиемия, развивающаяся при первичном альдостеронизме, потере калия через желудочно-кишечный тракт. Респираторный алкалоз-развивается вследствие усиленного выведения углекислого газа при нарушениях внешнего дыхания гипервентиляционного характера. Причинами респираторного алкалоза являются: Гипервентиляция при гипоксии; Органические или психические поражения центральной нервной системы; Гипервентиляционный синдром у детей; Гипервентиляционное управляемое дыхание.
110. Особенности биохимии печени. Основные метаболические процессы в печени. Биохимические механизмы обезвреживания лекарственных и токсических веществ в печени. Роль процессов микросомального окисления. Конъюгация. Ф-ии: 1. Распределительная- печень осуществляет распад, почти всех веществ всасываемых из ЖКТ. 2. Печень служит местом синтеза желчи и далее участвует в пищеварит. процессе. 3. В печени синтезируются большинство белков плазмы крови. 4. Служит местом инактивации и переработки многих нормальных продуктов жизнедеятельности. 5. В печени происходит детоксикация чужеродных веществ и ксенобиотиков. 6. Печень участвует в выведении с желчью обезвреженных токсинов. К функциям обезвреживания относится так же осуществления цикла мочевины. Кроме белков печень синтезирует гликоген, жиры и кетоновые тела. Обезвреживание токсических веществ осуществляется в 2 стадии: Задачей является превратить гидрофобные токсические вещества в более растворимые. В первую стадию происходят не синтетические реакции: гидролиз, сульфаокисление, образование гепоксидов. В таких реакциях к гидрофобному токсину присоединяется небольшая заряженная группа. Примером служит митохондриальное и микросомальное окисление. Если этого оказывается достаточно, то токсин выделяется в кровь, далее в почки и удаляются с мочой. В противном случае осуществляется 2-ая стадия- синтетические реакции свойства которых заключается в конъюгации модифицированного токсина с массивной заряженной химической группой. В качестве таких групп в большинстве случаев выступают остатки глюкуроновой кислоты, донором которой является УДФ, глюкуронат, образующийся при функционировании пути уроновых кислот. Кроме того конъюгация может осуществляться с остатком серной кислоты, глицином, глутаминовой кислоты, если при конъюгации образуется достаточно растворимые соединения, то оно выделяется в кровь, попадает в почки и удаляется с мочой. При недостаточной растворимости соединения секретируются в желчь и попадают в кишечник.
111. Катаболизм гемоглобина в печени. Патология обмена желчных пигментов. Конъюгированная и неконъюгированная билирубинурия. Паренхиматозная, гемолитическая и обтурационная желтухи. При распаде гемоглобина, освобождается гемм, от гемма отщепляется железо и образуется биливердин, он восстанавливается биливердинредуктазой до билирубина, который в соединении с альбуминов поступает в печень, где происходит его конъюгация с глюкуроновой к-той, образ-ся глюкорониды билирубина(нетоксичные).В киш-ке билирубинглюкоронид образует 2 группы продуктов: уробилиногены и стеркобилиногены, часть выводится с калом, а часть всасыв-ся в кровь, попадает в желчь и выводится ч/з почки. Концентрация билирубина в крови 0,1-1 мг/дл. В крови содержатся как неконъюг.билирубин, так и глюкорониды. Билирубинемия — это содержание билирубина в крови. Гипербилирубинемия — избыточное содержание билирубина в крови. Желтуха представляет собой клинико-биохимический синдром, возникающий при наличии в крови билирубина. Гемолитическая желтуха возникает в результате гемолиза эритроцитов. Гемоглобин, не может полностью инактивироваться клетками печени, поэтому в крови определяется увеличение общего билирубина в основном за счет прямого. За счет этого многократно увеличивается выработка стеркобилиногена, поэтому моча и кал имеют темное окрашивание. Желтуха, возникающая в этом случае, предает коже лимонно-желтый оттенок. Паренхиматозная желтуха возникает, когда поврежденные гепатоциты не способны выполнять свою функцию связывания билирубина с глюкуроновой кислотой. Увеличивается содержание непрямого билирубина. Общий билирубин крови увеличивается за счет прямого и непрямого. Моча интенсивно окрашивается (имеет цвет темного пива), поскольку связанный билирубин, поступает в мочу. Наиболее частой причиной печеночной желтухи является поражение гепатоцитов при гепатите, иногда при циррозе.
112. Микросомальное (монооксигеназное)окисление:механизм, эндогенные и экзогенные субстраты окисления,роль в обеспечении обезвреживающей ф-ции печени, индукторы и ингибиторы. В печени происходит обезврежив-е таких вещ-в, как билирубин и продукты катаболизма аминок-т в киш-ке, а также инактивируются лекарств-е препараты и токсические в-ва экзогенного происхожд-я, NH3 - продукт азотистого обмена, который в рез-те ферментативных р-ций превращается в нетоксичную мочевину, гормоны и биогенные амины. В-ва, поступающие в орг-зм из окруж. среды и не используемые им как источники энергии, называют чужеродными в-ми. Эти вещества могут попадать в орг-зм с пищей, через кожу или с вдыхаемым воздухом. Чужеродные в-ва бывают: хозяйств-й деят-ти ч-ка и бытовой химии- (моющие ср-ва, парфюмерия). Существует 2 типа окисления: микросомальное и митохондриальное. 1.Микросом-е окисл-е осуществл-ся ферментными системами, находящимися во фракциях микросом печени и надпочечников. В процессах микросомального окисл-я активированный О2 входит в окисляемое вещество. Микросом-е окисление — механизм использов-я кислорода с «пластическими» целями. 2.Митохондр-е окисл-е- главную роль играют р-ции дегидрирования, О2 является конечным акцептором электронов и используется только для образования воды. Митохондр-е окисл-е-механизм использ-я кислорода в биоэнергет-х процессах. Некоторые вещества ( барбитураты , галоперидол , глутетимид ) индуцируют микросомальные ферменты печени , особенно цитохром Р450 ; другие вещества ( хлорамфеникол , циметидин , дисульфирам , декстропропоксифен , аллопуринол ) ингибируют.
113. Токсическое действие кислорода. Клеточные системы, блокирующие развитие свободнорадикальных процессов. Антиоксидантное действие витаминов. Предполагают,что токсичность кислорода вызвана с превращением его в супероксид. Он образ-ся в ходе одноэлектронного окисления молекулярным кислородом восстановленного флавина и при окислении восстановленного компонента дыхательной цепи. Супероксид восстанавливает окисленный цитохром. Химич.действие супероксида усилив-ся в результате инициирования цепной реакции образов-я свободных радикалов. Функция супероксидмутазы: защита от повреждающего действия супероксида. Антиоксиданты способны улавливать свободные радикалы, снижая токсичность кислорода. В основе мех-зма действия большинства антиоксидантов (токоферол, тирозин, эстрогены и др) лежит реакция взаимодействия молекулы ингибитора с активными радикалами. Антиоксиданты способны оказывать влияние на скорость реакций перекисного окисления.
114. Источники энергии мышечного сокращения. Энергообеспечение мышечной работы при физических нагрузках различной интенсивности. Трупное окоченение. Источники энергии: 1.)Специальные р-ции субстратного фосфорилирования. Участие реакций субстратного фосфорилирования в обеспечении энергией мышечной клетки зависит от интенсивности, продолжительности, мощности и длительности мышечной работы. а)Креатинфосфокиназная реакция-самый быстрый способ ресинтеза АТФ, не требует присутствия кислорода, не дает нежелательных продуктов, включается мгновенно, недостаток - малый резерв субстрата. б)миокиназная реакция 2 АДФ --> АТФ + АМФ реакция катализируется миокиназой (аденилаткиназой). 2.Гликолиз, гликогенолиз (анаэробные процессы), большой резерв субстратов, используется гликоген мышц и глюкоза крови, полученная из гликогена печени, недостатки: небольшая эффективность. 3. Окислительное фосфорилирование- наиболее энергетически выгодный процесс - синтезируется 38 молекул АТФ при окислении одной молекулы глюкозы, имеет самый большой резерв субстратов: может использоваться глюкоза, гликоген, глицерин, кетоновые тела, продукты распада (CO2 и H2O),недостаток: требует повышенных количеств кислорода. Трупное окоченение- состояние мышц трупа, при котором они уплотняются и фиксируют части трупа в определенном положении. После наступления смерти все мышцы тела человека расслабляются, теряют свойственную им прижизненную упругость. Во всех мышцах тела начинаются сложные биохимические процессы, связанные с преобразованием АТФ и высокомолекулярных структур актина и миозина. При наступлении смерти дыхание прекращается, в орг-зм перестаёт поступать кислород. АТФ перестаёт гидролизоваться кальциевым насосом (Ca-АТФазой), и Са перестаёт возвращаться в цистерны. В связи с этим ионы Са диффундируют из областей высокой концентрации в области низкой концентрации ,связываясь с тропонином, что обуславливает соединение актина и миозина.
115. Особенности химического состава мышечной ткани. Строение сократительных элементов (миозин,актин) и регуляторных белков (тропонин и тропомиозин). Миозиновые нити-содержит 2 тяжелые полипетидные цепи и 4 легкие, тяжелая цепь имеет с С-конца конформацию альфа-спирали, и обе спирали скручены др с др (форма палочки) противопол. N-концы-глобулярной формы, образуют головки, к каждой головке присоединены 2 легкие цепи. Миозин катализирует гидролиз АТФ. Актиновые нити-в составе белки актин, тропомиозин и тропонин. Основа-актин. Актин-глобулярный белок с шарообразн.молекулами-G-актин.молекулы G-актина соедин-ся и образуют F-актин, к нему присоедин-ся головки миозина. F-актин+миозин=актомиозин. Тропомиозин-форма палочек, располаг-ся вблизи лент F-актина. Каждая молекула тропомиозина соединена с 7 молек.G-актина. Тропонин-глобулярная форма, построен из 3х субъединиц, связан нековалентно с актином и тропомиозином. одна из субъединиц содержит Са-связывающий центр.
116. Современные представления о строении и механизме сокращения гладких и поперечно-полосатых мышц. Строение: мышца состоит из волокон. В мышечной клетке есть миофибрилла(пучки белков вдоль клетки).Она построена из белковых нитей(филаментов) толстых и тонких. Белок толстых-миозин, тонких-актин. Имеют строго упорядоченное положение в миофибрилле. Функцион.ед-ца миофибриллы-саркомер (участок между 2мя Z-пластинками. Саркомер включает пучок миозиновых нитей, прикреплен. к М-линии и пучки актиновых нитей, прикреплен.к Z-пластинкам. Стадии сокращения: 1)Фиксация АТФ на головке миозина. 2)Гидролиз АТФ. Продукты гидролиза (АДФ и Ф) остаются фиксированными, а выделившаяся энергия аккумулируется в головке. Мышца готова к сокращению. 3)Образов-е комплекса “актин-миозин”. Он очень прочен. Может быть разрушен только при сорбции новой молекулы АТФ.4) Конформационные изменения молекулы миозина, в результате которых происходит поворот головки миозина. Освобождение продуктов реакции (АДФ и Ф) из активного центра головки миозина.
117. Особенности обмена углеводов, азота и источников энергии в мышечной ткани. Источники энергии: 1)Специальные реакции субстратного фосфорилирования. Участие реакций субстратного фосфорилирования в обеспечении энергией мышечной клетки зависит от интенсивности, продолжительности, мощности и длительности мышечной работы. а)Креатинфосфокиназная реакция-самый быстрый способ ресинтеза АТФ, не требует присутствия кислорода, не дает нежелательных продуктов, включается мгновенно, недостаток - малый резерв субстрата. б)миокиназная реакция 2 АДФ --> АТФ + АМФ реакция катализируется миокиназой (аденилаткиназой). 2.Гликолиз,гликогенолиз (анаэробные процессы), большой резерв субстратов, используется гликоген мышц и глюкоза крови, полученная из гликогена печени, недостатки: небольшая эффективность: 3 АТФ на один глюкозный остаток гликогена, накопление недоокисленных продуктов (лактат),гликолиз начинается не сразу - только через 10-15 секунд после начала мышечной работы.3. Окислительное фосфорилирование- наиболее энергетически выгодный процесс - синтезируется 38 молекул АТФ при окислении одной молекулы глюкозы, имеет самый большой резерв субстратов: может использоваться глюкоза, гликоген, глицерин, кетоновые тела, продукты распада (CO2 и H2O), недостаток: требует повышенных количеств кислорода .Образование аммиака в мышцах источником служит дезаминирование АМФ АМФ+вода=ИМФ+аммиак, однако АМФ регенерируется с использованием групп аспарагиновой кислоты ИМФ+аспартат+ГТФ=АМФ+фумарат+ГДФ+Н3РО4. Фумарат превращ-ся в аспартат, первичный источник аммиака.
118. Биохимия нервной ткани. Особенности липидного и белкового состава. Особенности биохимии нервной ткани: 1)связанные с генетическим кодом (в ядрах нервных клеток больше активных генов) 2. Аминок-ты нервной ткани ( разные структуры головного мозга имеют свои особенности по составу аминокислот) 3. Белки нервной системы. В нейронах выделены нейроспецифичные белки (встречаются только в нервной ткани, либо в нервной ткани их больше, чем в других тканях). Также в нейронах присутствует масса транспортных белков и белков-ферментов, белки миелиновой оболочки.4. Липиды- являются важнейшими структурными элементами клеточных мембран. Головной мозг содержит липидов около 50% от сухой массы, а миелиновая оболочка – до 80%. Липидный состав нервной ткани постоянен и не изменяется под воздействием таких внешних факторов, как диета, прием гормонов, лекарств-х средств, стрессы, которые сильно меняют липидный состав других органов. Жирные к-ты, входящие в состав липидов, в мозге отличаются большим разнообразием, чем в других тканях. Холестерин в норме обязательно содержится в нейронах, глиальных клетках и особенно много его в миелиновых оболочках аксонов. На долю холестерина приходится около 25% от содержания всех липидов.
119. Особенности обмена аминокислот в мозге. Поступл-е аминок-т из крови в клетки мозга зависит от особенностей клеток и от гемато-энцефалического барьера Содержание аминокислот в мозге выше, чем в крови. Аминокислотный состав мозга отличается определенной специфичностью. Набор свободных аминок-т в мозге (аспартат, глутамат, глутамин, 4-аминомаслянная кислота, N-ацетиласпартат. Пул свободных аминок-т использ-ся для синтеза белков и биологически активных аминов. Одна из ф-ций дикарбоновых аминокислот в головном мозге – связывание аммиака, освобождающегося при возбуждении нервных клеток. Аминок-ты служат как дополнит.источник энергии. Распад аминок-т осуществляется путем метаболизма, которую называют шунтом гамма-аминомаслянной кислоты (ГАМК). В случае увеличения расхода энергии и дефицита глюкозы увелич-ся содержание ГАМК, которая является тормозным медиатором для нейронов и снижает функциональную активность в определенных структурах мозга. Этот процесс может рассматривается как регуляция по механизму отрицательной обратной связи: высокая церебральная активность, вызывает дефицит глюкозы, который запускает шунт ГАМК, в рез-те чего накапливается ГАМК, тормозящая активность нейронов. В норме использование шунта ГАМК ограничено.
120. Особенности энергетического обмена мозга. Мозг обеспечивается энергией за счет аэробного распада глюкозы, лишь при голодании и сильной мышечной работе используются кетоновые тела. Основным потребителем энергии является Nа, К-АТФаза, поддерживающая ПП и восстанавливающая его после прохождения нервного импульса. Мозг чувствителен к гипогликемии и гипоксии. Мозг расходует >20% всей энергии потребляемой организмом. В качестве дополн-го источника энергии могут служить аминокислоты (метаболизм распада аминокислот-шунт гамма-аминомаслянной кислоты-тормозной медиатор для нейронов, снижает функц. активность в определенных структурах мозга. Процесс может рассм-ся как регуляция по механизму отрицательной обратной связи: высокая церебральная активность, вызывает дефицит глюкозы, который запускает шунт ГАМК, в результате чего накапливается ГАМК, тормозящая активность нейронов. В норме использование шунта ГАМК ограничено. Особенность энергообмена головного мозга в том, что он практически не содержит запасов вещ-в используемых в качестве энергетического субстрата и постоянно нуждается в их поступлении через мозговой кровоток.
121. Нейротрансмиттерные системы. Образ-е, биологическая роль и инактивация нейромедиаторов. Нейротрансмиттеры - химич. вещества, задействованные в передаче информации между нейронами и клетками мышц. Они вызывают краткие альтернации в постсинаптической мембране воспринимающей клетки либо деполяризацию или гипополяризацию мембраны. Возбуждающие нейромедиаторы (дофамин, гистамин, нормадреналин, адреналин, глютамат, ацетилхолин). Тормозящие (серотонин, ацетилхолин, таурин).
122. Биохимич. основы генерации и проведения нервных импульсов. Хар-ка нейромедиаторного процесса и веществ, обладающих нейромедиаторными свойствами (синтез, депонирование, выброс в синаптическую щель, деградация, обратный захват нейромедиаторов). Этапы синаптич. передачи нервного импульса 1)нервный импульс вызывает выход медиатора в синаптич.щель 2)медиатор диффундирует к мембране др.клетки (постсинаптич.мембране) 3)медиатор присоедин-ся к рецетору медиатора-белку, в результате изменения конформации рецептора генерир-ся ВПСП, при достижении порогового уровня возникает ПД, который движется по аксону 4)медиатор инактивируется или удаляется. Нейромедиатор (ацетилхолин, норадреналин, адреналин, дофамин, серотонин) - вещество, которое синтезируется в нейроне, содержится в пресинаптических окончаниях, высвобождается в синаптическую щель в ответ на нервный импульс, и действует на специальные участки постсинаптической клетки, вызывая изменения мембранного потенциала и метаболизма клетки.4 типа медиаторов: амины; аминокислоты; пуриновые нуклеотиды; нейропептиды.
123. Строение и функции компонентов межклеточного матрикса (коллаген, эластин, гликозаминогликаны, протеогликаны, фибронектин. Принципы организации межклеточного матрикса. Основн.компоненты межклет.матрикса-белки коллаген и эластин, гликозаминогликаны, протеогликаны, неколлагеновые белки (фибронектин, ламинин, тенасцин, остеонектин и др.) Коллаген — фибриллярный белок, составляет основу соединит-й ткани орг-ма (сухожилие, кость, хрящ)и обеспечивающий её прочность и эластичность. Молекула коллагена закручен. спираль из трёх α-цепей- тропоколлаген. 1 виток спирали α-цепи содержит 3 аминок-ых остатка. Эластин- распространен в соединит.ткани, особенно в коже, легких и кровеносных сосудах. Содержит много глицина и пролина. В эластине обнаружены десмозин и изодесмозин. Гликозаминогликаны (мукополисахариды)- могут связывать большие кол-ва воды, в результате чего межклет. в-во приобр-т желеобразный хар-р. Протеогликаны- состоят из белка на 5-10% и из гликозаминогликанов на 90-95%,составляют до 30 % сухой массы ткани. Они обеспеч-т тургор различ.тканей, фильтрацию в почках, поддержание прозрачности роговицы, структурную роль выполняют в склере. Фибронектин –белок, построен.из 2х одинак. пептидных цепей, соедин.дисульфидными связями. Онсвязыв-ся с проколлагенов.фибриллами и меняет кинетику образов-я фибрилл в перицеллюлярном пространстве. Межклет-й матрикс выполняет в организме ф-ции: образует каркас органов и тканей; участвует в регуляции водно-солевого обмена; образует высокоспециализированные структуры (кости, зубы, хрящи, сухожилия, базальные мембраны). Компоненты межклет.матрикса соединяясь м/д собой и клетками, образуют единую систему ткани.
124. Синтез коллагена. Причины и следствия биохимич.изменений соединит.ткани при старении и заболеваниях (коллагенозах) Синтез коллагена синтез-ся клетками (фибробластами) в межклет.среду.Стадии синтеза: трансляция, внутриклеточн. посттрансляционная модификация пептидных цепей, трансмембранный перенос, внеклеточная модификация с образов-ем коллаген. волокон. Синтез коллагена увелич.в заживающ.ране. При старении уменьш. содержание воды и отношение основное в-во/волокна. Показатель соотн-я уменьш.за счет нарастания коллагена и сниж. гликозаминогликанов, сниж.содержания гиалуроновой к-ты.И змен-ся физико-химич. Свойства коллагена(увелич.числа и прочности внутри- и межмолекулярных поперечн. связей, сниж.эластичности и способности к набуханию. Увелич. процесс созрев-я фибриллярных структур. Коллагенозы-группа забол-ий, характер-ся повреждением всех структурных составных частей соединит. ткани: волокон, клеток и межклет.в-ва. К коллагенозам относят ревматизм, ревматоидный артрит, системную красную волчанку, системную склеродермию, дерматомиозит и узелковый периартериит.
51 и 106 нет!!!!!
