
- •По предмету «Химия» для студентов 1 курса групп э-12д, эл-12д
- •Раздел 1. Общая и неорганическая химия
- •Тема 1.1.Основные понятия и законы химии
- •Тема 1.2. Периодический закон и периодическая система д. И. Менделеева. Строение атома
- •Тема 1.3. Строение вещества
- •Тема 1.4. Вода. Растворы. Электролитическая диссоциация
- •Тема 1.5. Классификация неорганических соединений и их свойства
- •Тема 1.6. Химические реакции
- •Тема 1.7. Металлы и неметаллы.
- •Раздел 2. Органическая химия
- •Тема 2.1.Основные понятия органической химии. Теория химического строения органических соединений
- •Тема 2.2.Углеводороды
- •Тема 2.3.Кислородосодержащие органические соединения
- •Тема 2.4. Азотсодержащие соединения
- •1. Все вещества состоят из молекул. Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
- •2. Молекулы состоят из атомов. Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
- •3. Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Тема 2.3.Кислородосодержащие органические соединения
Спирты. Предельные одноатомныё спирты, их строение, свойства. Получение и применение этилового спирта.
Предельные многоатомные спирты, их строение, свойства. Получение и применение глицерина.
Фенол, его химическое строение, свойства, получение и применение.
Альдегиды, их химическое строение и свойства. Получение, применение альдегидов.
Карбоновые кислоты, их строение и свойства на примере уксусной кислоты.
Сложные эфиры, их химическое строение, свойства, получение и применение.
Жиры, их состав и свойства. Жиры в природе, превращение жиров в организме.
Углеводы и их классификация.
Глюкоза — представитель моносахаридов, химическое строение, физические и химические свойства, применение.
Крахмал, нахождение в природе, практическое значение, гидролиз крахмала.
Сахароза, состав молекул, физические и химические свойства, применение.
Тема 2.4. Азотсодержащие соединения
Амины, их классификация и строение, получение, свойства, применение.
Анилин - представитель аминов; химическое строение и свойства; получение и практическое применение.
Аминокислоты, их состав и химические свойства: взаимодействие с соляной кислотой, щелочами, друг с другом. Биологическая роль аминокислот и их применение.
Белки как биополимеры. Свойства и биологические функции белков
Синтетические высокомолекулярные соединения. Общая характеристика высокомолекулярных соединений: состав, строение, реакции, лежащие в основе их получения (на примере полиэтилена или синтетического каучука).
Синтетические волокна, их строение, свойства, практическое использование на примере лавсана и капрона.
Виды синтетических каучуков, их свойства и применение.



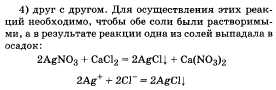
Химия - наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении.
Атомно - молекулярное учение.
1. Все вещества состоят из молекул. Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
2. Молекулы состоят из атомов. Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
3. Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Химический элемент - это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек.
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов.
Изотопы - химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
Химическая формула - это условная запись состава вещества с помощью химических знаков (предложены в 1814 г. Й. Берцелиусом) и индексов (индекс - цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле). Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Относительная атомная масса (Ar) - безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C.
Количество вещества, моль. Означает определенное число структурных элементов (молекул, атомов, ионов). Обозначается , измеряется в моль. Моль - количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода.
Число Авогадро (NA). Количество частиц в 1 моль любого вещества одно и то же и равно 6,02 • 1023.
