
- •19) Химические свойства одноатомных спиртов: кислотно-основные свойства, дегидратация(межмолекулярная и внутримолекулярная), окисление первичных, вторичных и третичных спиртов. Этерификация.
- •20)Фенолы. Классификация. Физические свойства. Строение. Химические свойства фенола (реакция по гидроксильной группе и ароматическому кольцу). Применение.
- •21) Альдегиды и кетоны. Изомерия, номенклатура. Физические свойства.
- •23)Карбоновые кислоты. Классификация. Изомерия, номенклатура. Нахождение в природе.
- •24)Физические и химические свойства монокарбоновых кислот.
- •25)Механические свойства полимеров: деформационные и прочностные. Применение полимеров в строительном деле.
- •26)Основные методы получения полимеров: полимеризация, поликонденсация.
- •28) Полиэтилен. Полипропилен. Физические и химические св-ва. Области применения.
- •29)Клеи: св-ва, состав, применение.
- •31)Герметики: состав, св-ва, применение
- •32) Битумы: природные источники, химический состав, применение
- •33) Деготь: природные источники, химич. Состав, применение
- •34) Полиакрилаты: химич. Состав, характеристика, применение.
19) Химические свойства одноатомных спиртов: кислотно-основные свойства, дегидратация(межмолекулярная и внутримолекулярная), окисление первичных, вторичных и третичных спиртов. Этерификация.
Спирты проявляют кислотно-основные св-ва(амфотерность). С2Н5ОН+Na→H2↑(этилат Na). Основные св-ва. Дегидратаци
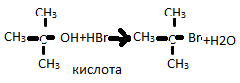
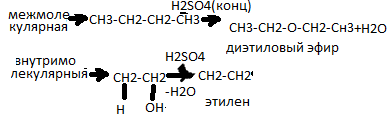
Окисление спиртов.Первичные спирты окисляются до альдегидов, вторичные –до кетонов, третичные –окисляются с трудом.Окислители:хромовая смесь (К2Cr2O7+H2SO4)

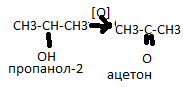
Этнрификация(получение
сложного эфира) взаим-вие м/у карбоновой
кислотой и спиртом, протек в присутствии
неорганич кислот, приводящий к образованию
сложного эфира и воды.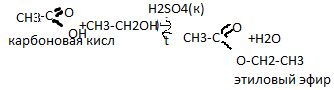
20)Фенолы. Классификация. Физические свойства. Строение. Химические свойства фенола (реакция по гидроксильной группе и ароматическому кольцу). Применение.
Фенолы-ароматические
соединения, кот в своем составе содержат
гидроксильную группу –ОН, непосредственно
связанную с ароматическим кольцом.
Классификация.Различают:
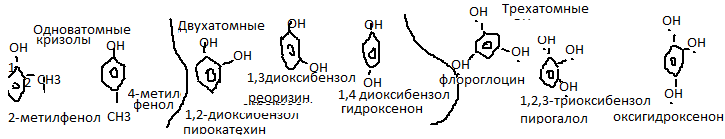
Физ
св-ва
Фенол-белое
кристаллическое вещество, нерастворим
в воде, ядовито, вызывает сильные
ожоги.Строение
и Хим св-ва
 Кислотные
св-ва 1.С6Н5-ОН+Na→2C6H5ONa+H2(Фенолят
Na)
2. С6H5OH+NaOH→C6H5ONa+H2O
3. Реакции S
Кислотные
св-ва 1.С6Н5-ОН+Na→2C6H5ONa+H2(Фенолят
Na)
2. С6H5OH+NaOH→C6H5ONa+H2O
3. Реакции S
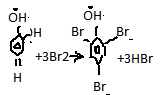 Группа
ОН оказ активирующ действие на аромат
кольцо, замещаются атомы Н в положениях
2, 4 и 6.Реакция явл качественной на
фенол→приводит к образованию осадка
белого цвета 2,4,6 трибромфенол.
4.
Группа
ОН оказ активирующ действие на аромат
кольцо, замещаются атомы Н в положениях
2, 4 и 6.Реакция явл качественной на
фенол→приводит к образованию осадка
белого цвета 2,4,6 трибромфенол.
4.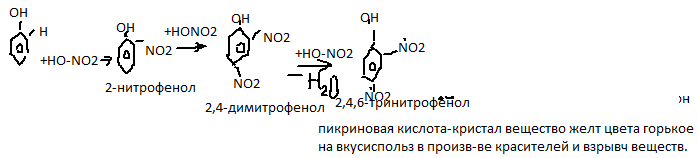 Применение:
Фенолы
применяют в производстве различных
феноло-альдегидных смол, полиамидов,
полиарилатов, полиариленсульфонов,
эпоксидных смол, антиоксидантов,
бактерицидов и пестицидов (например,
нитрафен). Алкилфенолы используют в
производстве ПАВ, стабилизаторов и
присадок к топливам. Двухатомные фенолы
и их производные входят в состав дубителей
для кожи и меха, модификаторов и
стабилизаторов резин и каучуков,
применяются для обработки кино- и
фотоматериалов. В медицине фенолы и их
производные используют в качестве
антимикробных, противовоспалительных,
спазмолитических, жаропонижающих ,
слабительных, адренолитических, вяжущих
и других лекарственных средств.
Применение:
Фенолы
применяют в производстве различных
феноло-альдегидных смол, полиамидов,
полиарилатов, полиариленсульфонов,
эпоксидных смол, антиоксидантов,
бактерицидов и пестицидов (например,
нитрафен). Алкилфенолы используют в
производстве ПАВ, стабилизаторов и
присадок к топливам. Двухатомные фенолы
и их производные входят в состав дубителей
для кожи и меха, модификаторов и
стабилизаторов резин и каучуков,
применяются для обработки кино- и
фотоматериалов. В медицине фенолы и их
производные используют в качестве
антимикробных, противовоспалительных,
спазмолитических, жаропонижающих ,
слабительных, адренолитических, вяжущих
и других лекарственных средств.
21) Альдегиды и кетоны. Изомерия, номенклатура. Физические свойства.
Альдегиды
![]() 1.
1.
![]() метаналь –сист муравьиный альдегид –
травиальное 2.
метаналь –сист муравьиный альдегид –
травиальное 2.![]() этаналь,
уксусный альдегид 3.
этаналь,
уксусный альдегид 3.
![]() пропаналь,
пропионовый альдегид 4.
пропаналь,
пропионовый альдегид 4.
![]() бутаналь,
масляный альдегид 5.
бутаналь,
масляный альдегид 5.
![]() 3-метилбутаналь.
Физ
св-ва
Кетоны — летучие жидкости или легкоплавкие
твёрдые вещества, низшие представители
хорошо растворимы в воде и смешиваются
с органическими растворителями, некоторые
(ацетон) смешиваются с водой в любых
отношениях. Невозможность образования
межмолекулярных водородных связей
обуславливает несколько бо́льшую их
летучесть, чем у спиртов и карбоновых
кислот с той же молекулярной массой.
3-метилбутаналь.
Физ
св-ва
Кетоны — летучие жидкости или легкоплавкие
твёрдые вещества, низшие представители
хорошо растворимы в воде и смешиваются
с органическими растворителями, некоторые
(ацетон) смешиваются с водой в любых
отношениях. Невозможность образования
межмолекулярных водородных связей
обуславливает несколько бо́льшую их
летучесть, чем у спиртов и карбоновых
кислот с той же молекулярной массой.
22)Химические
свойства альдегидов и кетонов: реакции
присоединения по карбонильной группе
(оксинитрильный синтез, получение
бисульфитных производных); окисление
и восстановление.
 A-реакции
присоединения. Окисление
A-реакции
присоединения. Окисление
1.
Оксинитрильный синтез
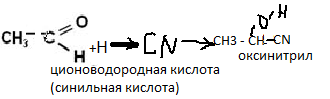
2.гидросульфит
Na
![]() гидросульфидное
производное альдегида . реакция использ
для обнаружения альдегидов
гидросульфидное
производное альдегида . реакция использ
для обнаружения альдегидов
Окисление Альдегиды в мягких условиях слабыми окислителями[Ag(NH3)2]OH,Cu(OH)2 до соответственных карбоновых кислот. Кетоны окисляются в жестких условиях сильными окислителями (хромовая смесь) К2Cr2O7+H2SO4(конц.) Продукт окисления кетонов – карбоновые кислоты и более простые кетоны.
