
- •Лекція 1
- •Загальна характеристика елементів-неметалів
- •Неметали як прості речовини
- •Хімічні властивості неметалів
- •Поширеність, добування і кругообіг неметалів у природі
- •Гідрогеновмісні сполуки неметалів
- •Оксигеновмісні сполуки неметалів
- •Лекція 2
- •Характеристика Гідрогену
- •Поширення в природі
- •Проста речовина
- •Фізичні властивості
- •Сполуки
- •Характеристика Оксигену.
- •Проста речовина
- •Похідні молекулярних іонів кисню
- •Лекція 3 Галогени
- •1. Загальна хактеристика галогенів.
- •Міцність зв’язку х-х і хімічні властивості простих речовин.
- •Методи синтезу гідрогенгалогенідів.
- •Лекція 4
- •Оксиди галогенів
- •2. Властивості оксокислот хлора
- •2.1. Особливості будови і міцність зв’язку Cl-o в оксоаніонах
- •2.2. Кислотні властивості. Індукційний ефект
- •2.3. Стабильность оксокислот хлора и их солей.
- •2.4. Окиснювальна здатність оксокислот хлора
- •3.Властивості оксокислот галогенів
- •3.1. Оксокислоти hxo та їх солі
- •3.2. Оксокислоти hxo2
- •3.3. Властивості кислот hxo3 та їх солей.
- •3.4. Оксокислоти hxo4
Поширеність, добування і кругообіг неметалів у природі
Поширеність неметалів у природі підлягає певним принципам. Найбільш активні неметали — галогени — зустрічаються у природі виключно у вигляді сполук, головним чином із лужними металами (карналіт КС1МgСl26Н2О). Оксиген і Сульфур також активні мінералоутворювачі, у більшості випадків із перехідними металами (вапняки СаСО3, пірит FeS2 та ін.). Оксиген, крім того, утворює численні силікати й алюмосилікати (каолін А12О32SiО22Н2О), а Сульфур — сульфати (гіпс СаSО42Н2О).
Кисень і сірка зустрічаються в природі й у вільному стані завдяки процесам фотосинтезу й вулканічній діяльності.
Основною формою Нітрогену в природі є атмосферний азот за рахунок виключно великої міцності молекули N2. Він утворюється головним чином завдяки розкладу азотовмісних органічних сполук та спалювання палива в промисловості. Головними природними сполуками Фосфору є фосфати (фосфорит Са3(РО4)2 й апатит Са5Х(РО4)3, де X — F-, С1-). Ці cполуки нерозчинні у воді й утворюють великі родовища.
Природний карбон зустрічається у двох формах - органічного та інерального походження. До першої відносять родовища кам'яного вугілля, нафти, природного газу, друга становить головним чином карбонатні породи і вуглекислий газ СО2.
Силіцій — основний елемент, який утворює літосферу,— представлений численними силікатами і алюмосилікатами.
Отже, форма існування неметалів у природі визначається хімічною активністю елемента. Більшість елементів-неметалів у природі знаходиться у зв'язаному стані. Розповсюдження сполук неметалів залежить також від їх розчинення у воді.
Більшість простих речовин із їхніх природних сполук добувають внаслідок окисно-відновних процесів, крім тих випадків, коли прості речовини зустрічаються в природі у самородному стані. Так, азот і кисень виділяють із зрідженого повітря фізичними методами — фракційною перегонкою.
Найбільш активні неметали-галогени можна виділити із природних сполук лише окисненням завдяки електролізу (електрохімічні методи). Порівняно малоактивні неметали, які поширені у природі в окисненому стані (бор, кремній, фосфор тощо), виділяють у вільному стані дією відновників. Малоактивні неметали (Вr2 та І2) можна витиснути із розчинів бромідів та йодидів більш енергійним окисником — хлором — або термічним розкладом йодидів, інколи бромідів (хімічні методи).
Таким чином, поширення неметалів у природі, а також добування їх із сполук визначаються хімічною активністю елементів-неметалів, що є наслідком будови їхніх атомів і молекул. Знання хімії неметалів важливе для розуміння природних геохімічних циклів хімічних елементів Нітрогену, Фосфору, Карбону, Оксигену й усвідомлення причин їх порушення внаслідок діяльності людини. Необхідно пам'ятати, що коли природні цикли стають необерненими, то виникає загроза всьому живому на Землі, бо перелічені елементи є органогенними.
Гідрогеновмісні сполуки неметалів
Неметали утворюють водневі сполуки згідно з місцем елементів у періодичній системі та відповідно до їх електронегативності. У цих сполуках елементи-неметали мають негативний ступінь окиснення, що видно з таблиці 4. У молекулах гідрогеновмісних сполук зв'язок Н-Е – ковалентний полярний. Полярність зв'язку залежить від електронегативності елемента й закономірно змінюється в періодах і групах, як видно з таблиці 14. Кристалічні ґратки цих сполук молекулярні. Тому всі вони за звичайних умов-гази з низькими температурами плавлення, крім води. Молекули водневих сполук мають різну термічну стійкість. У групах вона зменшується, бо збільшується довжина зв'язку (розміри атомів збільшуються) й відповідно зменшується енергія (міцність) зв'язку. Ось чому, наприклад, молекули води розкладаються на водень і кисень під дією електричного струму, а молекули гідроген селеніду й гідроген телуриду розпадаються на відповідні елементи вже при несильному нагріванні без доступу повітря.

У чому ж причина різної розчинності водневих сполук? Звернемося до електронної будови молекул водневих сполук другого періоду:
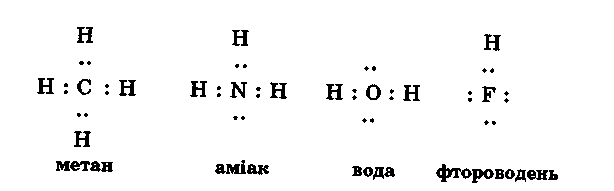
З формул видно, що лише в молекулі метану всі ковалентні зв'язки насичені. В молекулах інших речовин є вільні електронні пари, які зумовлюють полярність молекул і сприяють донорно-акцепторній взаємодії з протоном води. Саме тому метан практично не розчинний, а аміак і Гідроген фторид добре розчинні у воді.
! Пам'ятайте про таку особливість: полярні речовини добре розчиняються у полярних розчинниках, а неполярні речовини — відповідно у неполярних розчинниках. Так, бензол С6Н6 практично не розчиняється у воді, але добре розчиняється в ацетоні як неполярному органічному розчинникові.
Запам'ятайте: подібне розчиняється у подібному!
З дослідів за допомогою індикатору метилового оранжевого ви також дізналися, що аміак і хлороводень не лише розчинялися у воді, а й взаємодіяли з нею за таким механізмом:
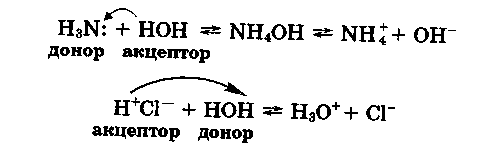
Як видно з наведених рівнянь реакцій, взаємодія води з аміаком та хлороводнем відбувалася за донорно-акцепторним механізмом і сприяла утворенню іонів гідроксилу ОН- й іонів гідроксонію Н3О+ (водню). Наявність цих іонів й зумовила зміну забарвлення індикатору метилового оранжевого: він став рожевим у розчині хлороводню (кисле середовище) і жовтим — у розчині аміаку (лужне середовище).
Вода в цих реакціях виявляє різні властивості: по відношенню до аміаку — кислотні, а до хлороводню — основні. Отже, вода залежно від умов проявляє амфотерні властивості.
Таким чином, більшість водневих сполук неметалів мають кислотні властивості, їхні водні розчини — кислоти. Водні розчини відповідних сполук V групи становлять виняток, вони — луги.
Оскільки є як кислотні, так і основні водневі сполуки, то вони можуть реагувати між собою.

Усі розглянуті вище реакції мають практичне значення. Так, на розчиненні водневих сполук неметалів у воді засновано добування безкисневих кислот: галогеноводневих, сірководневої тощо, а також лугів — гідроксиду амонію (нашатирного спирту). Реакції між водневими сполуками з різними хімічними властивостями використовують для добування солей амонію, сульфідів тощо.
Водневі сполуки неметалів — сильні відновники завдяки негативному ступеню окиснення неметалічного елемента. Розглянемо деякі приклади:
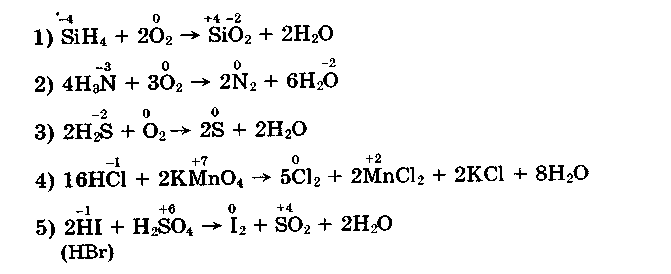
Завдяки відновним властивостям сірководню й аміаку вони не накопичуються в природі у вільному стані (сірководень та аміак — токсичні сполуки). На відновних властивостях водневих сполук засноване їх використання в лабораторіях для добування деяких простих речовин, наприклад хлору (рівняння 4).
Таким чином, властивості водневих сполук неметалів залежать як від електронної будови молекул, так і від ступеня окиснення елемента неметалу.
