
- •56. Шестичленные гетероциклы с двумя гетероатомами. Ароматические
- •Обнаружение барбитала
- •Обнаружение фенобарбитала
- •Оксазины
- •2) При действии на ортоаминобензилгалоидные производные ангидридами кислот получаются фенпентоксазолы и кумазоновые кислоты:
- •Фенотиазин; тиодифениламин; дибенз-1,4-тиазин
- •Химические свойства [править]
- •Препараты бензодиазепинового ряда.
56. Шестичленные гетероциклы с двумя гетероатомами. Ароматические
представители диазинов: пиримидин, пиразин, пиридазин. Пиримидин
и его гидрокси- и аминопроизводные: урацил, тимин, цитозин -
компоненты нуклеозидов. Лактим-лактамная таутомерия нуклеиновых
оснований. Барбитуровая кислота; лактим-лактамная и кето-енольная
таутомерия, кислотные свойства. Производные барбитуровой кислоты:
барбитал, фенобарбитал, тиамин (витамин В1). Оксазин, феноксазин.
Тиазин, фенотиазин. Семичленные гетероциклы. Диазепин,
бензодиазепин. Ле-карственные средства бензодиазепинового ряда.
Ароматические шестичленные гетероциклические соединения,
содержащие в своей структуре в качестве гетероатомов два атома азота, называются диазинами.

для этих соединений чаще применяют тривиальные названия.
пиридазин, пиримидин, пиразин. Как видно из приведенных формул, эти три диазина являются изомерами.
Существуют также шестичленные гетероциклы, содержащие в своей структуре в качестве гетероатомов атомы азота и кислорода или азота и серы, например:

Оксазин и тиазин не обладают ароматическим характером
и по своим свойствам напоминают ациклические соединения, содержащие аналогичные функциональные группы.
Пиридазин, пиримидин и пиразин представляют собой ароматические соединения, во многом напоминающие пиридин. Наличие в молекулах двух атомов азота пиридинового типа, которые дезактивируют друг друга, приводит к тому, что эти гетероциклические соединения являются более слабыми основаниями, чем пиридин. Несмотря на наличие двух основных центров в молекуле, диазины образуют соли с одним эквивалентом минеральной кислоты:
Пиримидин (C4N2H4, 1,3- или м-диазин, миазин) — гетероциклическое соединение, имеющее плоскую молекулу, простейший представитель 1,3-диазинов.
Молекулярная масса пиримидина 80,09 г/моль. Пиримидин проявляет свойства слабого двукислотного основания, так как атомы азота могут присоединять протоны за счет донорно-акцепторной связи, приобретая при этом положительный заряд.
Реакционная способность в реакциях электрофильного замещения у пиримидина снижена из-за снижения электронной плотности в положениях 2,4,6, вызванного наличием двух атомов азота в цикле. Так, пиримидин не нитруется и не сульфируется, однако в виде соли бромируется в положение 5.
Электрофильное замещение становится возможным только при наличии электронодонорных заместителей и направляется в наименее дезактивированное положение 5.
Под действием алкилирующих агентов (алкилгалогениды, борфторид триэтилоксония) пиримидин образует четвертичные N-пиридиниевые соли, при действии перекиси водорода и надкислот образует N-оксид.
Реакции пиридина с азотными нуклеофилами зачастую сопровождаются раскрытием кольца с дальнейшей рециклизацией: так, в жестких условиях при взаимодействии с гидразином, пиримидин образует пиразол, при взаимодействии с метиламином — 3-этил-5-метилпиридин.
Пониженная электронная плотность кольца приводит к тому, что пиримидин активен по отношению к нуклеофильным реагентам, которые атакуют 2-, 4- и 6- атомы углерода цикла.
Так, литийорганические соединения и реактивы Гриньяра присоединяются к пиримидину с образованием 4-замещенных 3,4-дигидропиримидинов
Пиримидин получают восстановлением галогенизированых пиримидиновых производных. Или из 2,4,6-трихлор пиримидина, получаемого обработкой барбитуровой кислоты хлороксидом фосфора.
ПИРАЗИН, мол. м. 80,1; бесцв. кристаллы; т. пл. 540C, т. кип. 115,5-115,80C; плотн. 1,0311 г/см3; pKa1 0,65, рКa2 5,8. Хорошо раств. в воде, хуже - вэтаноле, диэтиловом эфире.

Молекула плоская; длины связей С—С и С—H близки к таковым в бензоле, длина связи С—N 0,134 нм. Пиразин-гетероароматич. соединение. Вступает в р-ции электроф. и нуклеоф. замещения. При аминировании под действием NaNH2 в NH3 превращ. в 2-аминопиразин; при окислении-в N-оксиды по одному или двум атомам N, напр.:

Оксиды легко вступают в р-ции электроф. замещения и используются для синтеза разл. производных пиразина. Так, действием POCl3 на пиразин-1-оксид получают 2-хлорпиразин-1-оксид, к-рый при взаимод. с разб. р-ром NaOH превращ. в 2-гидроксипиразин-1-оксид; N-оксидная группа легко удаляется восстановлением.
Общие методы синтеза пиразина и его производных: 1) конденсация 1,2-диаминоалканов с -дикетонами, напр.:
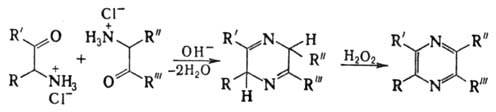
В пром-сти пиразин синтезируют обычно этим способом. 2) Конденсация двух молекул -аминокетонов или a-аминоальде-гидов, напр.:
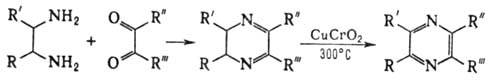
Такая конденсация протекает также при восстановлении -азидо- и a-нитрокетонов.
Пиразин и его производные обладают гербицидной и анти-биотич. активностью. Алкилпиразины - слагаемые аромата пищи, образующегося при ее приготовлении; обнаружены в жареном мясе, картофеле, какао, кофе, нек-рых сырах. Пира-зиновый цикл входит в состав нек-рых феромонов,антибиотиков (аспергилловая к-та), антивирусных, антибактериальных, противоопухолевых (эхиномицин) лек. препаратов, азиновых красителей.
ПИРИДАЗИН (1,2-диазин,
ойазин), мол. м. 80,09; бесцз. жидкость;
т. пл. -80C,
т. кип. 2080C,
48°С/1 мм рт. ст.; ![]() 1,1054;
1,1054; ![]() 1,5218;
рКа 2,33
(200C); 0,047
Н/м (340C); 13,14·10-30 Кл·м;
1,5218;
рКа 2,33
(200C); 0,047
Н/м (340C); 13,14·10-30 Кл·м; ![]() —
278,4 кДж/моль.
Раств. в воде, спиртах,
бензоле, диэтиловом
эфире,
не раств. впетролейном
эфире.
Производные: гидрохлорид, т. пл.
161-1630C; пикрат,
т. пл. 170-1750C
(с разл.); комплекс с PtCl4 ,
т. пл. 1800C. Молекулапиридазина
плоская.
—
278,4 кДж/моль.
Раств. в воде, спиртах,
бензоле, диэтиловом
эфире,
не раств. впетролейном
эфире.
Производные: гидрохлорид, т. пл.
161-1630C; пикрат,
т. пл. 170-1750C
(с разл.); комплекс с PtCl4 ,
т. пл. 1800C. Молекулапиридазина
плоская.
С большим трудом вступает в р-ции с электроф. агентами. С алкилгалогенидами образует соли по одному атому N, с оксониевыми солями-по обоим, с аминирующими агентами-соли моно-N-аминопиридазиния. При взаимод. с над-кислотами окисляется до моно- и ди-N-оксидов пиридазина. С маг-нийорг. соед. образует 4-замещенные, с литийорг. соед.-3-замещенные; р-ция идет через продукты присоединения, к-рые далее м. б. окислены до производных пиридазина. Дейтероводородный обмен под действием смеси CH3OD-CH3ONa происходит преим. по положению 4. Гомолитич. бензилирова-ние пиридазина приводит к получению 4-бензилпиридазина, бензои-лирование-к смеси 4-бензоил- и 4,5-дибензоилпиридазинов. Прифотолизе пиридазина в газовой фазе происходит раскрытие цикла с образованием азота и винилацетилена, при восстановлении Na в спирте-с образованием тетраметиленди-амина. При комнатной т-ре пиридазин легко вступает в диеновый синтез с малеиновым ангидридом, давая аддуктсостава 2:1; при 3000C изомеризуется в пиримидин. Для 3- и 4-метил-пиридазинов характерна конденсация с бензальдегидом по метильной группе.
Пиридазин получают взаимод. гидразина с диацеталем малеино-вого альдегида или с -кетоглутаровой к-той c послед. превращениями, напр. по схеме:
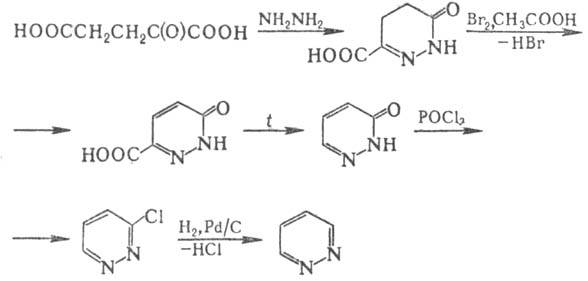
Др. способы получения пиридазина и его замещенных: восстановление 3-хлор и 3,6-дихлорпиридазинов, декарбоксилирование пиридазинкарбоновых к-т, взаимод. 2,5-диацетокси- или 2,5-диметокси-2,5-дигидрофурана с гидразином.
Методы синтеза основных функцион. производных пиридазина-галогенопиридазинов, аминопиридазинов и пиридазинонов: 4-и 5-галогенопроизводные получают обычно циклизацией соед. с открытой цепью, 3- и 6-производные-путем галоге-нирования соотв. замещенных пиридазинов с помощью POCl3, PCl5 или PBr5; аминопиридазины - взаимод. гало-генопиридазинов с NH3, аминами или мочевиной; пирида-зиноны-заменой галогена в галогенопроизводных пиридазина на алкоксигруппу с послед. гидролизом.
Замещенные пиридазина проявляют биол. активность (пестицид-ную, антивирусную, антибактериальную); нек-рые конден-сированные пиридазины входят в состав лек. ср-в (напр., апрессин, непрессол). 3,6( 1H,2H)-Диоксопиридазин - селективный регулятор роста растений.
Урацил
2,6-диоксипиримидин, органическое вещество из группы пиримидиновых оснований (См. Пиримидиновые основания). Белый порошок или иглоподобные кристаллы, растворимые в горячей воде; молярная масса 112.
Обладает амфотерными (и кислотными, и основными) свойствами, способен к таутомерии (См. Таутомерия). Впервые обнаружен в 1900 в продуктах расщепления дрожжевых нуклеиновых кислот. Присутствует во всех живых клетках, входя в состав многих нуклеотидов (См.Нуклеотиды) и рибонуклеиновых кислот (См. Рибонуклеиновые кислоты).


Урацил. Таутомерные формы урацила.
Тимин является одним из четырех высококомплементарной в нуклеиновых кислот ДНК, которые представлены буквы G–C–A–T. Другие являются аденина и гуанина, цитозином. Тимин (Т) почти всегда пары с аденином, хотя тимин димеры также возникают из-за воздействия УФ света.
Эта мутация отвечает за формирование меланомы. Также известен как 5-methyluracil, nucleobase пиримидинов тимин. Как подсказывает название, тимин могут быть получены от метилирования урацила в 5-й углерода.
В РНК тимин заменяется урацила в большинстве случаев. В ДНК тимин (Т) связывается с аденином (A) через две водородные связи для оказания помощи в стабилизации структуры нуклеиновых кислот.
Тимин в сочетании с Дезоксирибоза создает нуклеозидные фосфотрасфераз, который ассоциируется с термином тимидина. Тимидина может фосфорированный один, два или три группы фосфорной кислоты, создание, соответственно, TMP, TDP или TTP (тимидина моно-, ди- или трифосфата).
Одна из общих мутаций ДНК включает в себя два соседних thymines или цитозин, который, в присутствии ультрафиолетового излучения, могут образовывать димеры тимина, вызывая «kinks» молекулы ДНК, которые препятствуют нормальной функции.
Тимин также может быть объектом действия 5-фторурацилом (5-ФУ) в лечении рака. 5-Фторурацил может быть метаболические аналог тимин (в синтез ДНК) или урацил (в синтезе РНК). Замена этой аналоговый Ингибирует синтез ДНК в клетках, активно деления.
Тимин баз часто окисляются до hydantoins со временем после смерти организма.

Цитозин — азотистое основание, производное пиримидина. С рибозой образует нуклеозид цитидин, входит в состав нуклеотидов ДНК и РНК. Во время репликации и транскрипции по принципу комплементарности образует три водородных связи с гуанином.
 Бесцветные
кристаллы. Раствор цитозина поглощает
ультрафиолетовый свет: максимум абсорбции
(λмакс) 276 ммк (pH 1-3), 267 ммк (pH 7-10), 282 ммк
(pH 14).
Бесцветные
кристаллы. Раствор цитозина поглощает
ультрафиолетовый свет: максимум абсорбции
(λмакс) 276 ммк (pH 1-3), 267 ммк (pH 7-10), 282 ммк
(pH 14).
Цитозин, химическая формула C4H5N3O, проявляет основные свойства, реагирует с щелочами и кислотами, реагируя с азотистой кислотой дезаминируется, превращаясь в урацил.
Растворим в воде, слабо растворим в эфире, не растворим в спирте.
ри взаимодействии раствора цитозина с диазобензолсульфокислотой в щелочной среде, раствор окрашивается в синий цвет
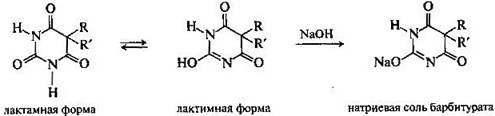
Незамещенные по атому азота лактамы являются простейшими соединениями, для которых принципиально возможна лактам-лактимная таутомерия — динамическое равновесие между лактамной и лактимной формами.

Лактим-лактамная таутомерия особенно важна для ароматических гетероциклов с гетероатомами азота — азотистых оснований, входящих в состав нуклеиновых кислот.
Таутомерия - это равновесная динамическая изомерия. Сущность ее заключается во взаимном превращении изомеров с переносом какой-либо подвижной группы и соответствующем перераспределении электронной плотности.
Лактамная форма (оксоформа или NH-форма) более термодинамически устойчива, чем лактимная.
Кислородные производные азотсодержащих гетероциклов в зависимости от условий могут существовать в различных таутомерных формах, переходящих друг в друга благодаря лактим-лактамной таутомерии.

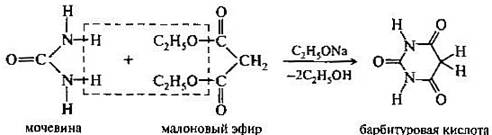
. Присутствие гидроксильных групп придает соответствующим производным пиримидина кислотные свойства. Особенно сильные кислотные свойства проявляет 2,4,6-тригидроксипиримидин — барбитуровая кислота. Барбитуровая кислота представляет собой циклический уреид малоновой кислоты. Она может быть получена при взаимодействий малонового эфира с мочевиной в присутствии этоксида натрия.
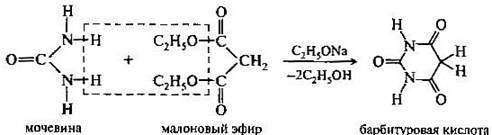
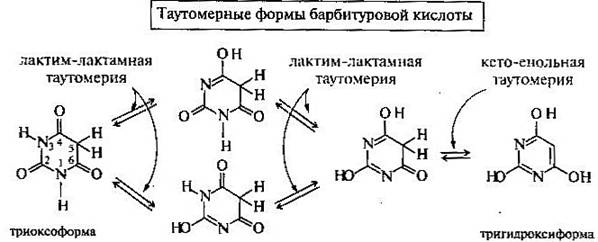
Для барбитуровой кислоты характерны два типа таутомерии — лактим-лактамная и кето-енольная. Ниже приведены несколько из различных возможных таутомерных форм барбитуровой кислоты.

Большую роль в качестве снотворных и противосудорожных средств играют 5,5дизамещенные производные барбитуровой кислоты, так называемые барбитураты. Их получают аналогично барбитуровой кислоте, используя дизамещенные эфиры малоновой кислоты. Для барбитуратов возможна только лактим-лактамная таутомерия. Они легко образуют водорастворимые соли с одним эквивалентом щелочи.
Примерами барбитуратов служат 5,5-диэтилбарбитуровая кислота - барбитал (веронал), ее натриевая соль, барбитал-натрий; 5-фенил-5-этилбарбитуровая кислота, фенобарбитал (люминал).
Барбитуровая кислота — 2,4,6-тригидроксипиримидин (2,4,6-пиримидинтрион, N,N-малонилмочевина). Бесцветные кристаллы, tпл 245 °C с разложением, растворимые в горячей воде. Плохо растворяется в холодной воде и этаноле, хорошо — в горячей воде, в эфире. Производные барбитуровой кислоты, содержащие алкильные или арильные заместители, а также их соли, называются барбитуратами[1].
Барбитуровая кислота впервые была синтезирована Адольфом Байером в 1864 г. конденсацией мочевины с малоновой кислотой[2]. Современной модификацией синтеза Байера является использование диэтилового эфира малоновой кислоты в присутствии этилата натрия[3]:
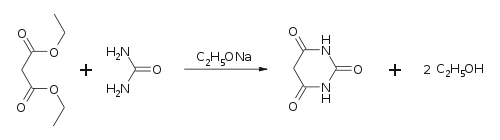
Этот же метод применяется для синтеза 5-замещенных барбитуратов из C-замещенных эфиров малоновой кислоты.
Для барбитуровой кислоты (и 5-монозамещенных барбитуратов) возможны две таутомерных формы: неароматическая пиримидин-2,4,6(1H,3H,5H)-трион и ароматическая 2,4,6-тригидроксипиримидин, в растворах равновесие смещено в сторону преобладания неароматической формы. Вместе с тем, депротонирование барбитуровой кислоты ведет к образованию резонансно стабилизированного ароматического аниона, что и обуславливает ее кислотные свойства:
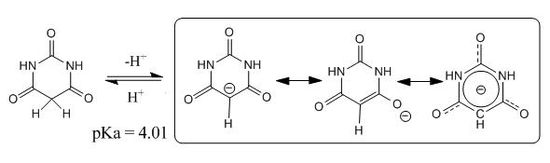
Дальнейшее депротонирование с сохранением ароматической структуры энергетически невыгодно, поэтому барбитуровая кислота титруется как одноосновная кислота.
Благодаря резонансной стабилизации аниона метиленовая группа барбитуровой кислоты проявляет CH-кислотные свойства: барбитуровая кислота конденсируется с ароматическими альдегидами с образованием 5-арилиденбарбитуровых кислот, нитрозируется с образованием нитрозопроизводного, перегруппировывающегося в 5-оксим (виолуровую кислоту), нитруется дымящей азотной кислотой с образованием 5-нитробарбитуровой (дилитуровой) кислоты.
Алкилирование барбитуровой кислоты идет преимущественно по атомам азота (так, при взаимодействии с диметилсульфатом образуется 1,3-диметилбарбитуровая кислота), однако в случае стерических затруднений наряду с N-алкилированием происходит и O-алкилирование, исключением является диазометан, который с барбитуровой кислотой образует 6-метокси-1-метилурацил[4].
При действии оксихлорида фосфора на барбитуровую кислоту происходит замещение хлором кислорода с образованием 2,4,6-трихлорпиримидина.
Присутствие
гидроксильных групп придает соответствующим
производным пиримидина кислотные
свойства. Особенно сильные кислотные
свойства проявляет 2,4,6-тригидроксипиримидин
— барбитуровая кислота. Барбитуровая
кислота представляет собой циклический
уреид малоновой кислоты. Она может быть
получена при взаимодействий малонового
эфира с мочевиной в присутствии этоксида
натрия.
 Для
барбитуровой кислоты характерны два
типа таутомерии — лактим-лактамная и
кето-енольная. Ниже приведены несколько
из различных возможных таутомерных
форм барбитуровой кислоты.
Для
барбитуровой кислоты характерны два
типа таутомерии — лактим-лактамная и
кето-енольная. Ниже приведены несколько
из различных возможных таутомерных
форм барбитуровой кислоты.
 Большую
роль в качестве снотворных и
противосудорожных средств играют
5,5дизамещенные производные барбитуровой
кислоты, так называемые барбитураты.
Их получают аналогично барбитуровой
кислоте, используя дизамещенные эфиры
малоновой кислоты. Для барбитуратов
возможна только лактим-лактамная
таутомерия. Они легко образуют
водорастворимые соли с одним эквивалентом
щелочи.
Большую
роль в качестве снотворных и
противосудорожных средств играют
5,5дизамещенные производные барбитуровой
кислоты, так называемые барбитураты.
Их получают аналогично барбитуровой
кислоте, используя дизамещенные эфиры
малоновой кислоты. Для барбитуратов
возможна только лактим-лактамная
таутомерия. Они легко образуют
водорастворимые соли с одним эквивалентом
щелочи.
 Примерами
барбитуратов служат 5,5-диэтилбарбитуровая
кислота - барбитал (веронал), ее натриевая
соль, барбитал-натрий; 5-фенил-5-этилбарбитуровая
кислота, фенобарбитал (люминал).
Примерами
барбитуратов служат 5,5-диэтилбарбитуровая
кислота - барбитал (веронал), ее натриевая
соль, барбитал-натрий; 5-фенил-5-этилбарбитуровая
кислота, фенобарбитал (люминал).
Барбитал — лекарственное средство, обладающие снотворным действием. Барбитал (веронал (происх. от ит. города Верона)) был первым барбитуратом, предложенным для применения в медицинской практике в качестве снотворного средства (в 1903 г.). Он оказывает успокаивающее и снотворное действие, вызывает глубокий сон. В настоящее время барбитал имеет ограниченное применение. В редких случаях, при неэффективности других средств, барбитал может быть использован в виде порошка.
Белый кристаллический порошок без запаха, горького вкуса. Легко растворим в воде (1:5 в холодной и 1:2, 5 в кипящей), мало растворим в спирте, нерастворим в эфире. Водный раствор имеет щелочную реакцию (рН 9,0—10,0). Растворы для инъекций готовят в асептических условиях.
Применение. Действие на организм. Барбитал применяется в качестве успокаивающего и снотворного средства. Он относится к барбитуратампродолжительного действия. Иногда его назначают больным в смесях с бромидами, амидопирином, антипирином и др. Барбитал по сравнению с другими барбитуратами медленно всасывается из пищевого канала и еще медленее выделяется из организма. Его можно обнаружить в организмедаже через 10 суток после приема.
Метаболизм. Большая часть дозы принятого барбитала выделяется с мочой в неизмененном виде. Незначительная часть дозы этого препарата выделяется с мочой в виде метаболитов, к числу которых относятся: 5-этил-5-β-оксиэтилбарбитуровая кислота, ее глюкуронид и 5-этил-барбитуровая кислота.
