
- •Содержание
- •2.Эймериозы
- •Ситуационное задание
- •Глава 2.
- •1. Туберкулез
- •2. Бабезиозы жвачных.
- •3. Печеночная недостаточность и ее патологоанатомическая характеристика.
- •4. Ситуационная задача.
- •Глава 3.
- •1. Бруцеллез
- •2. Балантидиоз свиней
- •3. Порядок наложения и снятия карантина.
- •4. Ситуационное задание
- •Глава 4.
- •1. Пастереллез
- •2. Эхинококкоз мелкого и крупного рогатого скота.
- •3. Предубойное содержание скота и птицы и его влияние на качество мяса.
- •4. Ситуационное задание
- •Глава 5.
- •1. Бешенство.
- •2. Описторхоз плотоядных животных
- •3. Дифференциальная патологоанатомическая диагностика африканской, европейской чумы плотоядных и септического течения рожи свиней.
- •4. Ситуационное задание
- •Глава 6.
- •1. Болезнь ауески
- •2. Паразитизм: происхождение и распространение. Виды паразитов. Влияние паразитов на организм хозяина.
- •3. Документы ветеринарного учета и отчетности. Отчетность.
- •4. Ситуационное задание
- •Глава 7.
- •2. Цистицеркозы животных, при которых дефинитивным хозяином является человек.
- •2. Цистицеркоз (бовисный) крупного рогатого скота.
- •3. Диагностика, дифференциальная диагностика и организация лечебно-профилактических мероприятий респираторных заболеваний птицы.
- •Ситуационное задание При экспертизе продуктов убоя 3-х реагирующих на туберкулин коров выявлены характерные изменения в средостенных лимфатических узлах. Какова санитарная оценка продуктов убоя
- •Глава 8.
- •1. Лейкоз крупного рогатого скота
- •2. Номенклатура инвазионных болезней
- •На организм животных и качество мяса.
- •4. Ситуационное задание
- •Глава 9.
- •1. Лептоспироз.
- •2. Токсоплазмоз крупного и мелкого рогатого скота
- •3.Асфиксия, ее патологоанатомическая характеристика.
- •4. Ситуационное задание
- •Глава 10.
- •1. Эмфизематозный карбункул
- •3. Порядок выдачи ветеринарных спавок и свидетельств.
- •4. Ситуационное задание
- •Глава 11.
- •1. Рожа свиней.
- •2. Цистицеркоз (овисный) мелкого рогатого скота.
- •3. Основы профилактики инвазионных болезней в животноводстве
- •4. Ситуационное задание
- •Глава 12.
- •1. Классическая чума свиней.
- •2. Гиподерматоз крупного рогатого скота.
- •3. Условно-годное мясо и способы его обеззараживания.
- •4. Ситуационное задание
- •Глава 13.
- •2. Трихинеллез свиней
- •3. Дифференциальная диагностика бешенства, болезни тешена, болезни ауэски, отечной болезни, листериоза и отравления поваренной солью.
- •4. Ситуационное задание
- •Глава 14.
- •3. Планирование ветеринарных мероприятий.
- •4. Ситуационная задача.
- •Глава 15
- •1.Ньюкаслская болезнь
- •2.Вольфартиоз
- •3. Профилактика пищевых заболеваний по линии службы ветеринарной медицины.
- •Глава16
- •1. Болезнь марека
- •2. Ценуроз церебральный (вертячка)
- •3.Дифференцированная патологоанатомическая диагностика колибактериоза, сальмонеллеза, тгс, ротавирусной инфекции и дизентерии свиней.
- •Ситуационное задание
- •Глава 17
- •1.Дерматомикозы.
- •2. Дифиллоботриозы плотоядных животных
- •3.Методы определения мяса, полученного от больных и убитых в агональном состоянии животных.
- •Глава 18.
- •1.Инфекционный бурсит кур (Гамборо)
- •2. Диктиокаулезы мелкого и крупного рогатого скота
- •3.Структура государственной ветеринарной медицины в Украине
- •Глава 19
- •1. Ящур
- •2. Паразитиформные клещи
- •3. Организация и методика послеубойного осмотра туш и внутренних органов свиней.
- •Глава 20
- •1.Инфекционная анемия лошадей
- •3. Патологоанатомическая характеристика инфекционных абортов.
- •Глава 21
- •1.Вирусный (трансмиссивный) гастроэнтерит
- •2. Кровососущие двукрылые насекомые (гнус). Общая характеристика и систематика.Симулиотоксикоз. Меры борьбы с гнусом и защита от него животных.
- •3.Законодательство по вопросам ветеринарной медецины.
- •Глава 22
- •1.Энзоотический энцефаломиелит
- •2. Оксиуроз лошадей
- •3. Ветсанэкспертиза и санитарная оценка рыбы при описторхозе и дифилоботриозе.
- •Глава 23
- •2. Губкообразная энцефалопатия крупного рогатого скота
- •Глава 24
- •1. Чума плотоядных
- •2.Фасциолезы крупного и мелкого рогатого скота
- •3. Структура государственной ветеринарной инспекции и ее задачи.
- •Глава 25.
- •3.Ветсанэкспертиза и санитарная оценка рыбы при анизакидозе
- •Глава 26
- •1. Африканская чума
- •2. Гастрофилезы непарнокопытных
- •3. Серологические реакции
- •Ситуационное задание
- •Глава 27.
- •2. Телязиозы крупного рогатого скота
- •3. Санитарная оценка продуктов убоя животных при трихинеллезе и цистицеркозах.
- •Ситуационное задание
- •Глава 28.
- •2. Метастронгилезы свиней
- •3. Методы выявления молока коров, больных субклиническим маститом, и его санитарная оценка.
- •Ситуационное задание
- •Глава 29.
- •1. Инфекционный ринотрахеит крупного рогатого скота
- •2. Дегельминтизация
- •3. Санитарная оценка туш и органов крупного рогатого скота при лейкозе.
- •4. Ситуационное задание
- •Глава 30
- •1.Хламидиозы.
- •2. Дикроцелиоз жвачных животных
- •3. Понятие о предотвращенном экономическом ущербе и методике его определения.
3. Серологические реакции
Микробные клетки несут на своей поверхности разнообразные антигены, среди которых имеются детерминанты, общие нескольким микроорганизмам или даже идентичные животным клеткам и уникальные, присущие только данному виду или варианту микроскопических существ. Токсигенные штаммы обычно содержат эти специфичные детерминанты и в экзопродуктах. Для успешного проведения иммунохи-мического анализа очень важно получить антисыворотку (то есть иммунную сыворотку) на максимально очищенные специфичные для вида или варианта антигены. Достигается это предварительной дезинтеграцией микробных структур, выделением и очисткой необходимых антигенных комплексов, а также путем специфической адсорбции антисыворотки, полученной на взвесь целых микробных клеток к их оболочкам или на раствор экзотоксина. Пользуются и разведением антисыворотки, чтобы избавиться от неспецифических реакций. Специфичную антисыворотку используют для иммунохимической идентификации антигенов в нативном виде или в виде конъюгатов с видимыми под обычным световым микроскопом ферментами, обнаруживаемыми под люминесцентным микроскопом флуорохромами или видимыми под электронным микроскопом контрастерами.
В ветеринарной практике приходится также анализировать растворимые антигены микроорганизмов. Иммунохимической идентификации обычно подвергают клостридии, эшерихии, стафилококки и некоторые другие продуценты экзотоксинов, а также органы и ткани животных, инфицированных сибиреязвенным микробом. Причем в первом случае экзотоксины накапливают обычно культивированием бактерий на специальных средах, во втором — преципитиноген экстрагируют изотоническим раствором хлорида натрия. В лабораториях чаще идентифицируют взвесь микробных клеток, то есть корпускулярный антиген.
Для обнаружения и идентификации растворимых антигенов применяют целый ряд методов, основанных на феномене преципитации. Наиболее популярной в ветеринарной практике является кольцевая реакция преципитации (РП), предложенная Асколи в 1902/. для обнаружения сибиреязвенного антигена в кожевенном сырье. Ставят ее в специальных узких пробирках и при появлении помутнения на границе между антисывороткой и антигеном можно идентифицировать гомологичный антисыворотке антиген в течение нескольких минут. Простота и доступность пробирочной РП обеспечили широкое применение ее в ветеринарно-санитарной экспертизе и криминалистике для определения видовой принадлежности мяса или идентификации крови.
При постановке РП с меченным радиоактивным йодом антигеном, не превышающим молекулярную массу альбумина (то есть не выпадающим в осадок при 50%-ном насыщении сульфатом аммония), можно установить общее количество, образовавшихся антител. Этой методикой Фарра экспериментаторы пользуются для определения антигенсвя-зывающёй способности антител.
На принципе преципитации основана также реакция нейтрализации, сущность которой сводится к предннкубации токсинов, ферментов или реже вирусов с гомологичными антисыворотками с последующим воздействием смеси ингредиентов на живую систему (организм, культуру тканей или клеток). В результате предварительного выдерживания смеси антител с растворимым антигеном в пробирке последний обезвреживается, что подтверждается реакцией живой системы. Реакцию впервые продемонстрировали Беринг и Китазато в 1890 г. на модели столбнячных токсина и антитоксина. В настоящее время ее используют для видовой и особенно внутривидовой идентификации токсигенных Cl. perfringens, Cl.botulinum и некоторых других микроорганизмов.
Применение реакции преципитации в жидкой среде не позволяет, однако, характеризовать гетерогенность антигенов, то есть количество и концентрацию антигенов в препарате. Данные сведения можно получить, если поставить РП в геле (чаще в агаровом) или реакцию диффузионной преципитации (РДП). Обладая разной скоростью передвижения, различные антигены препарата неодинаково диффундируют, образуя в толще прозрачного геля на месте встречи с гомологичным антителом преципитаты Локализация и конфигурация линий преципитатов будут характерны для каждого компонента антигенного препарата, что служит критерием оценки его качества. Путем разведения препарата можно характеризовать относительное содержание в нем антигенов.
Если в среде геля диффундирует один реагент (обычно антиген), реакцию называют простой или одномерной диффузии, а если навстречу друг другу одновременно диффундируют оба реагента (антиген и антитело), ее называют реакцией двумерной или двойной диффузии.
Реакцию одномерной диффузии можно поставить в пробирке и на стеклянной пластинке. Пробирочный вариант РДП был впервые разработан в 1946 г. Оудином. На дно узкой пробирки помещали антисыворотку, смешанную с агаровым гелем и сверху заливали раствором антигена, покрытым слоем вазелинового масла. Антиген диффундировал в подлежащий слой геля и, вступая в реакцию с антителами, образовывал в нем линии преципитации. По их количеству и локализации судили о качестве антигенного препарата.
Манчини в 1965 г. предложил пластинчатый вариант одномерной РДП, который получил название реакции радиальной имму-нодиффузии (РИД) из-за того, что антиген диффундирует из лунок радиально в гель, смешанный с антисывороткой, в результате чего вокруг лунок образуются кольца преципитации. Диаметр этих колец прямо пропорционален концентрации антигена. На этом основании РИД используют для определения содержания растворимых антигенов (иммуноглобулинов всех классов, токсинов, ферментов, антигенных гормонов).
Но еще в 1948 г. Оухтерлони разработал метод двойной и м-мунодиффузии в агаровый гель. Для этого в пластинке агара вырезалось несколько лунок — центральная и периферические. В центральную лунку помещали антисыворотку, в периферические — растворы различных антигенов или раствор одного антигена в разных разведениях. Диффундирующие реагенты взаимодействуют, образуя линии преципитации в промежутке геля между центральной и периферическими лунками. Таким образом устанавливают количество антигенов в препарате, примерную их концентрацию и степень родства. В последнем случае обращают внимание на совпадение локализации и конфигурации линий преципитации сравниваемых антигенов (реакция идентичности), пересечение этих линий (реакция неидентичности) и наличие шпор у скрещивающихся линий преципитации. Реакция идентичности свидетельствует о тождественности сравниваемых антигенов, неидентичности— об их различиях, а наличие шпор — о содержании в сравниваемых разных препаратах общих антигенных детерминант.
Данная реакция является самым распространенным методом тестирования антигенных свойств растворимых препаратов в экспериментальной работе и широко внедряется в практику диагностических лабораторий из-за своей простоты и высокой чувствительности.
В 1953 г. Оакли и Фултроп предложили более четко воспроизводимый вариант метода Оудина. Он заключается в том, что в стандартные пробирки оба реагента помещают в смеси с агаром и встреча их происходит в пограничном слое геля такой же концентрации. По чувствительности он превосходит метод Оухтерлони.
В 1953 г. Грабар и Вильяме предложили комбинированный метод анализа растворимых антигенов, включающий в себя электрофорез антигена (центральная лунка) в агаровом геле с последующим взаимодействием его с антисывороткой (в боковых канавках) по типу реакции Оухтерлони. Этот метод называется иммуноэлектрофорезсм (ИЭФ) и позволяет более четко разделят^, антигены в испытуемом препарате, то есть более полно характеризовать набор антигенов в препарате. Однако для постановки ИЭФ требуется довольно высокая концентрация реагентов, особенно антигенов (табл. 5).
ИЭФ можно ставить с меченными радиоактивными веществами реагентами, тогда получится радиоиммуноэлектрофорез. С помощью фотоэмульсии он позволяет выявлять самые незначительные количества иммунных глобулинов.
5. Минимальное количество препаратов растворимых антигенов Е. coli 078: К-80, необходимое для образования видимого преципитата при взаимодействии с препаратом IgG крупного рогатого скота (мг/мл)
|
Тест |
Конечная концентрация IgG (мг/мл) |
Потребность гексоз | |
|
О-антигена |
К-антигена | ||
|
РДП РИД ИЭФ |
11, 12 8,40 |
0,0461 0,0923 2,9500 |
0,0630 0,1250 2,0000 |
Растворимые антигены можно также анализировать специфическими реагентами и на довольно высоком уровне чувствительности путем нагружения ими неспецифических носителей — частиц латекса, эритроцитов барана как наиболее резистентных к перепадам осмотического давления. В таких случаях, правда, будет уже не реакция преципитации, а реакции непрямой агглютинации или торможения непрямой гемагглютинации.
Для индикации и идентификации корпускулярных антигенов применяют серологические реакции, основанные на феномене агглютинации, а также иммунохимические методы, сочетающие принципы серологического и микроскопического анализов и представляющие, по существу, феномен микропреципитации меченых антител. К последним относят антитела, меченные ферментами (для светопольной микроскопии), флуорохромами (для люминесцентной микроскопии) и конт-растёрами (для электронной микроскопии).
Антигенный анализ с помощью реакций агглютинации производится со взвесью микроорганизмов, содержащей тысячи и миллионы микробных тел, то есть на уровне популяции, а иммунохимический анализ с использованием меченых антител — на уровне отдельных клеток. Причем д^я применения агглютинационного теста обязательно выделение микроба в чистую культуру, иммунохимический анализ на уровне отдельной клегки может производиться и в смешанной культуре или взвеси микробов.
Реакция агглютинации (РА) пробирочная или пластинчатая выявляет только поверхностные антигенные детерминанты K-.J3- и Н-антигенов микробной клетки. Поскольку К-антиген бактерий покрывает" детерминанты О-антигена, РА ставят с гретой и нативной взвесью идентифицируемой культуры. При этом культуру берут в стационарной фазе роста, когда все поверхностные антигены полностью экспрессированы. Для выявления Н-антигена культуру исследуют раньше.
РА широко используют в ветеринарии для идентификации эшери-хий, сальмонелл и ряда других бактерий. Однако необходимость в выделении микробов в чистую культуру и накопления бактериальной массы снижают чувствительность данного теста и требуют много времени для его осуществления. К тому же при постановке РА не учитываются индивидуальные антигенные свойства бактерий исследуемой популяции, исключается возможность визуальной характеристики антигенов.
Указанных недостатков лишен метод флуоресцирующих антител (МФА), основанный на микропреципитации меченных флуорохромами антител нг фиксированном антигене. Оседая на гомологичной частице, меченые антитела специфически взаимодействуют с отдельными клетками, будь то в чистой или смешанной культуре. Поскольку преципитирующие на частице антитела мечены, они избирательно высвечивают индицируемые объекты. Поэтому даже единичные клетки будут видны в поле зрения микроскопа подобно тому, как свер кают звезды на темном небосклоне. Отсюда более высокая чувствительность МФА по сравнению с РА и возможность использования иммунохимического анализа смешанных антигенов. Последнее делает возможным применение МФА для обнаружения антигенов непосредственно в патологическом материале, что не позволяет ни один серологический метод.
-
![]()
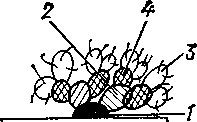
Рис. 52. Основные варианты метода флуоресцирующих антител (схема):
а-—прямой одноступенчатый; б— непрямой двухступенчатый; в — непрямой трехступенчатый (ан-. тикочплементарный) /—антиген, 2 — немеченая сыворотка I ступени (б, в); 3 — меченая сыворотка против искомого антигена (а), антиглобулиновая II (б) и антикомплементарная III (в) ступеней; 4— комплемент сыворотки крови морской свинки.
Из-за того, что отпадает необходимость выделять микроорганизмы в чистую культуру и сокращается время на постановку реакции примерно в 20 раз, метод флуоресцирующих антител считается экспрессным. Принципиально важным преимуществом МФА является также возможность дополнительно характеризовать морфологию исследуемых корпускул, что невозможно сделать при использовании серологических методов. Наконец, в отличие от РП и РА метод флуоресцирующих антител выявляет антигенные детерминанты, взаимодействующие с иммуноглобулинами не отдельных (IgM или IgG), а всех классов, причем с функцией как полных, так и неполных антител.
В лабораторной практике наибольшее распространение получили три варианта МФА: прямой, непрямой двухступенчатый и непрямой трухступенчатый (рис.52).
Прямой „вариант заключается в том, что на фиксированный на стекле антигел_наносят меченою _а^ггисыворотку и инкубируют при температуре тела животного^ 20—г 45_мщи МазокГотмывают от несвязавшихся антител, покрывают нефлуоресцирующей жидкостью (например, диметилфталатом) и просматривают под люминесцентным микроскопом. В положительном случае в поле зрения микроскопа видны ярко сверкающие клетки микроорганизмов. При этом микробы с развитым ригидным веществом по периферии светятся более ярко из-за суммации света от флуоресцирующих молекул, зафиксировавшихся по боковым участкам стенки клеток. Микроорганизмы с неразвитым ригидным слоем в стенке (например, вибрионы, лептоспиры, микоплазмы) обычно уплощаются при фиксации на стекле и поэтому светятся всей поверхностью равномерно.
Прямой вариант достаточно чувствителен, специфичен, прост в исполнении и требует мало времени. Но экономически не выгоден, так как на каждый антиген нужно иметь меченую сыворотку. К тому же он пригоден лишь для обнаружения антигенов, то есть для прямой индикации.
Непрямой двухступенчатый вариант сводится к тому, что на фиксированный антиген вначале наносят антисыворотку в немеченом виде (сыворотка~Т~ступени), а затем уже антивидовую меченую сыворотку (сыворотка II ступени). В положительном случае между антигеном и сывороткой I ступени образуется иммунный комплекс, для выявления которого мы наносим меченую сыворотку II ступени, содержащую антитела, к иммуноглобулинам сыворотки I ступени. Таким образом, иммуноглобулины сыворотки I ступени будут антителами для индицируемого антигена и одновременно антигенами для сыворотки II ступени.
Сыворотка I ступени физически увеличивает размеры светящегося комплекса, поэтому данный вариант чувствительнее прямого и пригоден для обнаружения даже самых мелких микроорганизмов (например, вирусов). Так как сыворотка I ступени применяется в немеченом виде, непрямой вариант можно использовать не только для прямой, но и для обратной индикации, то есть для обнаружения антител. Кроме того, данный вариант экономичнее прямого, так как для его осуществления надо иметь столько меченых антивидовых сывороток, сколько имеется продуцентов сыворотки I ступени. Сыворотку I ступени обычно получают на кроликах, лошадях, волах, баранах, свиньях и курах. Следовательно," располагая набором из 5 — 7 антивидовых меченых сывороток, производственная лаборатория в состоянии выявлять все интересующие ее антигены и антитела.
Непрямой трехступенчатый, или антикомплементарный, вариант заключается в последовательной обработке фиксированного на стекле антигена немеченой антисывороткой (сыворотка I ступени), немеченым комплементом (сыворотка II ступени) и, наконец, меченой антикомплементарной—антивидовой сывороткой (сыворотка III ступени). При наличии в препарате гомологичного сыворотке I ступени антигена между ними образуется иммунный комплекс, на который фиксируется комплемент (сыворотка II ступени). Для выявления последнего мы и наносим антикомплементарную сыворотку (III ступени) в меченом виде.
В качестве источника комплемента (сыворотки II ступени) может служить сыворотка любого животного, но наиболее активен комплемент морской свинки. Поэтому обычно на II ступени применяют сыворотку крови морской свинки, а на III ступени — меченую кроличькмсьь— воротку 'против белков крови морской свинки. Таким образом, при наличии лишь одного меченого реагента можно выявлять любой антиген или любое антитело.
В качестве флуорохромов для метки антител чаще используют флуо-ресцеинтиоизоционат (ФИТЦ), светящийся изумрудно-зеленым цветом. Но в арсенале пригодных для метки антител флуорохромов имеются красители, светящиеся желтым, оранжевым, синим и другими цветами. Если каждым из них пометить антисыворотки различной специфичности, в одном и том же препарате можно наблюдать одновременно совершенно разные антигены или антигенные детерминанты, что также выгодно отличает МФА от серологических методов антигенного анализа.
В случае метки антител светорассеивающими ферментами (например, пероксидаза хрена) иммунные комплексы можно выявлять под обычным светопольным микроскопом, что расширяет возможности и делает более доступным иммунохимический анализ с применением меченых антител. Данный метод обладает многими достоинствами МФА. Однако и он не позволяет рассмотреть детали антигенного строения поверхности микробной клетки и тем более ее внутренних структур. Это удается сделать с помощью иммунохимического анализа, основанного на использовании антител, меченных контрастирующими, то есть рассеивающими электроны веществами на уровне электронной микроскопии. С этой целью антитела конъюгируют с железосодержащим белком печени лошадей или других животных ферритином, ртутьсодержащим соединением—диазофенилмеркуриацетатом или с йодом. Благодаря непроницаемости контрастирующих веществ можно определить количество и локализацию антигенных детерминант на клеточном и субклеточном уровне.
