
- •Лекция 27 карбонильные соединения и карбоновые кислоты.
- •1. Хиноны.
- •2. Карбоновые кислоты и их производные.
- •Получение хинонов
- •Химические свойства хинонов
- •Карбоновые кислоты и их производные
- •Классификация карбоновых кислот.
- •Методы получения
- •Методы, основанные на реакции окисления
- •Лекция 28 карбоновые кислоты и их производные
- •3. Химические свойства.
- •Методы получения карбоновых кислот.
- •Методы, основанные на карбонилировании ненасыщенных углеводородов
- •Карбоксилирование металлоорганических соединений.
- •2.Физические свойства.
- •Химические свойства.
- •Производные карбоновых кислот.
- •Ангидриды карбоновых кислот
- •Сложные эфиры
- •Получение сложных эфиров
- •Лекция 29. Карбоновые кислоты и их производные
- •1.Производные карбоновых кислот (галогенангидриды, амиды, нитрилы).
- •Галогенангидриды
- •Способы получения
- •Амиды карбоновых кислот
- •Получение амидов
- •Нитрилы
- •Получение нитрилов (алкилцианидов).
- •Свойства производных карбоновых кислот
- •Гидролиз.
- •Реакции ацилирования.
- •Реакция переэтерификации.
- •Свойства непредельных одноосновных кислот.
- •Электрофильное присоединение
- •Полимеризация
- •Свойства двухосновных предельных кислот
- •Двухосновные непредельные кислоты
- •Свойства ароматических карбоновых кислот
2.Физические свойства.
Муравьиная и уксусные кислоты обладают раздражающим запахом. Масляная, валериановая, и капроновая кислоты маслянистые малоподвижные жидкости с неприятным запахом. Высшие жирные кислоты не имеют запаха, поскольку обладают малой летучестью. Температуры кипения кислот выше, чем у соответствующих спиртов.
Особенностью молекулярной структуры карбоновых кислот является их склонность к димеризации. Например, уксусная кислота существует в виде димера и в кристалле (тпл. 16оС), и в жидкой фазе и в газообразном состоянии. Димеризация – это общее свойство карбоновых кислот.
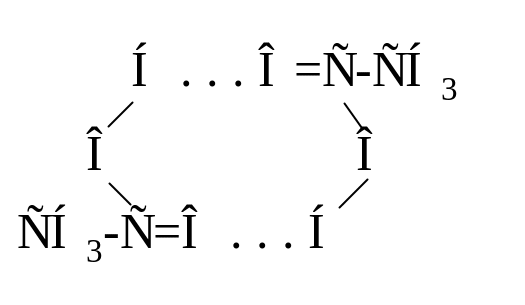
Кроме циклических димеров существуют линейные олигомеры:

Образование димерных или олигомерных ассоциатов за счет сильных водородных связей приводит к резкому увеличению температуры кипения.
Соединение СН3СНО СН3СН2ОН СН3С(О)ОН
Т.кип. 22 78 118
Молекулы карбоновых кислот образуют водородную связь с водой, поэтому они(низшие представители) хорошо растворимы в воде:

Соединение |
СН3СООН |
PhCOOH |
CH3COCH3 |
CH3CH2-OH |
||
мономер |
димер |
мономер |
димер |
|||
Длина связи, Ао, С - О С = О |
1.36 1.21 |
1.33 1.23 |
- - |
1.29 1.24 |
- 1.2 |
1.42 - |
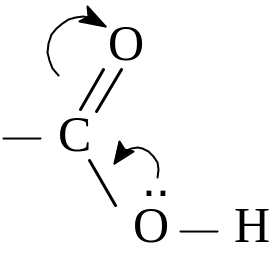
Из таблицы видно, что димеризация сближает значения длин углерода с кислородом, особенно характерно для бензойной кислоты. Связь >С=О длинее, чем в кетонах, а связь С-О –короче, чем в спиртах. Это, видимо подтверждает р-π-взаимодействие в карбоксильной группе:
В случае бензойной кислоты, видимо, орбиталь карбоксильной группы смешивается с π-орбиталями бензольного ядра.
Соединение СН3СН2СООН PhOH CH3COOH
Энергия С-О 91 103 109
связи О-Н 102 85 112
Связь С-О в кислотах становится более прочной, чем даже у фенола. Причина, видимо, та же самая: р-π-сопряжение в карбонильной группе.
Для карбоксильной группы можно привести резонансные структуры:
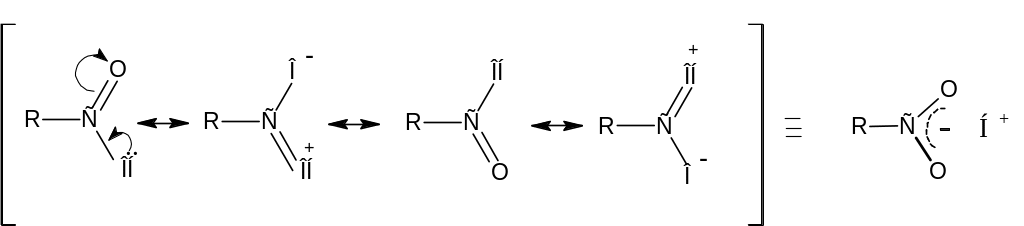
ВЗМО уксусной кислоты, как и в других соединениях, содержащих >С=О группу является nO (C=O)-орбиталь. Орбиталь НЭП атома кислорода гидроксильной группы оказывается третьей сверху.

В общей оценке реакционной способности следует отметить, что карбоновые кислоты имеют несколько реакционных центра:
- ОН – кислотный центр, за счет которого карбоновые кислоты проявляют кислотные свойства в реакциях с основаниями;
- электрофильный центр – атом углерода карбоксильной группы, при участии которого карбоновые кислоты и их функциональные производные вступают в реакции нуклеофильного замещения;
- основный центр – оксогруппа со своей неподеленной парой электронов, которая протонируется на стадии калализа в реакциях нуклеофильного замещения;
- СН-кислотный центр, возникающий у α-атома углерода за счет индуктивного эффекта карбоксильной группы.
