
- •Лекция 27 карбонильные соединения и карбоновые кислоты.
- •1. Хиноны.
- •2. Карбоновые кислоты и их производные.
- •Получение хинонов
- •Химические свойства хинонов
- •Карбоновые кислоты и их производные
- •Классификация карбоновых кислот.
- •Методы получения
- •Методы, основанные на реакции окисления
- •Лекция 28 карбоновые кислоты и их производные
- •3. Химические свойства.
- •Методы получения карбоновых кислот.
- •Методы, основанные на карбонилировании ненасыщенных углеводородов
- •Карбоксилирование металлоорганических соединений.
- •2.Физические свойства.
- •Химические свойства.
- •Производные карбоновых кислот.
- •Ангидриды карбоновых кислот
- •Сложные эфиры
- •Получение сложных эфиров
- •Лекция 29. Карбоновые кислоты и их производные
- •1.Производные карбоновых кислот (галогенангидриды, амиды, нитрилы).
- •Галогенангидриды
- •Способы получения
- •Амиды карбоновых кислот
- •Получение амидов
- •Нитрилы
- •Получение нитрилов (алкилцианидов).
- •Свойства производных карбоновых кислот
- •Гидролиз.
- •Реакции ацилирования.
- •Реакция переэтерификации.
- •Свойства непредельных одноосновных кислот.
- •Электрофильное присоединение
- •Полимеризация
- •Свойства двухосновных предельных кислот
- •Двухосновные непредельные кислоты
- •Свойства ароматических карбоновых кислот
Лекция 27 карбонильные соединения и карбоновые кислоты.
Схема лекции.
1. Хиноны.
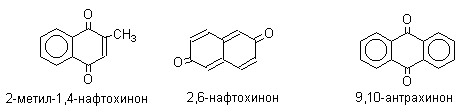
1.1.Классификация и номенклатура.
1.2.Способы получения.
1.2.1.Окисление фенолов.
1.2.2. Окисление бензола фталевым ангидридом.
1.3. Химические свойства.
1.3.1. Восстановление.
1.3.2.Хиноны как дегидрирующие агенты.
1.3.3. Хиноны как непредельные кетоны.
1.3.4. Хиноны в качестве диенофилов.
2. Карбоновые кислоты и их производные.
2.1. Классификация карбоновых кислот.
2.2. Одноосновные карбоновые кислоты.
2.2.1.Строение и номенклатура.
2.2.2. Методы получения
Хиноны
Хиноны по своей структуре являются циклогексадиенонами, но их название происходит от ароматических углеводородов: бензохинон от бензола, толухинон от толуола, нафтохинон от нафталина и т.д. Цифры в начале названия обозначают положение двух карбонильных групп.

Получение хинонов
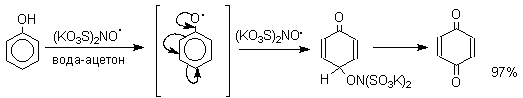
1. Окисление фенолов. Хиноны получают окислением одно- и двухатомных фенолов, аминов и диаминов ароматического ряда. Самый удобный способ получения хинонов заключается в окислении одноатомных фенолов солью Фреми - нитрозодисульфонатом калия. Эта реакция осуществляется в исключительно мягких условиях в водном спирте или ацетоне, выход обычно превышает 90%.
Уникальным реагентом для получения орто-хинонов из одноатомных фенолов оказался (С6Н5SeO)2O.

Для окисления фенолов, ароматических аминов и гидрохинонов до 1,4-бензохинонов и 1,4-нафтохинонов часто используют реагенты на основе хрома (YI). К ним относятся оксид хрома (YI) в уксусной кислоте или реагент Килиани (дихромат натрия и серной кислоты), однако выходы хинонов, как правило, ниже, чем при окислении солью Фреми или карбонатом серебра.

2. Окисление бензола фталевым ангидридом. 9,10-Антрахинон получают также ацилированием бензола фталевым ангидридом по Фриделю-Крафтсу с последующей циклизацией орто-бензоилбензойной кислоты.


Этот один из самых простых и старых способов промышленного получения антрахинона.
Химические свойства хинонов
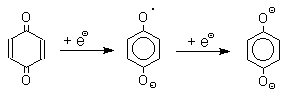
1. Восстановление. Наиболее важной реакцией хинонов является их восстановление до двухатомных фенолов. Восстановление хинонов осуществляется в две стадии. На первой стадии в результате одноэлектронного восстановления образуются анион-радикалы, которые называют также семихинонами. Эти частицы могут быть легко зарегистрированы с помощью ЭПР-спекроскопии. На второй стадии анион-радикал присоединяет еще один электрон с образованием дианиона двухатомного фенола.
Восстановление хинонов до двухатомных фенолов осложняется образованием хингидрона - аддукта состава 1:1 между хиноном и двухатомным фенолом. Хингидрон может быть окислен до хинона или нацело восстановлен до гидрохинона.
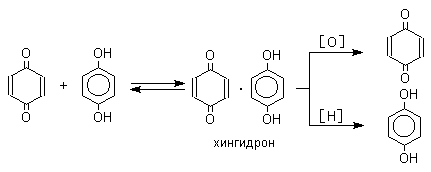
Окрашенный в темнозеленый цвет хингидрон представляет собой классический пример молекулярных комплексов, где один компонент служит донором, а другой - является акцептором электрона. Такие комплексы, где происходит перекрывание ВЗМО донора и НСМО акцептора, получили название комплексов с переносом заряда. К ним относятся -комплексы ароматических соединений с галогенами, катионами серебра и ртути; 1,3,5-тринитробензолом, пикриновой кислотой. Комплексы галогенов или тетрацианоэтилена с n-донорами (спиртами, простыми эфирами) или -донорами - (алкенами или алкинами), также следует рассматривать как комплексы с переносом заряда. В кристаллах хингидрона молекулы хинона и гидрохинона чередуются и располагаются в двух параллельных плоскостях друг над другом. Комплексы с переносом заряда часто интенсивно окрашены. Так, например, тетрацианоэтилен образует с дуролом (1,2,4,5-тетраметилбензолом) комплекс, окрашенный в красный цвет. Окраска комплексов обусловлена переносом заряда от ароматического донора к акцептору, хотя степень переноса заряда невелика и редко превышает 0,1 заряда электрона.
Восстановление хинонов до двухатомных фенолов проводят с помощью самых разнообразных восстановителей, среди которых в лабораторных условиях предпочтение отдается дитиониту натрия Na2S2O4 в щелочной среде.
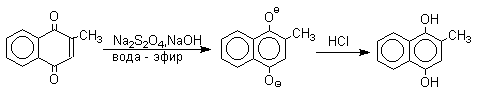
Восстановление антрахиноновых и других кубовых красителей дитионитом натрия в щелочной среде используется для перевода этих нерастворимых в воде соединений в так называемую лейкоформу, которая в виде динатриевой соли хорошо растворима в воде. Таким образом, например, упомянутый выше индантрен восстанавливают в тетрагидропроизводное, имеющее четыре фенольных гидроксила. Это лейкопроизводное хорошо растворимое в воде. Хлопчатобумажную ткань пропитывают раствором лейкоформы и выдерживают на воздухе. Лейкоформа окисляется кислородом до исходного красителя. Такой способ крашения гарантирует однородность окраски ткани. Он применяется при крашении индигоидными и другими кубовыми красителями.

2. Хиноны как дегидрирующие агенты. Легкость восстановления хинонов до фенола открывает возможность для использования хинонов в качестве дегидрирующих агентов. Для этой цели выбирают хиноны с высоким окислительно-восстановительным потенциалом, такие как 2,3,5,6-тетрахлор-1,4-бензохинон (хлоранил); 2,3-дихлор-5,6-дициано-1,4-бензохинон (ДДХ), дифенохинон. 1,2-Хиноны ввиду нестабильности практически не используются в качестве дегидрирующих агентов. Дегидрированию подвергаются дигидроароматические соединения ряда бензола и тетрагидропроизводные ряда нафталина, антрацена, гетероциклических соединений, тропилиден и т.д.


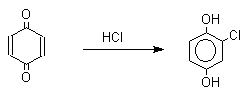
3. Хиноны как непредельные кетоны. 1,4-Хиноны представляют собой типичные α,β-ненасыщенные кетоны и для них характерны реакции 1,2- и 1,4-присоединения к сопряженной системе. 1,4-Бензохинон присоединяет хлористый водород в 1,4-положение с образованием 2-хлоргидрохинона.
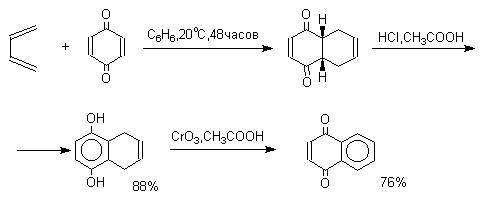
4. Хиноны в качестве диенофилов. 1,4-Бензохинон, 1,4-нафтохинон и их производные проявляют свойства активных диенофилов в реакции Дильса-Альдера. При взаимодействии 1,3-бутадиена с 1,4-бензохиноном при 25оС получается моноаддукт, который медленно енолизуется с образованием соответствующего гидрохинона. Это превращение, как и следовало ожидать, катализируется кислотой. При последующем окислении оксидом хрома (YI) получается 1,4-нафтохинон.
В заключение этого раздела следует отметить, что на протяжении длительного времени хиноны привлекали к себе интерес в производстве огромного количества высококачественных антрахиноновых красителей. Они широко использовались в качестве дегидрирующих агентов. В настоящее время интерес к этому классу соединений снова возрос после того, как было установлено, что целая группа хинонов играет жизненно важную роль переносчика электронов в дыхательных и фотохимических цепях биологических систем. В живых организмах эту роль транспорта электронов в дыхательных цепях в клетках выполняет группа коферментов Q, называемых убихинонами. В природе встречается несколько коферментов Q. Они отличаются друг от друга лишь числом изопреновых единиц, связанных с бензохиноновым кольцом. В организме человека важную роль играет кофермент Q10 (см. вводную часть к данному разделу). Подробные сведения о механизме действия хиноновых коферментов в аэробных системах можно найти в учебниках и монографиях по биоорганической химии.
