- •Применение
- •Химические свойства
- •2 Атома с → этан → этен; 3 атома с → пропан → пропен и т.Д.
- •Промышленное использование этилена
- •Гидратация
- •Гидрогалогенирование
- •6) Полимеризация алкенов
- •Реакции с участием подвижного водорода алкинов
- •Способы получения
- •Химические свойства сопряженных диенов
- •1. Гидрирование
- •2. Галогенирование
- •3. Диеновый синтез (реакция Дильса-Альдера)
- •Природный каучук
- •[Править]Синтетические каучуки
- •14) Арены (ароматические углеводороды)
- •1. Галогенирование
- •2. Нитрование
- •18) Классификация реагентов и реакций
- •Классификация реакций по изменениям углеродного скелета
- •20) Гидроксипроизводные углеводородов
- •Осно́вные свойства спиртов
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Получение
- •26) Химические свойства альдегидов и кетонов
- •Классификация
- •Номенклатура
- •Получение
- •30) Получение
- •Насыщенные дикарбоновые кислоты
- •Номенклатура
- •Изомерия
- •Химические свойства
- •40) Химические свойства
- •Некоторые важнейшие -аминокислоты общей формулы
- •Классификация [править]По радикалу
- •[Править]По функциональным группам
- •[Править]По классам аминоацил-тРнк-синтетаз
- •[Править]По путям биосинтеза
- •[Править]По способности организма синтезировать из предшественников
- •[Править]По характеру катаболизма у животных
- •[Править]«Миллеровские» аминокислоты
- •Незаменимые (Обязательные) аминокислоты
- •43) Химические свойства аминокислот
- •Первичная структура
- •[Править]Вторичная структура
- •[Править]Третичная структура
- •[Править]Четвертичная структура
14) Арены (ароматические углеводороды)
Арены или ароматические углеводороды – это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Реакции присоединения к аренам
В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом.
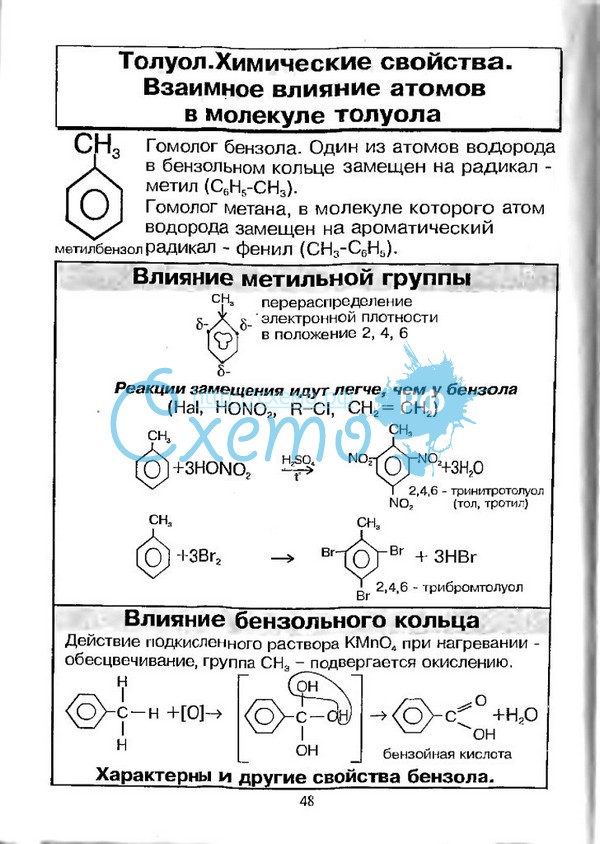
Гидрирование Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов.
Реакции окисления аренов
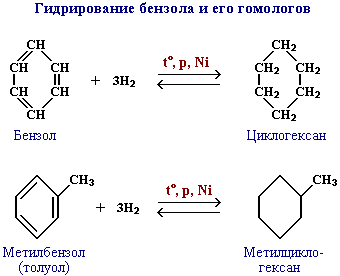
Бензол не окисляется даже под действием сильных окислителей (KMnO4, K2Cr2O7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений.
В отличие от бензола его гомологи окисляются довольно легко.
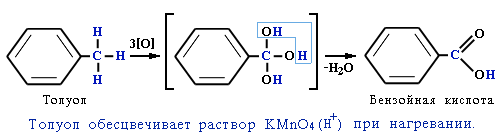
При действии раствора KMnO4 в кислой среде и нагревании в гомологах бензола окислению подвергаются только боковые цепи:
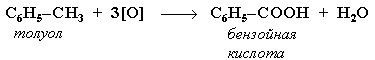
15)) Реакции замещения в бензольном кольце
Механизм реакций – электрофильное замещение.
1. Галогенирование
Замещение атома водорода в бензольном кольце на галоген происходитв присутствии катализаторов AlCl3, AlBr3, FeCl3 и т.п. (кислот Льюиса):
![]()
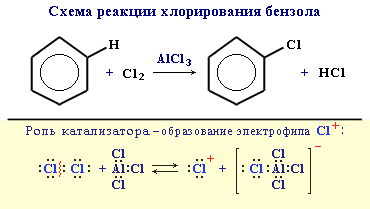
Видеоопыт "Бромирование бензола".
2. Нитрование
Бензол реагирует с нитрующей смесью (смесью концентрированныхазотной и серной кислот):
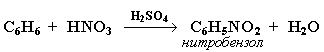
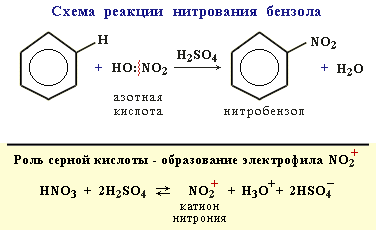
Видеоопыт "Нитрование бензола". 3. Алкилирование
Замещение атома водорода в бензольном кольце на алкильную группу(алкилирование) происходит под действием алкилгалогенидов (реакция Фриделя-Крафтса) илиалкенов в присутствии катализаторов AlCl3, AlBr3, FeCl3 (кислот Льюиса).
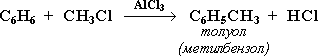
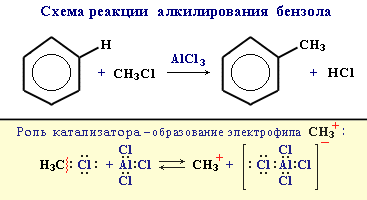
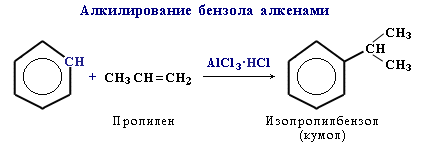
16) Правила ориентации при электрофильном замещении в бензольном кольце основаны на взаимном влиянии атомов в молекуле. Если в незамещенном бензоле С6Н6 электронная плотность в кольце распределена равномерно, то в замещенном бензоле С6Н5Х под влиянием заместителя Х происходит перераспределение электронов и возникают области повышенной и пониженной электронной плотности. Это оказывает влияние на легкость и направление реакций электрофильного замещения. Место вступления нового заместителя определяется природой уже имеющегося заместителя.
Правила ориентации
Заместители, имеющиеся в бензольном ядре, направляют вновь вступающую группу в определенные положения, т.е. оказывают ориентирующее действие.
По своему направляющему действию все заместители делятся на две группы: ориентанты первого рода и ориентанты второго рода. Ориентанты 1-го рода (орто-пара-ориентанты) направляют последующее замещение преимущественно в орто- и пара-положения. К ним относятся электронодонорные группы (электронные эффекты групп указаны в скобках):
-R (+I); -OH (+M,-I); -OR (+M,-I); -NH2 (+M,-I); -NR2 (+M,-I) +M-эффект в этих группах сильнее, чем -I-эффект.
Ориентанты 1-го рода повышают электронную плотность в бензольном кольце, особенно на углеродных атомах в орто- и пара-положениях, что благоприятствует взаимодействию с электрофильными реагентами именно этих атомов. Пример:
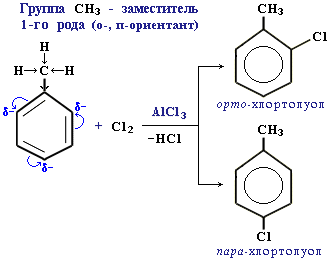
Ориентанты 1-го рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом.
Особое место среди ориентантов 1-го рода занимают галогены, проявляющие электроноакцепторные свойства:-F (+M<–I), -Cl (+M<–I), -Br (+M<–I). Являясь орто-пара-ориентантами, они замедляют электрофильное замещение. Причина - сильный –I-эффект электроотрицательных атомов галогенов, понижащий электронную плотность в кольце.
Ориентанты 2-го рода (мета-ориентанты) направляют последующее замещение преимущественно в мета-положение. К ним относятся электроноакцепторные группы:
-NO2 (–M, –I); -COOH (–M, –I); -CH=O (–M, –I); -SO3H (–I); -NH3+ (–I); -CCl3 (–I).
Ориентанты 2-го рода уменьшают электронную плотность в бензольном кольце, особенно в орто- и пара-положениях. Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета-положении, где электронная плотность несколько выше. Пример:
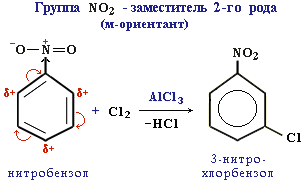
Все ориентанты 2-го рода, уменьшая в целом электронную плотность в бензольном кольце, снижают его активность в реакциях электрофильного замещения.
Таким образом, легкость электрофильного замещения для соединений (приведенных в качестве примеров) уменьшается в ряду:
толуол C6H5CH3 > бензол C6H6 > нитробензол C6H5NO2.
17)