
- •Применение
- •Химические свойства
- •2 Атома с → этан → этен; 3 атома с → пропан → пропен и т.Д.
- •Промышленное использование этилена
- •Гидратация
- •Гидрогалогенирование
- •6) Полимеризация алкенов
- •Реакции с участием подвижного водорода алкинов
- •Способы получения
- •Химические свойства сопряженных диенов
- •1. Гидрирование
- •2. Галогенирование
- •3. Диеновый синтез (реакция Дильса-Альдера)
- •Природный каучук
- •[Править]Синтетические каучуки
- •14) Арены (ароматические углеводороды)
- •1. Галогенирование
- •2. Нитрование
- •18) Классификация реагентов и реакций
- •Классификация реакций по изменениям углеродного скелета
- •20) Гидроксипроизводные углеводородов
- •Осно́вные свойства спиртов
- •Химические свойства
- •Способы получения
- •Химические свойства
- •Получение
- •26) Химические свойства альдегидов и кетонов
- •Классификация
- •Номенклатура
- •Получение
- •30) Получение
- •Насыщенные дикарбоновые кислоты
- •Номенклатура
- •Изомерия
- •Химические свойства
- •40) Химические свойства
- •Некоторые важнейшие -аминокислоты общей формулы
- •Классификация [править]По радикалу
- •[Править]По функциональным группам
- •[Править]По классам аминоацил-тРнк-синтетаз
- •[Править]По путям биосинтеза
- •[Править]По способности организма синтезировать из предшественников
- •[Править]По характеру катаболизма у животных
- •[Править]«Миллеровские» аминокислоты
- •Незаменимые (Обязательные) аминокислоты
- •43) Химические свойства аминокислот
- •Первичная структура
- •[Править]Вторичная структура
- •[Править]Третичная структура
- •[Править]Четвертичная структура
Промышленное использование этилена
Этилен используется для производства целого ряда химических соединений: винилхлорида, стирола, этиленгликоля, этиленоксида, этаноламинов, этанола, диоксана, дихлорэтана,уксусного альдегида и уксусной кислоты[15]. Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла.
5) sp2-гибридизация (характерна для алкенов , диенов и аренов) Три sp² орбиталиПроисходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
Галогенирование (присоединение галогенов)
Присоединение галогенов по двойной связи С=С происходит легко в обычных условиях (при комнатной температуре, без катализатора). Например, быстрое обесцвечивание красно-бурой окраски раствора брома в воде (бромной воды) служит качественной реакцией на наличие двойной связи:
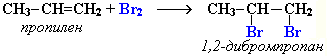
Видеоопыт "Взаимодействие этилена с бромной водой".
Еще легче происходит присоединение хлора:
![]()
Эти реакции протекают по механизму электрофильного присоединения с гетеролитическим разрывом связей в молекуле галогена.
При нагревании до 500 °С возможно радикальное замещение атома водорода при соседнем к двойной связи атоме углерода:
![]() .
.
Гидратация
Реакция присоединения воды к алкенам протекает в присутствии серной кислоты[20]:
![]()
Реакция протекает по правилу Марковникова.
Гидрогалогенирование
Электрофильное присоединение галогенводородов к алкенам происходит по правилу Марковникова:
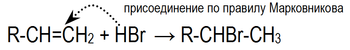
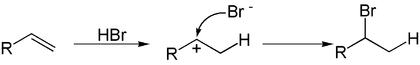
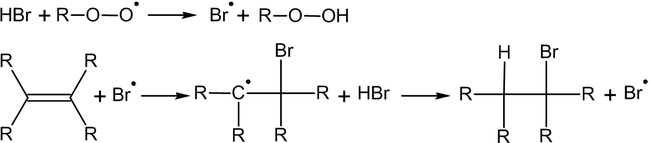
Однако в присутствии перекисей присоединение происходит преимущественно против этого правила (эффект Хараша)[1]:

Это объясняется тем, что реакция в данном случае будет протекать по радикальному механизму и присоединение радикала Br.идет по стерически наиболее доступному концевому атому углерода двойной связи:
Правило Марковникова — в органической химии правило, используемое для предсказаниярегиоселективности реакции присоединения протонных кислот и воды к несимметричным алкенам иалкинам. Наиболее часто данное правило формулируют следующим образом: при присоединении протонных кислот и воды к несимметричным алкенам и алкинам атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Впервые правило было предложено русским химикомВ. В. Марковниковым в 1869 году[1]
6) Полимеризация алкенов
1. Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера) по схеме:
n M ![]() Mn
Mn
Число n в формуле полимера (Mn) называется степенью полимеризации. Реакции полимеризации алкенов идут за счёт присоединения по кратным связям:
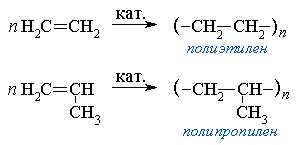
Подробнее процесс полимеризации и понятие о полимерах, имеющих исключительно важное практическое значение, рассматриваются в части VI "Высокомолекулярные соединения"
Высокомолекулярные соединения (полимеры), характеризуются молекулярной массой от нескольких тысяч до нескольких (иногда многих) миллионов. В состав молекул высокомолекулярных соединений (макромолекул)входят тысячи атомов, соединенных химическими связями. Любые атом или группа атомов, входящие в состав цепи полимераили олигомера, называются составным звеном. Наименьшее составное звено, повторением которого может быть описано строение регулярного (см. ниже) полимера, называется составным повторяющимся звеном. Составное звено, которое образуется из одной молекулы мономера при полимеризации, называется мономерным звеном (ранее иногда называлось элементарным звеном). Например, в полиэтилене [—СН2СН2—]n повторяющееся составное звено - СН2, мономерное -СН2СН2.
Использование полимеров
Благодаря своим уникальным свойствам применяются полимеры повсеместно: в машиностроительном и текстильном производстве, медицине и сельском хозяйстве. С помощью высокомолекулярных соединений изготавливают такие изделия как резину, волокна, пластмассы, пленки, клей, лак, посуду. Природные и синтетические полимеры содержат в себе углерод и органические вещества. Некоторые полимеры (например, полиуретан, полиэфир и эпоксидные смолы) предрасположены к воспламенению, что создает повышенный уровень опасности при их практическом использовании. Для предупреждения негативных последствий используются всевозможные добавки или применяются галогенированные полимеры. Применение полимеров в технике – это электроизоляционные и конструкционные материалы. Полимеры - хорошие электроизоляторы, поэтому их широко используют в производстве различных по конструкции и назначению проводов, кабелей, электрических конденсаторов. На основе полимеров получаются материалы, имеющие полупроводниковые и магнитные свойства. А поливинилхлоридные полимеры (пластмасса белого цвета) используются в производстве ПВХ окон.
7). Алки́ны (иначе ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n-2. Атомы углерода при тройной связи находятся в состоянии sp-гибридизации.

![]()
Алкины
3D модель ацетилена — простейшего алкина
Для алкинов характерны реакции присоединения. В отличие от алкенов, которым свойственны реакции электрофильного присоединения, алкины могут вступать также и в реакции нуклеофильного присоединения. Это обусловлено значительным s-характером связи и, как следствие, повышенной электроотрицательностью атома углерода. Кроме того, большая подвижность атома водорода при тройной связи обуславливает кислотные свойства алкинов в реакциях замещения.
Изомерия и номенклатура
Согласно IUPAC названия алкинов образуют, заменяя в названиях алканов суффикс “-ан” на “-ин”. В качестве родоначальной структуры выбирают самую длинную цепь, содержащую тройную связь. Нумерацию этой цепи начинают с того конца, к которому ближе находится тройная связь.
Примеры
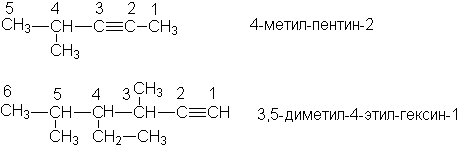
Названия остатков алкинов образуют, присоединяя суффикс –ил к названию алкина:
HC C- этинил
СН3-С С- пропинил-1
НС С-СН2- пропинил-2.
В рациональной номенклатуре замещенные алкины рассматриваются как производные ацетилена:
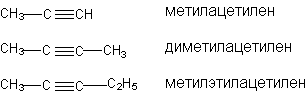
Структурная изомерия начинается с 4-го “С”, изомерия, связанная с изомерией углеродного скелета начиная с 5 “С”. По числу изомеров ацетиленовые углеводороды занимают промежуточное положение между алканами и алкенами.
8)
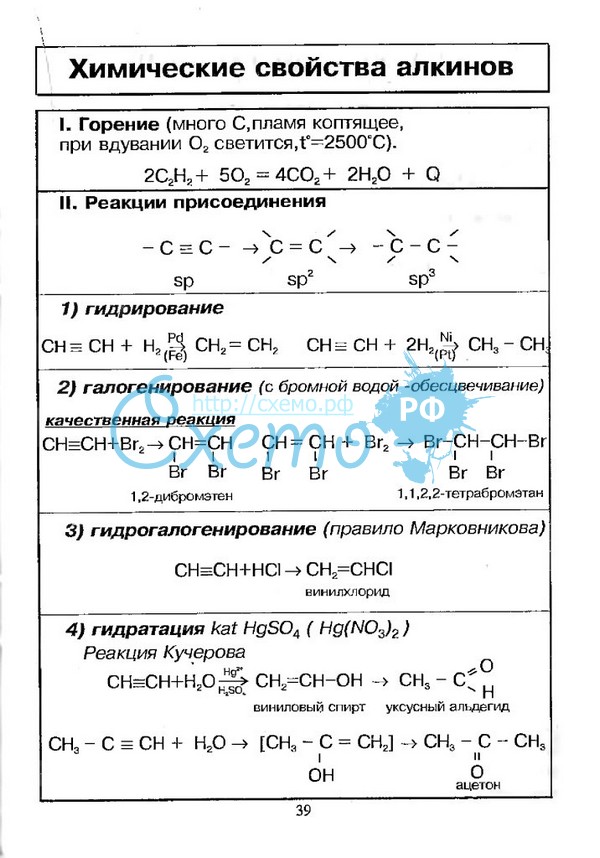
sp-гибридизация (характерна для алкинов) Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов
