
- •Коррозия и защита металлов от коррозии Содержание
- •Раздел 1 Химическая коррозия металлов 5
- •2.13.Электрохимическая защита от коррозии 37
- •Раздел 3. Методы защиты..............................................................54
- •3.4.2. Методы нанесения металлических покрытий 65
- •Раздел 4. Коррозионная стойкость сплавов................................77
- •Коррозия и защита металлов от коррозии Введение
- •1. Что такое коррозия?
- •2. Коррозионная проблема _ Значение коррозионных исследований определяется 4 аспектами.
- •3. Структура металлов и ее влияние на коррозионные процессы
- •Раздел 1 Химическая коррозия металлов
- •1.1.Термодинамика химической коррозии металлов
- •1.2. Механизм газовой коррозии
- •1.3. Свойства пленок
- •Условие сплошности
- •1.4. Законы роста оксидных пленок во времени
- •1.5. Влияние внешних и внутренних факторов на скорость коррозии
- •1.5.1. Влияние температуры на скорость газовой коррозии
- •1.5.2. Состав газовой среды
- •1.5.3.. Давление газов
- •1.5.4. Режим нагрева
- •1.5.5. Состав сплава и пленки
- •1.6. Показатели коррозии
- •1.7.Оксидные пленки на поверхности железа
- •1.8.Газовая коррозия железа, стали, чугуна
- •1.8.1. Рост чугунов. Водородная коррозия. Карбонильная коррозия. Коррозия в среде хлора и хлороводорода.
- •1.8.2.Коррозия под действием продуктов сгорания топлива
- •При этом ухудшается пластичность стали
- •1.9.Методы защиты от газовой коррозии.
- •1.10.Классификация пленок на металлах по толщине
- •1.11.Теория жаростойкого легирования
- •Раздел 2 Электрохимическая коррозия металлов
- •2.1. Определение электрохим. Коррозии
- •2.2 Механизм электрохимической коррозии
- •2.3.Вычисление электродного потенциала e
- •2.4.Составление гальванического элемента и
- •2.5. Кинетика электрохимической коррозии
- •2.6.Диаграмма Пурбе.
- •2 .7. Условия возникновения коррозионного процесса
- •2.8.Поляризация. Деполяризация .
- •Анодная поляризация
- •Катодная поляризация
- •Катодная деполяризация.
- •А) Водородная деполяризация (перенапряжение водорода)
- •Б) Кислородная деполяризация (перенапряжение кислорода)
- •2.9. Поляризационные кривые
- •2.10. Пассивное состояние металлов и сплавов
- •2.11. Коррозионные диаграммы
- •2.12. Влияние внутренних и внешних факторов на скорость коррозии
- •2.12. 1 Влияние рН среды
- •2.12.2. Влияние температуры на скорость коррозии.
- •2.13.Электрохимическая защита от коррозии
- •2.14. Локальные виды коррозии и коррозионно-механические разрушения металлов.
- •2.14. 1. Локальные виды коррозии
- •2.15. Коррозия металлов в природных и технологических средах
- •2.15. 1. Атмосферная коррозия металлов
- •2.15. .2 Почвенная коррозия металлов
- •2.15. 3. Морская коррозия металлов
- •2.16. Влияние конструктивных факторов на развитие коррозионных разрушений машин и аппаратов
- •Раздел 3. Методы защиты
- •3.2. Замедлители ( ингибиторы) электрохимической
- •3.4. Металлические и неорганические покрытия
- •3.4.1. Защитные металлические покрытия
- •Классификация покрытий
- •Взаимосвязь покрытие - основа
- •Пористость покрытий
- •Электронанесение красок
- •Автофорез
- •3.6. Тонкослойные химические покрытия. Фосфатные и оксидные защитные пленки
- •3.6.1. Фосфатирование
- •3.6.2. Оксидирование
- •3.6.3. Пассивирование
- •3.6.4. Анодирование
- •Раздел 4. Коррозионная стойкость сплавов
- •4.1. Коррозия сплавов на основе железа
- •4.1.1. Коррозия углеродистых сталей
- •4.2.2. Медь и ее сплавы
- •Лабораторна робота №1 кінетика окиснення металів на повітрі
- •Оформлення результатів
- •Розділ іі. Електрохімічна корозія
- •Гравіметричний метод визначення швидкості корозії
- •Оформлення результатів
- •Розділ III. Засоби захисту металів від корозії Лабораторна робота № 6 захист металів від корозії за допомогою інгібіторів
2.13.Электрохимическая защита от коррозии
Природа процессов коррозии в электролитах, как было показано выше электрохимическая. При этом. коррозия является результатом ионизации металла за счет отдачи им электронов окислительному компоненту среды, т. е. связана с направленным протеканием тока в системе металл—электролит. Очевидно, этот процесс можно остановить или приостановить путем изменения направления тока или создания условий, затрудняющих отдачу металлом электронов. Решение указанных задач с использованием внешнего тока является сущностью электрохимической защиты.
Различают два способа электрохимической защиты. Первый из них, обеспечивающий изменение направления тока в системе металл—электролит, называется катодной защитой. Второй способ, затрудняющий или предотвращающий отдачу металлом электронов, называется анодной защитой.
В общем случае под электрохимической защитой понимается перевод металла в нереакционноспособное состояние путем электродной поляризации.
Катодная защита— способ предотвращения коррозии путем катодной поляризации металла со сдвигом его потенциала в отрицательную сторону. Катодная защита сводитсяI к тому, чтобы обеспечить на поверхности металла возможность протекания только (или преимущественно) катодных процессов.
Анодная защита — способ предотвращения коррозии путем анодной поляризации металла со сдвигом его потенциала в положительную сторону. Анодная защита сводится к тому, чтобы обеспечить создание на поверхности металла защитной пассивирующей пленки.
Электрохимические способы защиты осуществляются : с помощью внешних источников постоянного тока или протекторов, имеющих по сравнению с защищаемой конструкцией потенциал более отрицательный при катодной защите или более положительный — при анодной. В отечественной литературе и практике часто электрохимический способ защиты с применением протекторов называется протекторной защитой. Этот термин неудачен, однако для удобства с некоторыми оговорками мы им пользуемся.
Таким образом, имеется принципиальная возможность катодной и анодной защиты металлов от коррозии. Однако, как будет показано ниже, величины защитных потенциалов значительно отличаются от теоретических значений. Во многих случаях при Е коррозия не предотвращается, а усугубляется.
Механизм электрохимической защиты
Во всех электродных процессах сугубо электрохимической стадией является только стадия разряда — ионизация. В связи с этим объяснение механизма электрохимической защиты зиждется на закономерностях кинетики процессов именно этой стадии. Механизм электрохимической защиты поясняется с помощью поляризационных диаграмм, раскрывающих кинетику электродных реакций.
Электрохимическая защита состоит в катодной или анодной поляризации защищаемой конструкции. Она осуществляется присоединением к конструкции извне источника постоянного тока или постороннего электрода— протектора. Электрохимическую защиту подразделяют на катодную и анодную.
Катодная защита применяется для предохранения металлических изделий, находящихся в почве, морской воде, а также для защиты аппаратуры химических и других заводов (холодильники, конденсаторы, теплообменники и др.), хранилищ нефти и др. Она осуществляется присоединением металлоконструкции к отрицательному полюсу внешнего источника постоянного тока или к металлу с более отрицательным потенциалом (анодный протектор). Такое присоединение превращает металлоконструкцию в катод и . тем самым предохраняет металл от разрушения. При катодной защите помощью источника постоянного внешнего тока (рис. 22) в качестве вспомогательного электрода (анода) используют нерастворимые материалы (графит, уголь) или растворяющийся металлический лом (рельсы, старые трубы и т. д.), который периодически нужно возобновлять.
При использовании анодного протектора создается гальванический элемент, в котором металлоконструкция является катодом, а протектор — растворимым анодом (рис. 23). В качестве протектора ис-
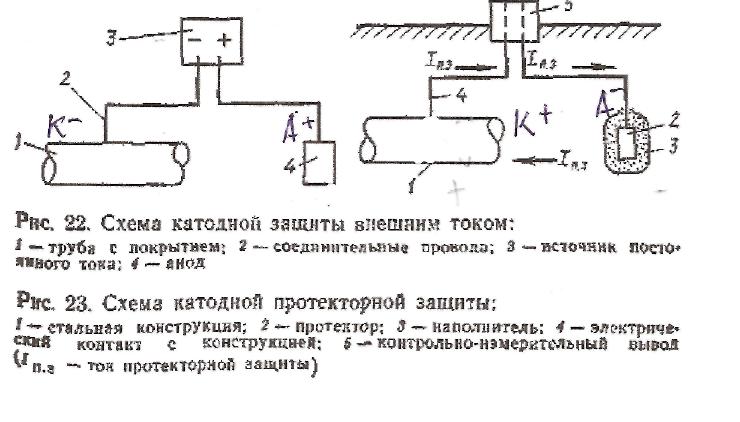
пользуют магний, цинк и их сплавы. Протектор работает эффективно, если переходное сопротивление между ним и коррозионной средой невелико. При защите изделия, лежащего в почве, протектор помещают в наполнитель — смесь неорганических солей с глиной, понижающих переходное сопротивление. Площадь протектора должна составлять 0,2—0,5 % от площади защищаемой конструкции.
Эффективность катодной защиты оценивают по защитному эффекту Z (в %) и коэффициенту защитного действия К.
Защитный эффект Z определяют по формуле Z=((K1 –K2)/K1 ) 100%
где К1— скорость коррозии металла без электрозащиты и К2 - с электрозащитой соответственно, г/(м2 -ч).
Коэффициент защитного действия К равен
К =( ∆m1 – ∆m2)/ ik
где ∆m1 и ∆m2 — убыль массы металла без электрозащиты и с ней соответственно, г/м2; ik плотность катодного тока, А/м2.
Эффективность катодной защиты возрастает, если ее применять совместно с защитными покрытиями, например с нанесением битумного покрытия на трубопроводы.
При использовании катодной защиты, особенно с помощью внешнего источника постоянного тока, можно обеспечить полную защиту металлоконструкции от коррозии, т. е. достичь Z= 100%. Для этого нужно, чтобы потенциал защищаемого металла был равен равновесному.
Анодная защита применяется для защиты аппаратуры, изготовленной из нержавеющих и углеродистых сталей, титана, циркония и т. д., при работе в сильно агрессивных средах. Ее используют также часто с целью снижения -I загрязнений агрессивной среды продуктами коррозии.
Анодная защита применяется «только в тех случаях , когда металл или сплав способны перейти в пассивное состояние:. Анодная защита осуществляется присоединением защищаемого изделия к положительному полюсу внешнего источника постоянного тока или к металлу с более положительным потенциалом (катодный протектор). При этом потенциал защищаемого металла должен сместиться в область устойчивого пассивного состояния .
Катоды, используемые при анодной защите от внешнего источника, тока, должны иметь высокую устойчивость в коррозионной среде. Выбор материала катода определяется характером среды. Помимо платины, применяют хромоникелевые стали (для кислот), кремнистый чугун (для растворов неорганических солей, серной кислоты), никель (для щелочных сред).
В качестве катодного протектора можно использовать такие материалы, как углеграфит, диоксид марганца, магнетит, диоксид свинца, имеющие весьма положительный потенциал. Скорость коррозии при анодной защите может быть снижена до минимальной величины, соответствующей току полной пассивации , но никогда не уменьшается до нудя, как в случае катодной защиты.
