
- •Коррозия и защита металлов от коррозии Содержание
- •Раздел 1 Химическая коррозия металлов 5
- •2.13.Электрохимическая защита от коррозии 37
- •Раздел 3. Методы защиты..............................................................54
- •3.4.2. Методы нанесения металлических покрытий 65
- •Раздел 4. Коррозионная стойкость сплавов................................77
- •Коррозия и защита металлов от коррозии Введение
- •1. Что такое коррозия?
- •2. Коррозионная проблема _ Значение коррозионных исследований определяется 4 аспектами.
- •3. Структура металлов и ее влияние на коррозионные процессы
- •Раздел 1 Химическая коррозия металлов
- •1.1.Термодинамика химической коррозии металлов
- •1.2. Механизм газовой коррозии
- •1.3. Свойства пленок
- •Условие сплошности
- •1.4. Законы роста оксидных пленок во времени
- •1.5. Влияние внешних и внутренних факторов на скорость коррозии
- •1.5.1. Влияние температуры на скорость газовой коррозии
- •1.5.2. Состав газовой среды
- •1.5.3.. Давление газов
- •1.5.4. Режим нагрева
- •1.5.5. Состав сплава и пленки
- •1.6. Показатели коррозии
- •1.7.Оксидные пленки на поверхности железа
- •1.8.Газовая коррозия железа, стали, чугуна
- •1.8.1. Рост чугунов. Водородная коррозия. Карбонильная коррозия. Коррозия в среде хлора и хлороводорода.
- •1.8.2.Коррозия под действием продуктов сгорания топлива
- •При этом ухудшается пластичность стали
- •1.9.Методы защиты от газовой коррозии.
- •1.10.Классификация пленок на металлах по толщине
- •1.11.Теория жаростойкого легирования
- •Раздел 2 Электрохимическая коррозия металлов
- •2.1. Определение электрохим. Коррозии
- •2.2 Механизм электрохимической коррозии
- •2.3.Вычисление электродного потенциала e
- •2.4.Составление гальванического элемента и
- •2.5. Кинетика электрохимической коррозии
- •2.6.Диаграмма Пурбе.
- •2 .7. Условия возникновения коррозионного процесса
- •2.8.Поляризация. Деполяризация .
- •Анодная поляризация
- •Катодная поляризация
- •Катодная деполяризация.
- •А) Водородная деполяризация (перенапряжение водорода)
- •Б) Кислородная деполяризация (перенапряжение кислорода)
- •2.9. Поляризационные кривые
- •2.10. Пассивное состояние металлов и сплавов
- •2.11. Коррозионные диаграммы
- •2.12. Влияние внутренних и внешних факторов на скорость коррозии
- •2.12. 1 Влияние рН среды
- •2.12.2. Влияние температуры на скорость коррозии.
- •2.13.Электрохимическая защита от коррозии
- •2.14. Локальные виды коррозии и коррозионно-механические разрушения металлов.
- •2.14. 1. Локальные виды коррозии
- •2.15. Коррозия металлов в природных и технологических средах
- •2.15. 1. Атмосферная коррозия металлов
- •2.15. .2 Почвенная коррозия металлов
- •2.15. 3. Морская коррозия металлов
- •2.16. Влияние конструктивных факторов на развитие коррозионных разрушений машин и аппаратов
- •Раздел 3. Методы защиты
- •3.2. Замедлители ( ингибиторы) электрохимической
- •3.4. Металлические и неорганические покрытия
- •3.4.1. Защитные металлические покрытия
- •Классификация покрытий
- •Взаимосвязь покрытие - основа
- •Пористость покрытий
- •Электронанесение красок
- •Автофорез
- •3.6. Тонкослойные химические покрытия. Фосфатные и оксидные защитные пленки
- •3.6.1. Фосфатирование
- •3.6.2. Оксидирование
- •3.6.3. Пассивирование
- •3.6.4. Анодирование
- •Раздел 4. Коррозионная стойкость сплавов
- •4.1. Коррозия сплавов на основе железа
- •4.1.1. Коррозия углеродистых сталей
- •4.2.2. Медь и ее сплавы
- •Лабораторна робота №1 кінетика окиснення металів на повітрі
- •Оформлення результатів
- •Розділ іі. Електрохімічна корозія
- •Гравіметричний метод визначення швидкості корозії
- •Оформлення результатів
- •Розділ III. Засоби захисту металів від корозії Лабораторна робота № 6 захист металів від корозії за допомогою інгібіторів
2.11. Коррозионные диаграммы
Отдельно полученные анодные и катодные поляризационные кривые еще не описывают скорость коррозионного процесса. Последняя определяется скоростью протекания самой медленной, лимитирующей стадии. Эту стадию называют контролирующим фактором. Для его определения наибольшее распространение получил графический метод. По этому методу анализ коррозионных систем принято проводить с помощью диаграмм, на которых графически отражена кинетика анодной и катодной реакций. На этих диаграммах значение потенциала откладывается по ординате, а по оси абсцисс откладывают величины и анодного, и катодного токов, вне зависимости от того, что они имеют противоположенное направление (рис. 4.12).
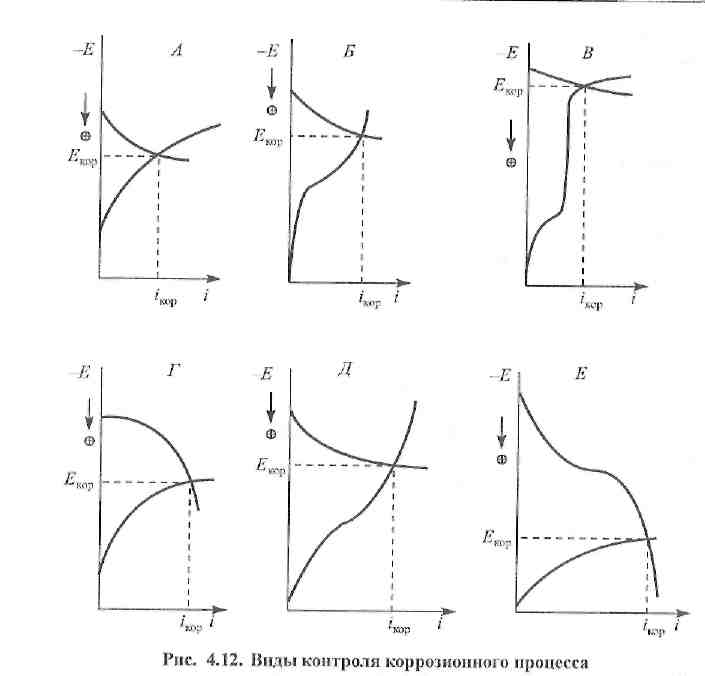
При этом устанавливается общий потенциал коррозии Екор.
Коррозионные диаграммы позволяют определить тормозящий (контролирующий) фактор процесса коррозии. Это очень важно при выборе метода защиты от коррозии, так как, как правило, наиболее эффективно воздействовать на лимитирующую стадию процесса.
Значительная поляризация процесса видна из большой величины наклона соответствующей поляризационной кривой. Пологая кривая указывает на малую затрудненность реакции. Например, при значительной анодной поляризации и малой величине катодной поляризации потенциал коррозии Екор близок к катодному потенциалу Ек до прохождения тока. Если ∆Еа>>∆Ек, то коррозия протекает с анодным торможением, если ∆ЕК >> ∆Еа, то коррозия протекает с катодным контролем. Если ∆ЕК ≈ ∆Еа — имеет место смешанный контроль.
Н.Д. Томашов определил, что в практических условиях встречаются шесть основных случаев контроля коррозии, которые представлены на рис. 4.12.
Катодный контроль (∆ЕК >> ∆Еа):
А.Тормозящий фактор — трудность реакции восстановления молекул О2- Встречается в нейтральных растворах при хорошем перемешивании.
Б. Тормозящий фактор—диффузия кислорода. Диаграмма характерна для коррозии в неперемешиваемых нейтральных растворах. Так корродируют железо, цинк и некоторые другие металлы.
В. Лимитирующий фактор — трудность реакции разряда ионов водорода. Характерна для процесса коррозии железа и цинка в кислых растворах.
Г. Смешанный катодно-анодный контроль (∆ЕК ≈ ∆Еа). Диаграмма характерна для коррозии железа, сталей, алюминия и других металлов в пассивном состоянии.
Д. Смешанный катодно-омический контроль (∆Ек>>∆Еа,R≠0). Коррозия протекает в среде с низкой электропроводностью. Например, коррозия подземных трубопроводов.
Е. Смешанный катодно-анодно-омический контроль (∆Ек ≈ ∆Еа, R≠0). Наблюдается этот вид контроля у металлов, склонных к пассивации при большом омическом сопротивлении электролита, например, при атмос-ферной коррозии сталей.
2.12. Влияние внутренних и внешних факторов на скорость коррозии
Внутренние Внешние
1. Хим. состав сплава 1. Хим. активность среды, рН
2. Структура мет. 2. Температура.
3. Состояние поверхности 3. Давление
4. Условия эксплуатации 4. Скорость движ. электролита.
5. Концентрация эл-та.
