
- •Тема 3.Электронное строение атомов и периодический закон.
- •3.1 Лучистая энергия
- •3.2 Квантовая теория.
- •3.3 Фотоэлектрический эффект.
- •3.4 Атомные спектры
- •3.5 Двойственная природа материи
- •3.6 Принцип неопределенности
- •3.7 Квантовомеханическое описание атома
- •3.8. Периодический закон и таблица элементов.
3.6 Принцип неопределенности
Если ē-н обладает волновыми и корпускулярными свойствами, то можно ли точно сказать, где он локализован? Разрешил этот вопрос немецкий физик В. Гейзенберг, который пришёл к выводу, что для ē-на невозможно одновременно установить ни его скорость движения, ни его координаты в пространстве, что известно как принцип неопределённости Гейзенберга:
 (3.7)
(3.7)
Где Δq- неопределённость положения ē-на, Δv- неопределённость скорости ē-на; mē –масса ē-на.
Гипотеза Луи де Бройля и принцип неопределённости Гейзенберга положили начало новой теории атомного строения.
3.7 Квантовомеханическое описание атома
Из-за невозможности определения положения индивидуального ē-на относительно ядра, квантовомеханическая модель рассматривает только вероятностное нахождение ē-на в определённой области пространства в заданный момент времени. Его движение описывается так называемой волновой функцией ᴪ (гр. псн.) в зависимости от координат x, y, z, которую предложил швейцарский физик Шрёдингер (1887-1961):
 (3.8)
(3.8)
Где
Е-
полная энергия электрона; U-потенциальная
энергия ē-на;
 число
3,141592653589…
число
3,141592653589…
Физический
смысл
ᴪ
состоит
в том, что её квадрат
 пропорционален
вероятности нахождения ē-на в малом
объёме пространства (dv)
с координатами x,
y,z.
пропорционален
вероятности нахождения ē-на в малом
объёме пространства (dv)
с координатами x,
y,z.
Трёхмерность ē- ой волны потребовала в соответствии с числом координатных осей в пространстве трёх постоянных для решения уравнения (3.8)-трёх так называемых квантовых чисел: главного (n), побочного (l) или орбитального и магнитного (m) . Они отражают волновые свойства электрона. Четвёртое квантовое число - спиновое, характеризует корпускулярные свойства ē-на; в решение уравнения Шрёдингера оно не входит.
Главное квантовое число «n» принимает значения 1, 2, 3, 4 и т. д. Оно ответственно за энергию электрона
1эВ=1,602 Дж
Дж
1Дж=1,1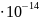
 =
=
 ,
(3.9)
,
(3.9)
Побочное квантовое число l характеризует пространственные формы орбиталей, на которых находятся ē –ны. Оно может принимать значения от 0 до (n-1), то есть l=0,1,2,3,… (n-1), которые назвали подоболочками и обозначили латинскими буквами:
Значение l |
0 |
1 |
2 |
3 |
4: |
Подоболочки, (подуровни) |
s |
p |
d |
f |
q |
В отсутствии магнитного поля орбитали одной полоболочки имеют одинаковую энергию. Такие орбитали называются вырожденными. Когда атомы помещены в магнитное поле (внешнее), то происходит расщепление p-,d-,и f –орбиталей (эффект Зеемана) за счёт дополнительной энергии.
Таким образом, под влиянием внешнего магнитного поля орбитальные энергии ē –в становятся дискретными, т. е. квантованными, что характеризуется магнитным (ориентационным) квантовым числом « m », которое может принимать целочисленные значения в пределах:
 (3.10)
(3.10)
Например для p-подуровня m=-1, 0, +1, т.е. имеет три подуровня, проходя через нулевое значение.
М агнитное
квантовое число «m»
определяет количество орбиталей
(квантовых ячеек ) )на каждом подуровне
(подоболочке), равное значению: (2l+1).
агнитное
квантовое число «m»
определяет количество орбиталей
(квантовых ячеек ) )на каждом подуровне
(подоболочке), равное значению: (2l+1).
Таким
образом,
общее число атомных орбиталей на
энергетических уровнях атома определяется
значениями трёх квантовых чисел n
,l
,m.
Спиновое
квантовое число, обозначаемое через s
 характеризует движение ē-на вокруг
собственной оси…
характеризует движение ē-на вокруг
собственной оси…
На рис. 3.2 показано относительное расположение энергетических уровней s- ,p-, d- подоболочек.

Рис. 3.2 Диаграммы электронных энергетических уровней-подоболочек (1s-4d)
Каждый ē-н в атоме имеет свой индивидуальный набор квантовых чисел, которым он отличается от всех других ē-в данного атома.
Электронная конфигурация атомов представляет собой запись распределения электронов по оболочкам( энергетическим уровням), по подоболочкам и орбиталям в их основном (стационарном), состоянии. Для осуществления такой записи имеется три правила (принципа):
1.Электроны в основном состоянии атома заполняют орбитали последовательности повышения орбитальных энергетических уровней рис.3.2
2. Принцип (запрета) Паули : на любой орбитали может находится не более 2 электронов, с противоположными спинами
3. Правило Хунда: заполнение одной подоболочки начинается одиночными электронами и, после того, как одиночные ē –ны займут все орбитали, происходит окончательное заполнение орбиталей ē-ми с противоположными спинами.
Приведем пример (электронной формулы) электронной конфигурации атома
кислорода
( :
:
 его электронно-графическая форма имеет
другую запись:
его электронно-графическая форма имеет
другую запись:

Для
инертных газов
(Ne,
Ar)
электронная конфигурация имеет общий
вид:
 , где
n-главное
квантовое число.
, где
n-главное
квантовое число.
Наиболее
распространённым
способом наглядного представления
пространственных характеристик орбиталей
является их контурное изображение:
s-орбиталей
в виде шаровой формы, в центре которой
находится ядро атома; p,
-d,
-f-
орбиталей
в виде сложных комбинаций между собой
гантелеобразных комбинаций электронных
облаков, не пересекающихся между
собой….(![]()
 большая
ошибка физиков….?)
большая
ошибка физиков….?)
