
- •Синтез 2,6-бис(фениламинометил)пиридина
- •Оглавление
- •Введение
- •Обзор литературы Методы получения альдегидов
- •Окисление первичных спиртов
- •Восстановление карбоновых кислот и их производных
- •Получение альдегидов из оксиранов
- •Методы получения иминов
- •Методы синтеза аминов
- •Обсуждение результатов
- •Экспериментальная часть
- •Синтез 2,6-диформилпиридина [7]
- •Синтез 2,6-бис((фенилимино)метил)пиридина [12]
- •Синтез 2,6-бис(фениламинометил)пиридина [11]
- •Список литературы
Московский государственный университет им. М.В. Ломоносова
Химический факультет
Кафедра органической химии
Синтез 2,6-бис(фениламинометил)пиридина
Курсовая работа
по органической химии
студентки 306 группы
Сохраняевой А.С.
Научный руководитель:
канд. хим. наук
Зайцев К.В.
Преподаватель группы:
доцент Зайцева Г.С.
Москва, 2008 г.
Оглавление
Оглавление 2
Введение 3
Обзор литературы 4
Методы получения альдегидов 4
Окисление первичных спиртов 4
Восстановление карбоновых кислот и их производных 5
Получение альдегидов из оксиранов 6
Методы получения иминов 8
Методы синтеза аминов 9
Обсуждение результатов 13
Экспериментальная часть 16
Синтез 2,6-диформилпиридина [7] 16
Синтез 2,6-бис((фенилимино)метил)пиридина [12] 17
Синтез 2,6-бис(фениламинометил)пиридина [11] 17
Выводы 19
Список литературы 20
Введение
В последнее время особое внимание исследователей привлекают комплексы переходных металлов с тридентатными азотосодержащими лигандами. Эти соединения являются хорошими катализаторами процессов полимеризации олефинов [1]. В качестве лигандов часто используют макроциклы, содержащие пиридин. Природа заместителей при атомах, координирующих металл, влияет на активность катализатора благодаря электронным и стерическим эффектам в ближайшем окружении металла. Кроме того, такие комплексы катализируют процессы разложения пероксида водорода, эпоксидирования алкенов, окисления бензиловых спиртов до альдегидов [2]. Используемые в качестве лигандов макроциклы, содержащие пиридин, можно эффективно использовать для разделения актинидов и лантанидов [2]. Также эти макроциклы проявляют антибактериальную активность [3].
Целью настоящей работы являлся трёхстадийный синтез одного из возможных лигандов, 2,6-бис(фениламинометил)пиридина (4). Это вещество было синтезировано следующим способом:
Окисление 2,6-ди(гидроксиметил)пиридина (1) до 2,6-диформилпиридина (2) под действием оксида селена (IV) в диоксане.
Конденсация 2,6-диформилпиридина (2) с двумя эквивалентами анилина в присутствии кислоты с образованием 2,6-бис((фенилимино)метил)пиридина (3).
Восстановление 2,6-бис((фенилимино)метил)пиридина (3) до 2,6-бис(фениламинометил)пиридина (4) под действием боргидрида натрия.
Обзор литературы Методы получения альдегидов
Первой стадией курсовой работы являлся синтез 2,6-пиридиндикарбальдегида, поэтому в литературном обзоре рассмотрены возможные методы синтеза альдегидов. Особое внимание уделено методам получения ароматических альдегидов.
Окисление первичных спиртов
Одним из наиболее распространённых методов получения альдегидов является окисление первичных спиртов.
Среди окислителей на основе переходных металлов широко используются производные хрома (VI). Например, использование хромовой кислоты позволяет избежать окисления до карбоновой кислоты [4].
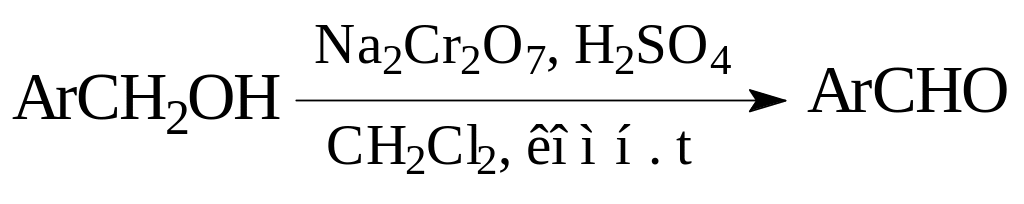
Оксид хрома (VI) чаще всего используется в виде пиридинового комплекса в хлористом метилене. Указанный метод является наиболее простым в применении [4].
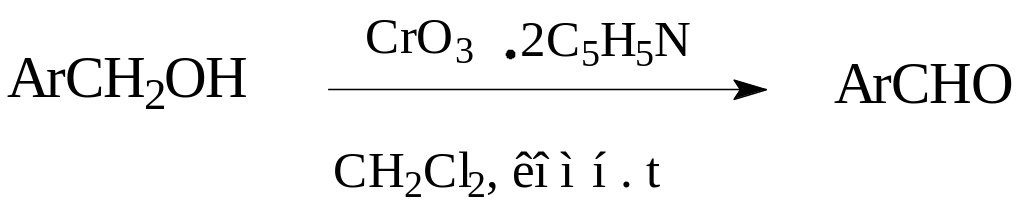
Широкое применение нашёл способ окисления спиртов карбонатом серебра (I) на целите (реагент Фетизона). Реакция проходит в мягких условиях, не затрагивая двойные связи и, кроме того, с сохранением конфигурации.

Другим мягким окислителем служит специальным образом приготовленный («активный») MnO2. Этот реагент используется в основном для окисления активированной (аллильной или бензильной) гидроксильной группы. Важно отметить, что такой способ подходит для окисления ненасыщенных спиртов без перегруппировки или изомеризации [4, 5].

Для превращения 2,6-ди(гидроксиметил)пиридина в 2,6-диформилпиридин описан способ окисления активированным MnO2. Реакция проводится при десятикратном избытке оксида. Это существенно затрудняет процедуру очистки, что приводит к низким выходам продукта [6].
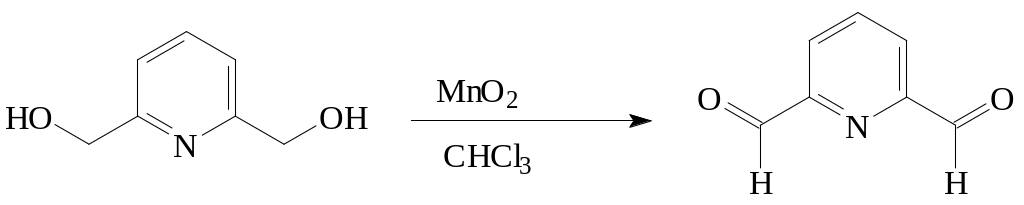
В литературных источниках также описан метод окисления 2,6-ди(гидроксиметил)пиридина и его производных до 2,6-пиридиндикарбальдегида с помощью оксида селена (IV) [7, 8, 9, 10].

