
- •Расчётные задачи химической термодинамики
- •Глава 1.
- •Если использовать средние значения теплоемкости и плотностив заданном температурном интервале, то объемная плотность аккумулированной энергии равна:
- •Задача 1.3.4
- •Задача 1.3.6
- •Задача 1.38
- •1.4 Задачи
- •Глава 2. Тепловые эффекты физико-химических процессов.
- •2.1. Цели изучения
- •2.2. Основные закономерности.
- •Для реакций с участием идеальных газов
- •2.3. Основные задачи
- •Отметим, что рассматриваемая реакция протекает наряду с реакциями
- •Задача 2.3.4.
- •Глава 3.
- •В некоторых случаях можно воспользоваться значениями средних
- •3.3. Основные задачи.
- •Задача 3.3.2
- •Задача 3.3 Определите возможность протекания процесса
- •Решение
- •Задача. 3.3.4
- •Задача 3.3.5
- •Решение
- •Решение
- •Решение уравнения с помощью эвм - секунды, но почти с той же
- •Задача 3.3.8
- •Согласно [1], логарифм константы равновесия реакции образования
- •Исходя из этих соображений, проследим влияние давления на вели-
- •Выразим связь между константой равновесия и равновесным соста-
- •Задача 3.3.13
- •3.4. Многовариантные задачи.
Глава 2. Тепловые эффекты физико-химических процессов.
2.1. Цели изучения
Изучив этот раздел, Вы сможете
отличать экзотермические процессы от эндотермических;
рассчитать тепловой эффект процесса по значениям тепловых эффектов других процессов, которые можно скомбинировать таким образом, чтобы получился данный процесс;
рассчитать тепловой эффект процесса по значениям стандартных теплот образования каждого реагента и продукта;
рассчитать значение энергии связи в молекуле и энергию кристаллической решетки;
рассчитать тепловой эффект даже при отсутствии справочных данных по теплотам образования;
оценить влияние температуры на тепловой эффект реакции;
рассчитать тепловой эффект процесса при различных значениях температур
2.2. Основные закономерности.
2.2.1. Тепловым эффектом называют теплоту, которая выделяется или поглощается в процессе, протекающем термодинамически необратимо при постоянном давлении или объёме, причем температура исходных веществ и продуктов реакции одинакова и единственным видом работы является работа против сил внешнего давления.
2.2.2. Тепловой эффект химической реакции в изохорном процессе равен:
QvrU (2.1)
и в изобарном процессе:
Qp= rH, (2.2),
где rUиrH-изменение внутренней энергии и энтальпии в результате процесса.
Поскольку
Qp-Qv=PrV, (2.3)
где rV –изменение объема в результате реакции, то в случае процессов, протекающих только с участием конденсированных фаз
rV0 и rUrH
Для реакций с участием идеальных газов
rH=rU+nRT, (2.4)
где n- изменение числа молей газообразных веществ.
2.2.3. Физико-химические превращения, которые сопровождаются выделением теплоты в окружающую среду, называют экзотермическими (rH0). Процессы, идущие с поглощением теплоты, называют эндотермическими (rH0). В технологических задачах важная роль отводится составлению тепловых балансов химических реакций и проведению теплотехнических расчетов. Основой таких расчетов служит закон Гесса.
2.2.4. Согласно закону Гесса, если реакция протекает через несколько последовательных стадий, то изменение энтальпии rH такой реакции равно сумме изменений энтальпий каждой стадии rHi
rH=irHi (2.5)
2.2.5. Стандартной энтальпией образования fH0( стандартной теплотой образования) соединения называют изменение энтальпии в процессе образования моля этого соединения из простых веществ, причем и реагенты и продукты находятся в стандартном состоянии.
Стандартные теплоты образования при температуре 298К fH0(298) табулированы 1 .
Знание теплот образования нескольких сотен веществ позволяет рассчитывать тепловые эффекты тысяч реакций, поскольку согласно Гессу
rH0i(ifH0i)продi(jfH0j)исх, (2.6)
где i ,j- стехиометрические коэффициенты.
2.2.6. Влияние температуры на тепловой эффект реакции описывается законом Кирхгофа.
В дифференциальной форме
drH/dT=rCp 2.7
и drU/dT=rCv ,
где rCp и rCvизменение теплоёмкости в ходе изобарного и изохорного процессов:
rCpT= a +bT+cT2c T2 (2.9).
Из (2.7) и (2.8) следует, что влияние температуры определяется законом rCp и rCv:

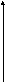 rH0
rCp
rH0
rH0
rCp
rH0
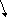 rCp
rCp
rCp
rCp
rCp
rCp
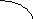





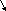


T T
В интегральной форме зависимость теплового эффекта реакции от температуры в области температур 298 – T, в которой нет ни модификационных ни фазовых превращений, выражается соотношением
rH0T=rH0298+T298rCpdT, (2.10)
где rH0298стандартное изменение энтальпии реакции при 298K.
Если в рассматриваемом интервале температур происходятфазовые и/или модификационные превращения, то при расчете необходимо учесть теплоты соответствующих превращений, а так же изменение температурной зависимости теплоемкости веществ, претерпевших такие превращения: rH0T=rH0298+T298rCp(298,Tф.п.)dT+rH0ф.п.+TTф.п.rCp (Tф.п,T) dT (2.11) где Tф.п.- температура фазового превращения, rCp(298,Tф.п.) и rCp (Tф.п,T) – изменение теплоёмкости в ходе реакции в температурном интервале от 298К до температуры фазового превращения и от Tф.п. до заданной температуры Т, H0ф.п– изменение энтальпии при фазовом превращении.
Следует учесть, что в (2.10) H0ф.п вычисляют в случае фазового превращения исходного вещества и прибавляют при фазовом превращении продукта реакции.
Интегрирование (2.10) с учетом (2.9) приводит к
rH0T=nH0T1+aT- T1+b/2T2- T12+c/3T3- T13+c1/T1+1/T (2.12)
Выражение (2.12) можно привести к виду
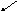

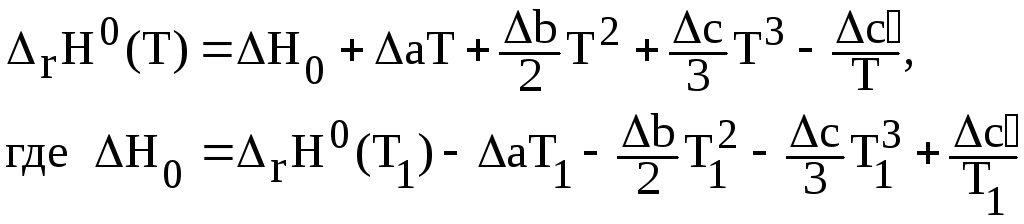 (2.13)
(2.13)
Следует иметь в виду, что если температурная зависимость теплоемкости каждого i-го участника реакции адекватно описывается уравнением вида Cp=a+bT+cT2+c/T2 в некотором интервале температур {T1, T2}i [1], то соотношения (2.10 – 2.12) справедливы в температурном интервале, являющимся пересечением указанных интервалов.
2.2.7. Достаточно удобен и прост метод расчета тепловых эффектов реакций (в независимости от того, сопровождаются ли они в исследуемом интервале температур модификационными или фазовыми превращениями) на основании таблиц функций (Н0(Т) – Н0(298)), конечно, если такие данные имеются [1]:
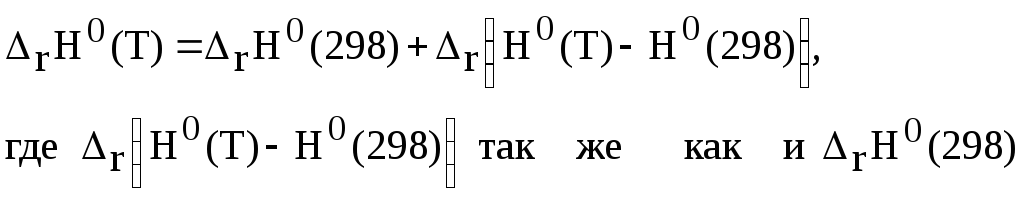 (2.14)
(2.14)
вычисляются по закону Гесса:
![]()
2.2.8. Расчет теплот образования газообразных соединений по энергиям связей в соответствии с законом Гесса может быть осуществлен по соотношению:
![]() (2.15)
(2.15)
где
![]() ,
,
![]() - число связей
данного вида,
- число связей
данного вида,![]() ,
,
![]() - соответствующие
им энергии разрыва связей,
- соответствующие
им энергии разрыва связей, ![]() -
число атомов твердого элемента и теплота
сублимации (возгонки) твердого элемента.
-
число атомов твердого элемента и теплота
сублимации (возгонки) твердого элемента.
Используя
(2.15) может быть рассчитан и тепловой
эффект реакции ![]() ,
разумеется если имеются [1] необходимые
для этого данные по энергиям связи.
,
разумеется если имеются [1] необходимые
для этого данные по энергиям связи.
