
- •Расчётные задачи химической термодинамики
- •Глава 1.
- •Если использовать средние значения теплоемкости и плотностив заданном температурном интервале, то объемная плотность аккумулированной энергии равна:
- •Задача 1.3.4
- •Задача 1.3.6
- •Задача 1.38
- •1.4 Задачи
- •Глава 2. Тепловые эффекты физико-химических процессов.
- •2.1. Цели изучения
- •2.2. Основные закономерности.
- •Для реакций с участием идеальных газов
- •2.3. Основные задачи
- •Отметим, что рассматриваемая реакция протекает наряду с реакциями
- •Задача 2.3.4.
- •Глава 3.
- •В некоторых случаях можно воспользоваться значениями средних
- •3.3. Основные задачи.
- •Задача 3.3.2
- •Задача 3.3 Определите возможность протекания процесса
- •Решение
- •Задача. 3.3.4
- •Задача 3.3.5
- •Решение
- •Решение
- •Решение уравнения с помощью эвм - секунды, но почти с той же
- •Задача 3.3.8
- •Согласно [1], логарифм константы равновесия реакции образования
- •Исходя из этих соображений, проследим влияние давления на вели-
- •Выразим связь между константой равновесия и равновесным соста-
- •Задача 3.3.13
- •3.4. Многовариантные задачи.
Если использовать средние значения теплоемкости и плотностив заданном температурном интервале, то объемная плотность аккумулированной энергии равна:
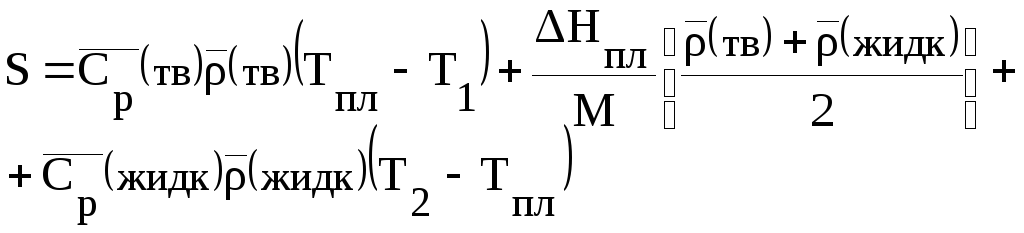 (1.12)
(1.12)
Отметим, что к общим требованиям для теплоаккумулирующих материалов (в добавлении к очевидным – высокой теплоемкости Ср и высокой теплоты плавления Нпл) относят термическую и химическую стабильность, некоррозионность по отношению к конструкционным материалам, высокую теплопроводность, и, разумеется, доступность и соответствующую цену.
Основные задачи.
Задача
1.3.1. В таблице
представлены значения ![]() (кДж/моль)
для двух веществ – NaOH
и Na2CO3
(кДж/моль)
для двух веществ – NaOH
и Na2CO3
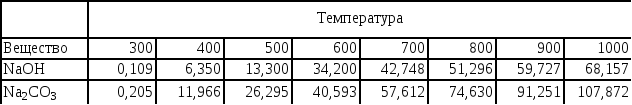
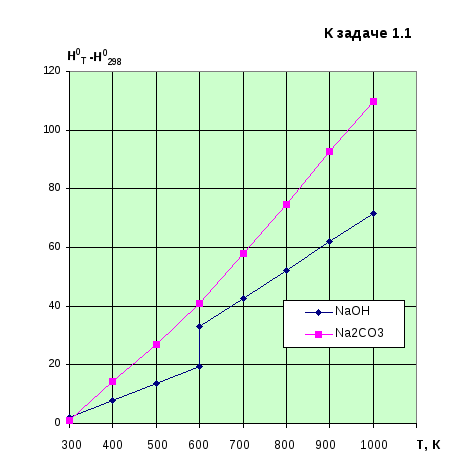
Можно ли по этим данным определить, имеются ли в заданном интервале температур фазовые переходы?
Решение.
Резкий
скачок в изменении значений ![]() для NaOH
в интервале температур 500 – 600К дает
основание утверждать о наличии в этом
интервале фазового перехода. Действительно,
согласно справочным данным [1] при 596К
происходит плавление NaOH,
т.е. процесс
для NaOH
в интервале температур 500 – 600К дает
основание утверждать о наличии в этом
интервале фазового перехода. Действительно,
согласно справочным данным [1] при 596К
происходит плавление NaOH,
т.е. процесс
-
NaOH(тв)![]() NaOH(жидк)
NaOH(жидк)
с теплотой плавления Н0плавл=8,36 кДж/моль.
Монотонный
ход зависимости
![]() дляNa2CO3
не дает оснований для подобных утверждений.
Согласно [1] плавление Na2CO3
происходит при 1127К. Приведенный рисунок
иллюстрирует эти утверждения.
дляNa2CO3
не дает оснований для подобных утверждений.
Согласно [1] плавление Na2CO3
происходит при 1127К. Приведенный рисунок
иллюстрирует эти утверждения.
Задача
1.3.2. По данным
таблицы определите средние значения ![]() дляNaOH
через 50К в интервале 298 – 1000К.
дляNaOH
через 50К в интервале 298 – 1000К.
Решение.
Согласно (1.8) среднее значение теплоемкости
![]()
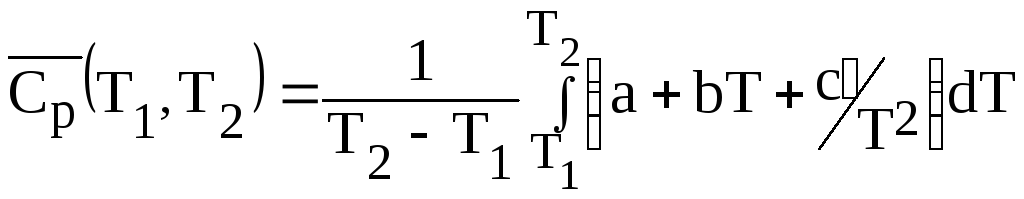
и после интегрирования:
![]()
После упрощений получим:
![]()
Рассчитаем
вначале ![]() в интервале температур 298 – 566, т.е. для
NaOH(тв)
до температуры
в интервале температур 298 – 566, т.е. для
NaOH(тв)
до температуры
![]()
перехода Т=566К:
перехода Т=566К:
![]()
Рассчитанные значения Cp (298,T) представим в виде таблицы:
|
Вещество |
Температура, К | |||||||
|
NaOHтв- |
350 |
400 |
450 |
500 |
550 |
566 |
300 |
595 |
|
Cp,Дж/мольК |
60,66 |
62,18 |
64,07 |
66,19 |
68,50 |
69,27 |
59,68 |
70,60 |
К сожалению, данные о коэффициентах уравнения Ср=F(T) дляNaOH-отсутствуют. Поэтому рассчитаем значенияCp для жидкогоNaOHв интервале температур Тпл= 595 – 100К:
Cp (595,T) = 89,58 – 2,93 х10-3(595+Т)
Результаты расчета:
|
Вещество |
Температура, К | ||||||||
|
NaOH(жидк) |
600 |
650 |
700 |
750 |
800 |
850 |
900 |
950 |
1000 |
|
Cp(595,Т),Дж/мольК |
86,08 |
85,93 |
85,79 |
85,64 |
85,49 |
85,35 |
85,20 |
85,05 |
84,91 |
Задача 1.3.3.
Используя
средние значения Cp
дляNaOHрассчитайте![]() в интервале температур 298 – 1000 К.
в интервале температур 298 – 1000 К.
Решение.
Согласно (1.4) при отсутствии фазовых переходов
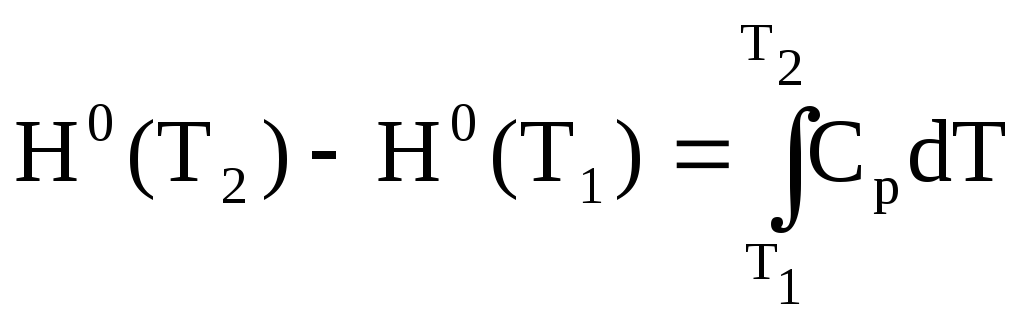
Поскольку в интервале
![]()
![]()
![]()
Подставив значения Т, получим:
|
Вещество |
Температура, К | |||||||
|
NaOН(тв) |
300 |
350 |
400 |
450 |
500 |
550 |
566 |
595 |
|
Hoт–Но298,кДж/моль |
0,12 |
3,15 |
6,34 |
9,73 |
13,37 |
17,26 |
18,56 |
20,97 |
Значение
![]() рассчитано при значении, чтоCp
-NaOH(тв) и-NaOH(тв) отличаются
незначительно.
рассчитано при значении, чтоCp
-NaOH(тв) и-NaOH(тв) отличаются
незначительно.
Аналогично
рассчитывают
![]() :
:
|
Вещество |
Температура, К | |||||||
|
NaOН(жидк) |
600 |
650 |
700 |
750 |
800 |
850 |
900 |
1000 |
|
Hoт–Но595,кДж/моль |
0,43 |
4,77 |
9,00 |
13,27 |
17,52 |
21,76 |
25,98 |
34,39 |
Задача 1.3.4
Рассчитайте
изменение энтальпии
![]() дляNaOHв интервале
температур 298 – 1000, используя истинные
значения теплоемкостей. Сравните
полученные результаты с результатами
расчета по средним теплоемкостям.
дляNaOHв интервале
температур 298 – 1000, используя истинные
значения теплоемкостей. Сравните
полученные результаты с результатами
расчета по средним теплоемкостям.
Решение.
Расчет будем вести по формуле (1.5)
![]()
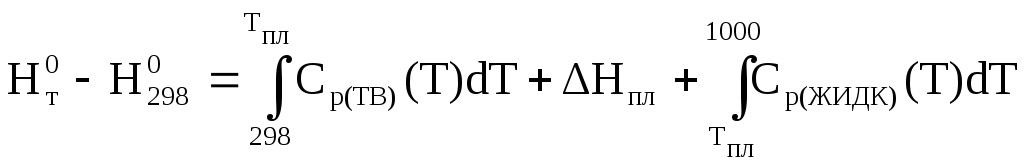
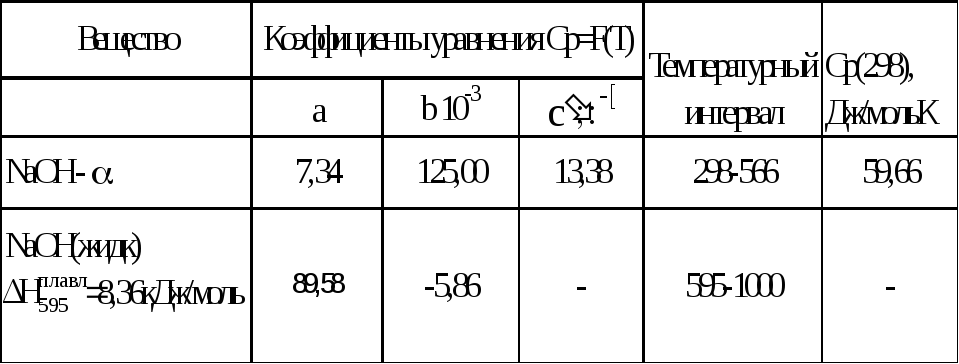
В соответствии с данными справочника [1]:
Ср(тв)= 7,34 + 125 х 10-3Т + 13,38 х 105/Т2,Дж/моль К
![]() = 6,36 кДж/моль
= 6,36 кДж/моль
Ср(жидк)= 89,58 – 5,86 х 10-3Т,Дж/моль К,
Тогда:
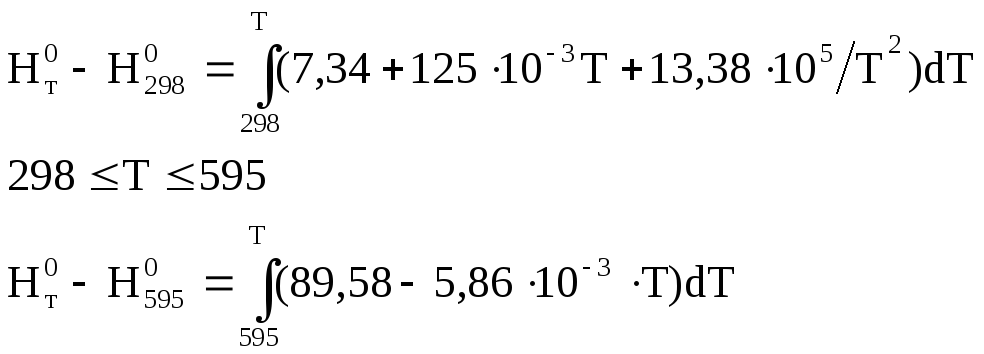
![]()
и после интегрирования:
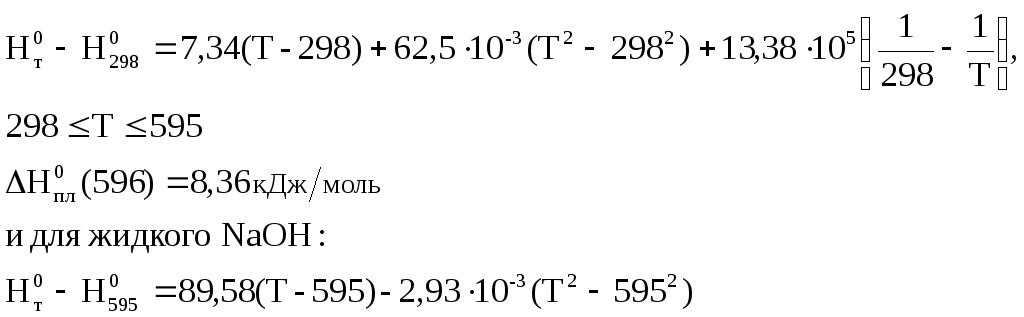
Результаты расчета представим в таблицах:
|
Вещество |
Температура, К | |||||||
|
Na OH(тв) |
300 |
350 |
400 |
450 |
500 |
550 |
566 |
595 |
|
|
0,12 |
3,15 |
6,34 |
9,74 |
13,37 |
17,26 |
18,56 |
21,00 |
|
Na OH(жидк) |
600 |
650 |
700 |
750 |
800 |
850 |
900 |
1000 |
|
|
0,43 |
4,73 |
9,00 |
13,27 |
17,52 |
21,76 |
25,98 |
34,38 |
Сравнение результатов расчета по средним значениям Cp (Т1, Т2) и истинным значением теплоемкости показывает, что результаты практически не различаются. Поэтому при наличии данных о средних теплоемкостях расчеты можно проводить по этим данным.
Рассчитаем
теперь
![]() :
:
![]()
![]() +
Нпл+(Нт– 595)
+
Нпл+(Нт– 595)
и результаты сведем в таблицу
|
Вещество |
Температура, К |
| ||||||||
|
NaOH |
300 |
400 |
500 |
595 |
600 |
700 |
800 |
900 |
1000 | |
|
|
0,12 |
6,34 |
13,37 |
21,0 |
29,79 |
38,36 |
46,88 |
55,34 |
63,74 | |
Задача 1.3.5
Найдите
уравнение зависимости и постройте
график
![]() F(T)
дляNa2Si2O5.
F(T)
дляNa2Si2O5.
Рассчитайте,
используя полученные уравнения значения
![]() для 298Т2000.
для 298Т2000.
Решение.
Необходимые справочные данные найдем в [1]
|
Вещество |
Коэффициенты уравнения Ср =F(T),Дж/моль К |
Температурный интервал, К | ||
|
a |
b x 103 |
c x 10-5 | ||
|
- Na2Si2O5 (тв) |
185,69 |
70,54 |
-44,64 |
298-951 |
|
- Na2Si2O5 (тв)
|
292,88 |
— |
— |
951-1147 |
|
Na2Si2O5 (жидк)
|
261,21 |
— |
— |
1147 - 2000 |
Проанализировав справочные данные, приходим к выводу, что уравнение, выражающее зависимость энтальпии от температуры в интервале 298 – 2000 К имеет вид:
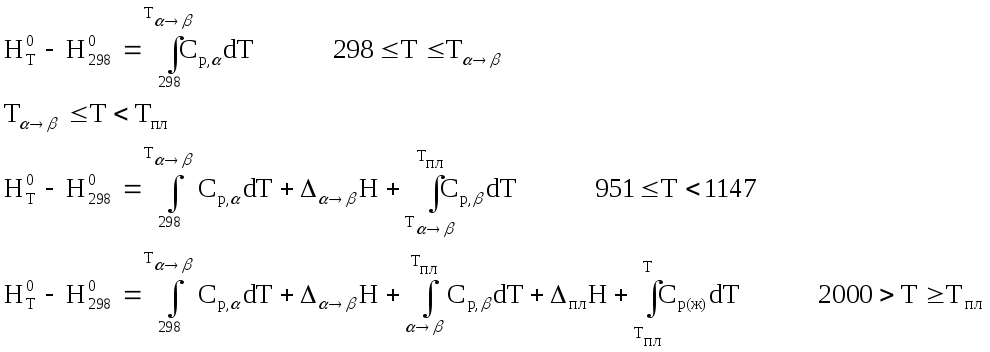
После подстановки значений параметров уравнений и интегрирования получим:
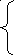

График
зависимости
![]() F(T)
представлен на рис.
F(T)
представлен на рис.

Рис.
Значения
![]() ,
рассчитанные по полученным уравнениям,
представим в виде таблицы.
,
рассчитанные по полученным уравнениям,
представим в виде таблицы.
|
Значения
| ||||||||||||
|
300 |
400 |
500 |
600 |
700 |
800 |
900 |
1000 |
1100 |
1200 |
1400 |
1600 |
1800 |
|
0,31 |
17,63 |
37,14 |
58,1 |
80,4 |
103,5 |
127,5 |
154,6 |
183,9 |
246,8 |
299,0 |
351,2 |
403,4 |
