
- •Расчётные задачи химической термодинамики
- •Глава 1.
- •Если использовать средние значения теплоемкости и плотностив заданном температурном интервале, то объемная плотность аккумулированной энергии равна:
- •Задача 1.3.4
- •Задача 1.3.6
- •Задача 1.38
- •1.4 Задачи
- •Глава 2. Тепловые эффекты физико-химических процессов.
- •2.1. Цели изучения
- •2.2. Основные закономерности.
- •Для реакций с участием идеальных газов
- •2.3. Основные задачи
- •Отметим, что рассматриваемая реакция протекает наряду с реакциями
- •Задача 2.3.4.
- •Глава 3.
- •В некоторых случаях можно воспользоваться значениями средних
- •3.3. Основные задачи.
- •Задача 3.3.2
- •Задача 3.3 Определите возможность протекания процесса
- •Решение
- •Задача. 3.3.4
- •Задача 3.3.5
- •Решение
- •Решение
- •Решение уравнения с помощью эвм - секунды, но почти с той же
- •Задача 3.3.8
- •Согласно [1], логарифм константы равновесия реакции образования
- •Исходя из этих соображений, проследим влияние давления на вели-
- •Выразим связь между константой равновесия и равновесным соста-
- •Задача 3.3.13
- •3.4. Многовариантные задачи.
Задача 3.3.13
Проследите влияние температуры на степень превращения
оксида углерода при стехиометрическом соотношении
CO:H2O(газ) в реакции конверсии оксида углерода водяным
паром:
CO + H2 O (газ) CO2 +H2
Рассчитайте состав газовой смеси при равновесии в зависимости
от температуры.
Решение.
CO + H2O (газ)CO2 + H2
Исходный 1 1 0 0
Состав, моль
Равновесный 1- 1- ,
Состав
где - химическая переменная (3,43)
Тогда константа равновесия Кa в соответствии с(3,46),поскольку
=0 :
![]()
откуда
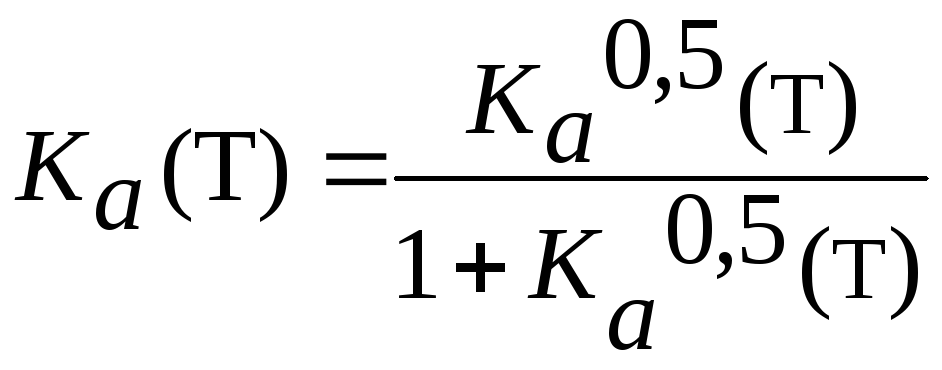
Учтя (3,47),получим значение степени превращения CO
со = (т.к. n0 (co) =1)
После подстановки значений Ка (т) при различных температурах получим
|
Т |
298 |
500 |
600 |
700 |
800 |
900 |
1000 |
|
Кa |
10482,0 |
137,00 |
28,20 |
9,39 |
4,22 |
2,29 |
0,70 |
|
ХСО |
0,99 |
0,92 |
0,84 |
0,75 |
0,67 |
0,60 |
0,45 |
При низких температурах степень превращения очень велика (что подтверждает выводы предыдущей задачи), однако скорость процесса при таких температурах незначительна.Низкотемпературный цинкхроммедный катализатор,используемый в промышленности, обеспечивает необходимую скорость процесса при температуре 350°-400°(600-700К).При этих температурах степень превращения ХСО остается
достаточно высокой.Проследите влияние соотношения пар: газ(H2O:CO) на степень превращения оксида углерода в реакции конверсии оксида у углерода водяным паром при Т=800К.
Решение:
Состав,моль. СО+H2O(газ)→CO2+H2
Исходный 1 n 0 0
Равновесный 1- n-
![]()
где - химическая переменная (3,34)
Тогда константу равновесия Кa можно представить (3,46) как:
![]()
![]()
И при Т=800К (значения Кa(т) рассчитаны в задаче 3.3.13):
Для исследуемой реакции- степень превращения СО= (3,47),
поскольку no(Co)=1
Равновесный состав (в мольных долях NC) может быть
выражен следующими соотношениями:
![]() ;
;![]() ;
;![]()
Рассчитаем ХСО и Ni при значениях n=1;2;3;4.
|
Соотношение Пар: газ =n :1 |
Степень превращения χCO |
Равновесный состав | |||
|
NCO |
|
|
| ||
|
1 |
0,67 |
0,165 |
0,165 |
0,335 |
0,335 |
|
2 |
0,85 |
0,05 |
0,38 |
0,28 |
0,28 |
|
3 |
0,90 |
0,025 |
0,525 |
0,225 |
0,225 |
|
4 |
0,93 |
0,014 |
0,614 |
0,186 |
0,186 |
Результаты показывают ,что при увеличении соотношения пар:газ до 4:1 степень превращения χco увеличивается от 0,67 до 0,93.
Этими соображениями руководствуются при проведении исследуемого процесса в промышленности :соотношение пар:газ обычно поддерживается как 4:1 .Результаты показывают так же , что соотношение между исходными веществами влияет на равновесный выход продуктов : максимальный выход получают при стехиометрическом соотношении исходных веществ . Таким образом ,для максимального выхода продуктов реакции необходим стехиометрический состав исходных веществ ,а для достижения
Максимальной степени превращения – избыток.
Задача 3.3.15.
В водородном генераторе при температуре 800 К и давлении Р=1атм. Протекает реакция CO+H2O(газ) CO2+H2
Считая , что в генераторе достигаются равновесные концентрации
, определите возможность образования сажи (углерода) при этих условиях.
Решение.
Образование углерода возможно ,если при данных условиях возможен самопроизвольный процесс:
2CO CO2+C (тв)
критерием самопроизвольного протекания процесса в соответствии
с(3.39) и (3.40) является условие
ΔrG(T)< 0,
потеря соблюдается,если
Пi PνiAi<Ka(T) (3.40)
Для рассматриваемой реакции это условие конкретизуется
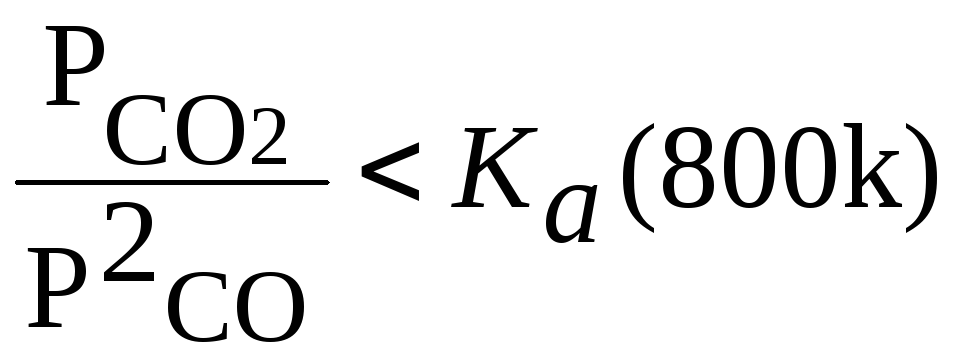
Равновесные парциальные давления PCO2=NCO2 P и PCO=NCO P при 800К и различном соотношении пар:газ возьмем из предыдущей задачи.
Константу активности Ка при 800К (отметим попутно, что в
данном случае Ka= Kp, поскольку общее давление в системе
Р=1атм.) рассчитаем через Константы активности образования
Кf[1] исходных веществ и продуктов реакции():
2CO→Co2.+ С (тв)
lg
Kf(800K)
(11,86 25,80 0)
![]() =lg
Ka(800)=2,08;
=lg
Ka(800)=2,08;
Ka
(800)=120,2 тогда при соотношениях пар: газ![]() :
nCO
:
nCO
(a):
1:1;
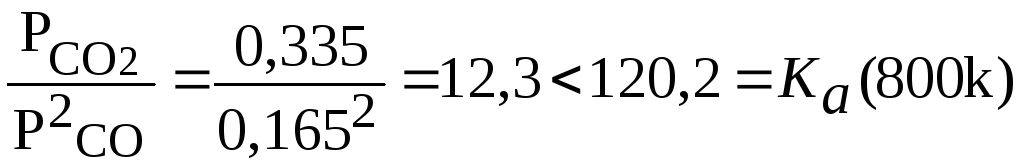
2:1;
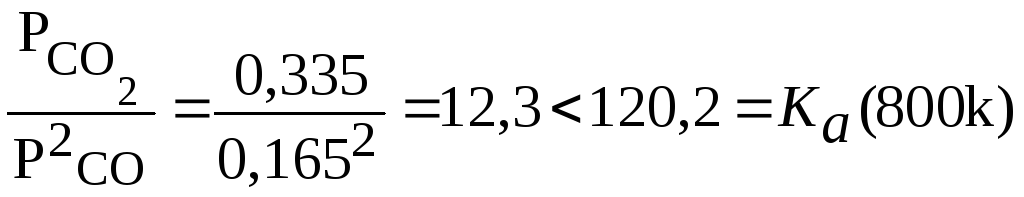
3:1;
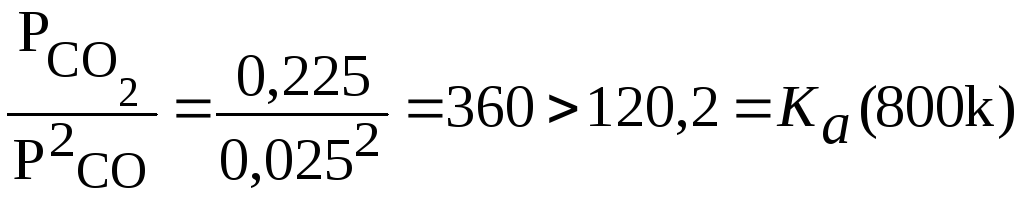
4:1;
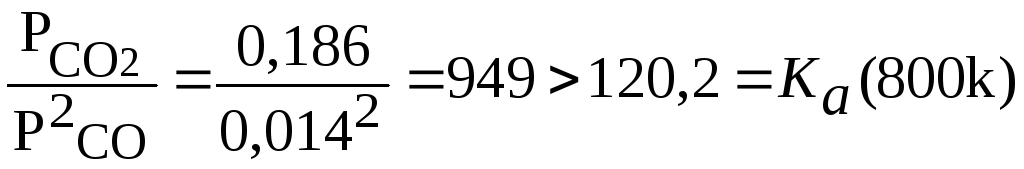
Следовательно, при соотношение-пар: газ как 3:1 и 4:1 при 800К выпадение сажи не возможно.
Задача 3.3.16
В водородном генераторе при 800К и общем давлением Р=1атм протекают процессы
CO+H2O (газ)→ СО2 + H2 (1)
2CO→ CO2 + C (тв) (2)
Решение определите состав системы при равновесия.Рассматриваемая, задача достаточна, типична: в химических системах могут протекать сложные процессы,включающие множество взаимодействий с одним или несколькими исходными или промежуточными веществами.Принцип расчета равновесий в сложных системах заключается в следующем;(a)-зная начальный состав выражают равновесный состав с учетом всех возможных в системе превращений (каждая реакция характеризуется своей химической переменной ξ ). Для процесса , состоящего из нескольких реакций , активности(или концентрации) реагирующих веществ должны одновременно удовлетворять всем равновесиям.
CO+ H2O(газ) CO2 + H2 (1)
Исходный 1 1 0 0
Состав,моль
Равновесный 1-ξ1-2ξ2 1-ξ1 ξ1+ξ2 ξ2
Состав,моль
2CO CO2 +C (тв) (2)
исходный
состав, моль 1 0
равновесный 1-ξ1-2ξ2 ξ1+ξ2
состав , моль
(б)- записывают выражение, связывающие константы равновесия Кa с составом (3.42) для каждой реакции. Число таких уравнений
равно числу рассматриваемых реакций. Тогда для реакции (1) и (2)
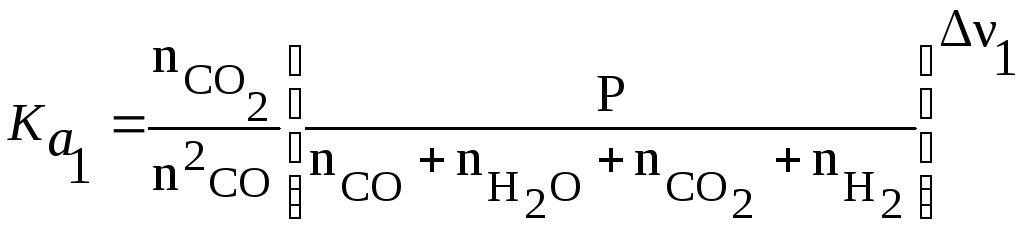
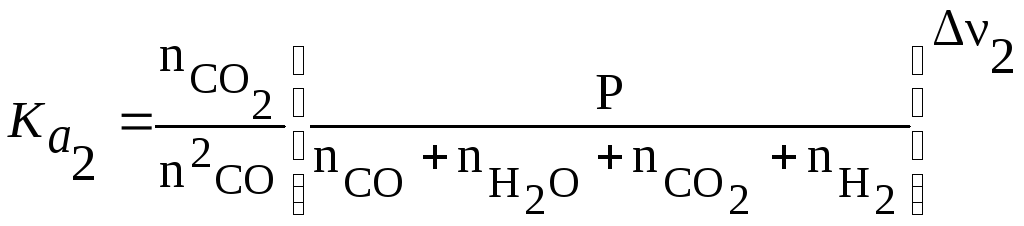
Учтя ,что ν1=0, ν 2=-1 и Р=1атм,после подстановки значений
![]() и
и![]() :
:
![]()
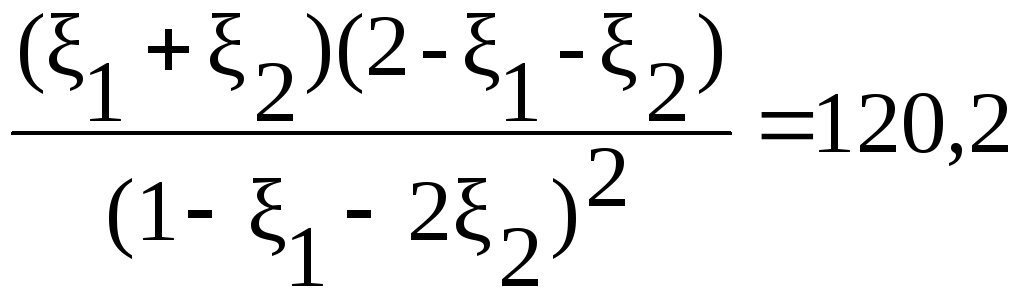
(в)- решение системы S нелинейных уравнений, где S-число
рассматриваемых реакций. Решение системы нелинейных уравнений представляет довольно не простую задачу, однако, применение современных программных средств, например, Match-Cad, позволяет решать такие задачи. Более того, такие задачи могут быть решены с использованием программируемые микрокалькулятором [7].Однако ведь может так случиться, что ни ПЭВМ, ни ПМК нет под рукой (вообще-то они, конечно, есть; ведь у нас у каждого студента, ассистента, доцента и т.д. все это есть, но просто нет
под рукой!)
Тогда можно использовать простой и наглядный метод, который
называют методом релаксации или методом последовательно
соединенных реакторов.
Отступление третье, в котором рассказывается о методе релаксация, или методе последовательно соединенных растворов.
Рассматриваемую совокупность реакций представляют в виде
Системы последовательно соединенных растворов, число которых
равно числу независимых стехиометрических уравнений.
Каждый раствор Ri; действует как периодический, в котором
достигается равновесия в I-ой реакции, т.е. в реакции, номер
Которой соответствует номеру раствора.
Процесс начинают с загрузки(конечно, мысленно !) в исходный реактор R1.Полученные продукты перегружают во второй реактор R2, в котором достигает равновесия второй реакции.
Затем продукты перегружают в третий реактор R3 и так далее.
В каждый реактор поступает равновесная смесь продуктов из предыдущего ректора и в каждом реакторе Ri протекает только одна i-ая реакция.
Первый проход заканчивается после того, как смесь прошла реактор, номер которого соответствует номеру реакции n.
После последнего реактора Rn полученную реакционную смесь загружают в первый реактор и цикл повторяется до тех пор, пока степень протекания каждой реакции не станет меньше НЕКОТОРОЙ наперед заданной величины.
С



 казанное
поясняет рисунок.
казанное
поясняет рисунок.


















R1 R2 Rn



















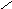




Рис. Рецикл равновесного потока
Из сказанного следует, что метод последовательно соединенных реакторов позволяет вместо системы из n нелинейных уравнений решать nk нелинейных уравнений с одной неизвестной (k-число “проходов”, или рециклов)
В каждом новом “проходе” системы реакторов степень превращения постепенно снижается, достигая некоторую наперед заданную величину.
Число “проходов” заранее предсказать трудно.
Теперь вернемся к задаче 3.3.16, которую будем решать, используя метод последовательно соединенных реакторов. Число “проходов” j ограничим значением ξ=0,003.
Пусть исходный состав смеси на входе в i-ый реактор
ξ
nco,
![]() .
.
Тогда равновесный состав для реакции
 CO
+ H2O
CO
+ H2
(1)
CO
+ H2O
CO
+ H2
(1)
Равновесный nCO-xij nH2O -xij nCO2+xij nH2+xij
состав, моль
где xij – химическая переменная в i-ом реакторе после j-го “прохода” Rij, i=1;2
И константа равновесия Ka связана с равновесным составом:
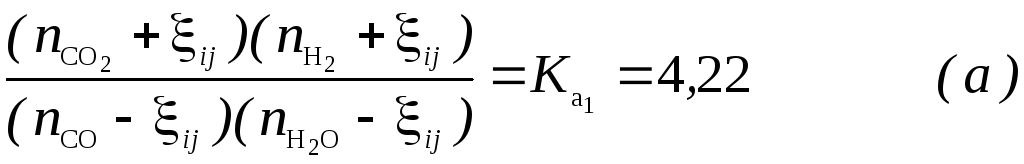
Для реакции
![]() (2)
(2)
равновесный
![]()
![]()
состав, моль
![]()
![]()
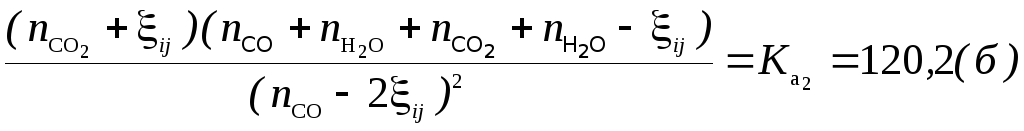
Последовательность, этапы и результаты расчета показаны на схеме, в которой Rij и ξij соответственно i-ый реактор Ri и значение химической переменной в i-ом реакторе после j-го «прохода». (i=1; 2 число реакторов, равное числу рассматриваемых реакций).
Каждое уравнение (а) и (б) решали с использованием приближенных методов(см. отступление второе)
Вход R11
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
1 |
1 |
0 |
0 |
|
N |
0,5 |
0,5 |
0 |
0 |
|
ån=2 | ||||
R11
 выход
R11
входR21
выход
R11
входR21
|
C |
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,328 |
0,328 |
0,672 |
0,672 |
|
N |
0,164 |
0,164 |
0,336 |
0,336 |
|
ån=2 | ||||
ξ11=0,672
R21
|
2 |
 выход R21
вход R12
выход R21
вход R12|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,108 |
0,328 |
0,782 |
0,672 |
|
N |
0,057 |
0,174 |
0,414 |
0,355 |
|
ån=1,89 | ||||

ξ21=0,11
 выходR12
входR22
выходR12
входR22
R12
|
|
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,218 |
0,438 |
0,672 |
0,562 |
|
N |
0,115 |
0,232 |
0,355 |
0,297 |
|
ån=1,89 | ||||
ξ12=-0,11
 R22
выходR22
входR13
R22
выходR22
входR13
|
2 |
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,106 |
0,438 |
0,728 |
0,562 |
|
N |
0,057 |
0,239 |
0,397 |
0,306 |
|
ån=1,834 | ||||
ξ22=0,056
 выходR13
входR23
выходR13
входR23
R13
|
2 |
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,163 |
0,495 |
0,671 |
0,505 |
|
N |
0,089 |
0,270 |
0,366 |
0,275 |
|
ån=1,834 | ||||

ξ13=-0,057
 выходR23
входR14
выходR23
входR14
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,099 |
0,495 |
0,703 |
0,505 |
|
N |
0,055 |
0,275 |
0,390 |
0,280 |
|
ån=1,802 | ||||
|
C |
ξ23=0,032
 R14
выходR14
входR24
R14
выходR14
входR24
|
C |
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,139 |
0,535 |
0,663 |
0,465 |
|
N |
0,077 |
0,297 |
0,368 |
0,258 |
|
ån=1,802 | ||||
 ξ14=-0,04
ξ14=-0,04
 выходR24
входR15
выходR24
входR15
|
2CO CO2+C(тв) |
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,101 |
0,535 |
0,682 |
0,465 |
|
N |
0,056 |
0,300 |
0,382 |
0,261 |
|
ån=1,783 | ||||
ξ24=0,0195
 выходR15
входR25
выходR15
входR25
R15
|
C |
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,121 |
0,555 |
0,662 |
0,445 |
|
N |
0,068 |
0,311 |
0,371 |
0,250 |
|
ån=1,783 | ||||
ξ15=-0,02
 входR25
выходR16
входR25
выходR16
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,099 |
0,555 |
0,672 |
0,445 |
|
N |
0,056 |
0,313 |
0,379 |
0,251 |
|
ån=1,772 | ||||
R25
|
2 |
ξ25=0,011
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,114 |
0,570 |
0,659 |
0,432 |
|
N |
0,064 |
0,321 |
0,371 |
0,243 |
|
ån=1,775 | ||||
выходR16
входR26

R16
|
C |
ξ16=-0,015
 выходR26
входR17
выходR26
входR17
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,098 |
0,570 |
0,667 |
0,432 |
|
N |
0,055 |
0,332 |
0,377 |
0,244 |
|
ån=1,767 | ||||
|
2 |
ξ26=0,0075
R17
|
|
 выходR17
входR27
выходR17
входR27|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,110 |
0,582 |
0,655 |
0,420 |
|
N |
0,062 |
0,329 |
0,370 |
0,237 |
|
ån=1,767 | ||||
ξ17=-0,012
|
2CO CO2+C (тв) |
 R27
выходR27
входR18
R27
выходR27
входR18|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,099 |
0,582 |
0,661 |
0,420 |
|
N |
0,056 |
0,330 |
0,375 |
0,238 |
|
ån=1,761 | ||||
ξ27=0,0057
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,107 |
0,590 |
0,653 |
0,412 |
|
N |
0,061 |
0,335 |
0,371 |
0,234 |
|
ån=1,762 | ||||
|
C |
 выходR18
входR28
выходR18
входR28
ξ18=-0,008
 выходR28
входR19
выходR28
входR19
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,098 |
0,590 |
0,657 |
0,412 |
|
N |
0,056 |
0,336 |
0,374 |
0,234 |
|
ån=1,757 | ||||
|
2 |
ξ28=0,0045
|
C |
 выходR28
входR19
выходR28
входR19|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,104 |
0,596 |
0,651 |
0,406 |
|
N |
0,059 |
0,339 |
0,370 |
0,231 |
|
ån=1,757 | ||||
ξ29=-0,006
выход R29
|
|
CO |
H2O |
CO2 |
Н2 |
|---|---|---|---|---|
|
n |
0,098 |
0,596 |
0,654 |
0,406 |
|
N |
0,056 |
0,340 |
0,373 |
0,231 |
|
ån=1,754 | ||||
|
2 |
ξ29=0,003
Задача 3.3.17
Определите состав равновесной смеси при протекании в газовой фазе процесса при T=600K и общем давлении P=1атм
![]()
![]() (1)
(1)
![]()
![]() (2)
(2)
Исходный
состав соответствует стехиометрии
![]() .
Продукты реакции в исходной смеси
отсутствуют.
.
Продукты реакции в исходной смеси
отсутствуют.
Решение.
Поскольку
обе реакции идут без изменения числа
молей, то
![]() .
.
Поскольку общее давление в системе P=1атм, то систему можно рассматривать как идеальную, а значит Kγ=1 и Ka(Т) = Kр(Т).
Тогда можно записать:
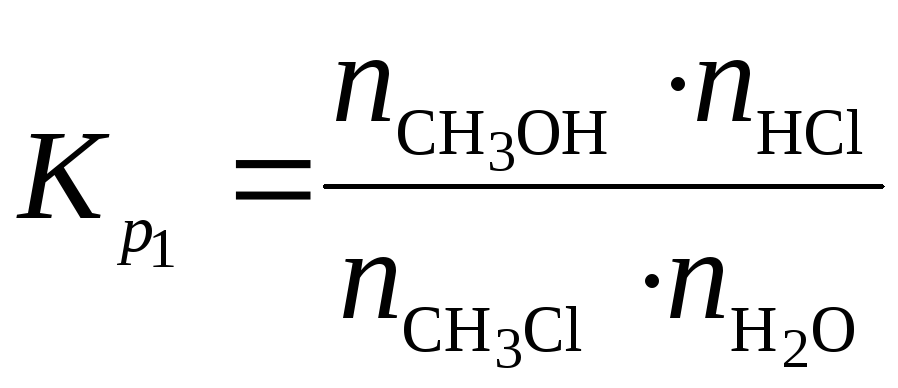 (а)
(а)
и
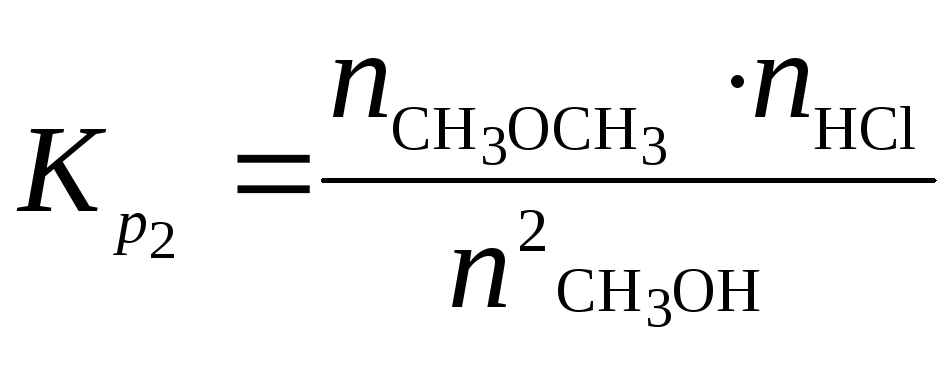 (б)
(б)
При решении такого типа задач возможны два подхода.
Подход первый, основанный на совместном решении системы уравнений (а) и (б).
Введем обозначения: x-количество HCl, моль в равновесной смеси(в соответствии со стехиометрией реакции, такое же количество CH3Cl и H2O прореагировало и CH3OH образовалось по первой реакции); y- количество CH3OCH3,моль,в равновесной смеси (в соответствии со стехиометрией такое же количество H2O образовалось и в два раза большее количество CH3OH прореагировало по второй реакции).
Тогда
при равновесии(активности или концентрации
реагентов в момент равновесия должны
удовлетворять всем уравнениям, связывающим
Kp
c
составом для любой реакции!) количество
каждого вещества, моль:
![]() С учетом этих
обозначений (а) (б) можно записать :
С учетом этих
обозначений (а) (б) можно записать :
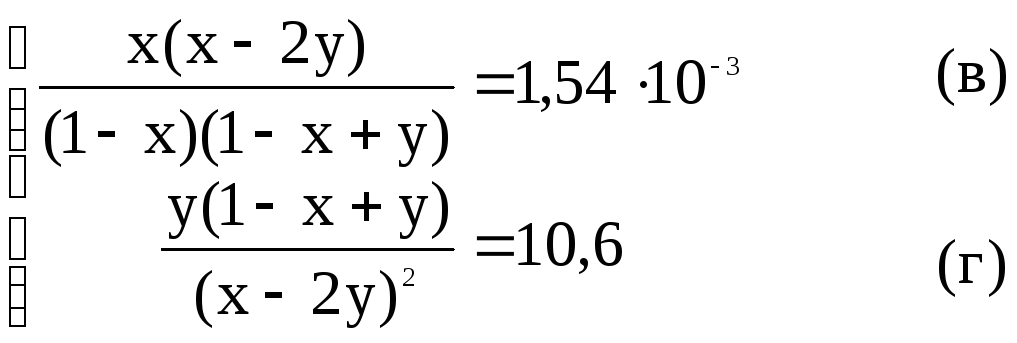
Задача сводится к решению системы двух нелинейных уравнений с двумя неизвестными.
Такая система может быть решена, например, с помощью программы, реализующей, итерационный метод с модификацией Зейделя.Напомним, что для сходимости метода решения необходимо условие: суммы модулей частных производных каждой функции по всем переменным не должны превышать единицу.
Выполняя это требование, преобразуем (в) и (г). Соответственно получим:
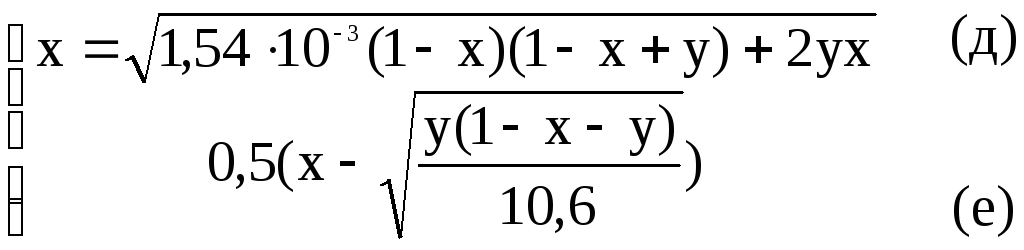
Программная
реализация метода может быть осуществлена
или с помощью ПЭВМ или с помощью ПМК
[7].
В [7]
приведены соответствующие программы
расчета и его результаты:
![]() .
.
Таким образом, состав равновесной смеси, моль:
|
CH3Cl |
H2O |
CH3OH |
CH3OCH3 |
HCl |
|
0,9518 |
0,9613 |
0,029 |
0,0094 |
0,0481 |
Подход второй, основанный на методе последовательно соединенных реакторов (см. отступление третье.)
Этот метод позволяет вместо системы нелинейных уравнений (в рассматриваемом случае системы двух уравнений (а) и (б)) решать последовательно нелинейные уравнения (а) и (б) с одной неизвестной. В этом случае процесс последовательных решений производят до тех пор, пока степень превращения( или химическая переменная) не станет меньше некоторой наперед заданной величины, а равновесный состав практически не изменяется, разумеется, в заданных пределах.
Рассмотрим еще раз практическое применение этого метода( см. также задачу 3.3.16).
Для реакции (1) (учитывая стехиометричность начального состава) выразим равновесный состав через начальный и химическую переменную ξ1j, где 1- номер реактора R1, в котором протекает реакция (1), j-номер “прохода” через этот реактор. Тогда после первого “прохода”:
![]() (1)
(1)
равновесный 1-ξ11 1-ξ11 ξ11 ξ11
состав, моль
Значение
ξ11,
а следовательно, и равновесный состав
на выходе из реактора R11
после первого “прохода”
![]() находят
из соотношения (а), связывающего
равновесный состав и константу равновесия
находят
из соотношения (а), связывающего
равновесный состав и константу равновесия![]() :
:
![]()
Реакционная смесь такого состава поступает во второй реактор R2j, где протекает реакция (2). В реакторе R2 устанавливается равновесие реакции (2).
![]() (2)
(2)
исходный
состав, моль ξ11 0 ξ11
равновесный
состав, моль n11-2ξ21 ξ21 n11+ξ21
Теперь
находят h21,
используя связь между
![]() и равновесным составом во второй реакции.
и равновесным составом во второй реакции.
![]()
Находят
равновесный состав на выходе из второго
реактора R21
после первого «прохода»:
![]()
Этот состав снова поступает в первый реактор R12, где осуществляется второй проход:
![]() (1)
(1)
исходный
![]()
![]()
![]()
![]()
состав,
моль
![]()
![]()
![]()
![]()
Из соотношения:
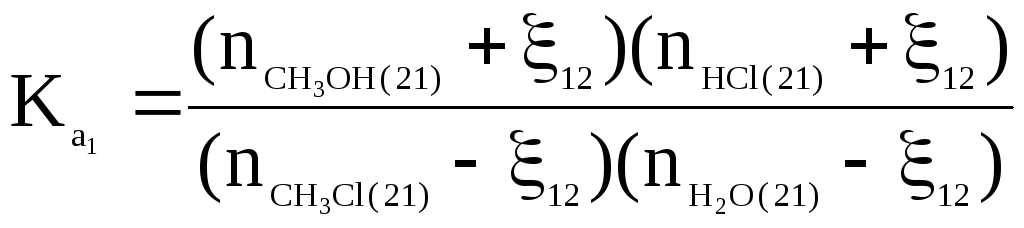
определяют
ξ12
и равновесный состав на выходе из первого
реактора после второго прохода
![]() который поступает во второй реакторR22
,
который поступает во второй реакторR22
,
где осуществляется второй “проход”, и.т.д.
Указанную процедуру проводят, пока не будут выполнены наперед заданные условия относительно значений ξij.
Последовательность расчетов и его результаты иллюстрируются схемой, в которой Rij и ξij соответственно i-ый реактор и значение химической переменной в i-ом реакторе после j-го “прохода”.
CH3Cl H2O CH3OH HCl
 1
1 0 0 выход
R11
вход R12
1
1 0 0 выход
R11
вход R12
|
CH3Cl |
H2O |
CH3OH |
HCl |
|
0,9623 |
0,9623 |
0,0377 |
0,0377 |

 выход
вход
R11
выход
вход
R11вход R11
-
R11

|
R21
|
|
CH3Cl |
H2O |
CH3OH |
CH3OCH3 |
HCl |
|
0,9623 |
0,9688 |
0,0247 |
0,0065 |
0,0377 |
ξ12=0,0065

|
CH3Cl |
H2O |
CH3OH |
CH3OCH3 |
HCl |
|
0,9498 |
0,9613 |
0,0322 |
0,0065 |
0,0452 |
|
R |
ξ21=0,0075
|
R22 |
|
CH3Cl |
H2O |
CH3OH |
CH3OCH3 |
HCl |
|
0,9498 |
0,9633 |
0,0282 |
0,0085 |
0,0452 |

x22=0,002
|
R |
|
CH3Cl |
H2O |
CH3OH |
CH3OCH3 |
HCl |
|
0,9478 |
0,9613 |
0,0302 |
0,0085 |
0,0472 |
x31=0,002
|
R23 |
|
CH3Cl |
H2O |
CH3OH |
CH3OCH3 |
HCl |
|
0,9478 |
0,9620 |
0,0288 |
0,0092 |
0,0472 |

x23=0,0007
|
R |
|
CH3Cl |
H2O |
CH3OH |
CH3OCH3 |
HCl |
|
0,9472 |
0,9614 |
0,0294 |
0,0092 |
0,0478 |
x41=0,0006
|
R24 |
|
CH3Cl |
H2O |
CH3OH |
CH3OCH3 |
HCl |
|
0,9472 |
0,96155 |
0,0291 |
0,00935 |
0,0478 |
x24=0,00015

 O+H2O
CO2+H2
O+H2O
CO2+H2 CO
CO2+C(тв)
CO
CO2+C(тв) CO+H2O
CO2+H2
CO+H2O
CO2+H2 CO
CO2+C
(тв)
CO
CO2+C
(тв) CO
CO2+C
(тв)
CO
CO2+C
(тв) O+H2O
CO2+C
(тв)
O+H2O
CO2+C
(тв) O+H2O
CO2+H2
O+H2O
CO2+H2 O
+H2O
CO2+H2
O
+H2O
CO2+H2 CO
CO2+C
(тв)
CO
CO2+C
(тв) O+H2O
CO2+H2
O+H2O
CO2+H2 CO
CO2+C
(тв)
CO
CO2+C
(тв) CO+H2O
CO2+H2
CO+H2O
CO2+H2 O+H2O
CO2+H2
O+H2O
CO2+H2 CO
CO2+C
(тв)
CO
CO2+C
(тв) O+H2O
CO2+H2
O+H2O
CO2+H2 CO
CO2+C
(тв)
CO
CO2+C
(тв) 12
12 13
13 14
14