
- •Расчётные задачи химической термодинамики
- •Глава 1.
- •Если использовать средние значения теплоемкости и плотностив заданном температурном интервале, то объемная плотность аккумулированной энергии равна:
- •Задача 1.3.4
- •Задача 1.3.6
- •Задача 1.38
- •1.4 Задачи
- •Глава 2. Тепловые эффекты физико-химических процессов.
- •2.1. Цели изучения
- •2.2. Основные закономерности.
- •Для реакций с участием идеальных газов
- •2.3. Основные задачи
- •Отметим, что рассматриваемая реакция протекает наряду с реакциями
- •Задача 2.3.4.
- •Глава 3.
- •В некоторых случаях можно воспользоваться значениями средних
- •3.3. Основные задачи.
- •Задача 3.3.2
- •Задача 3.3 Определите возможность протекания процесса
- •Решение
- •Задача. 3.3.4
- •Задача 3.3.5
- •Решение
- •Решение
- •Решение уравнения с помощью эвм - секунды, но почти с той же
- •Задача 3.3.8
- •Согласно [1], логарифм константы равновесия реакции образования
- •Исходя из этих соображений, проследим влияние давления на вели-
- •Выразим связь между константой равновесия и равновесным соста-
- •Задача 3.3.13
- •3.4. Многовариантные задачи.
Решение
Возможность
самопроизвольного процесса в условиях,
отличных от стандартных, определяется
соотношением (3.30) и для исследуемой
реакции имеет вид:
![]()
Учтя
значение
![]() (см. задачу3.3.5)
(см. задачу3.3.5)
![]()
Откуда
![]()
Поскольку
величина, стоящая под ln
должна быть безмерной, то давление
следует выражать в тех же единицах,
которые использовались при определении
стандартного состояния - если стандартное
давление
![]() ,
тоP>1,35
атм, если
,
тоP>1,35
атм, если
![]() ,
то P>1350
кПа.
,
то P>1350
кПа.
Задача 3.3.7 Исследуйте возможность синтеза оксидов азота из молекулярного азота и кислорода.
Решение. Критерием возможности самопроизвольного протекания процесса является условие (3.39-3.40);
![]()
Найдем значения констант равновесия предполагаемых возможных процессов, используя данные о константах равновесия реакций образования, значения которых табулированы [1]:
|
№ |
Реакция |
Логарифм константы равновесия реакции образования lgKf при температуре, K
| ||
|
500 |
700 |
1000 | ||
|
1 |
|
-12,45 |
-9,99 |
-8,12 |
|
2 |
|
-8,88 |
-6,16 |
-4,11 |
|
3 |
|
-6,77 |
-5,76 |
-5 |
|
4 |
|
-19,55 |
-19,02 |
-18,48 |
Тогда для каждой из реакций зависимость (3.39) имеет вид:
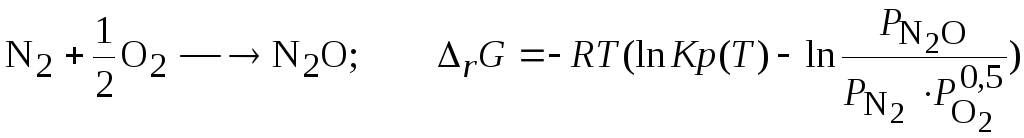
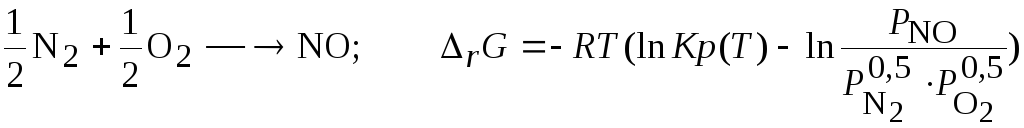
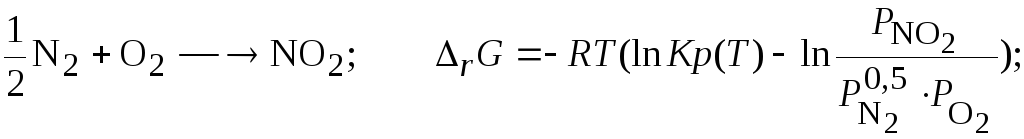
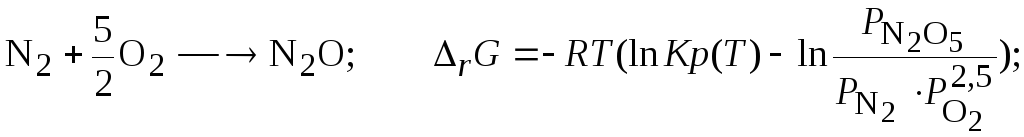
![]()
![]() Анализ
приведенных зависимостей показывает,
что, если концентра-
Анализ
приведенных зависимостей показывает,
что, если концентра-
ция
продуктов в смеси равна нулю, то,
![]() ,следовательно, реакция обязательно
начнется (конечно, если нет кинетических
затруднений*)
независимо от того, чему равно стандартное
сродство
,следовательно, реакция обязательно
начнется (конечно, если нет кинетических
затруднений*)
независимо от того, чему равно стандартное
сродство![]() и, соответственно, значение
и, соответственно, значение![]() .
.
Однако, принципиальная способность синтеза оксидов азота опреде-
ляется
степенью превращения азота
![]() (3.47) в рассматриваемых
(3.47) в рассматриваемых
реакциях.
Поэтому рассчитаем
![]() для реакции
для реакции
1 /2NO2+O2
NO2
/2NO2+O2
NO2
при стехиометрическом соотношении исходных веществ и 1000К.
При
этой температуре
![]()
![]() (в
остальных случаях
(в
остальных случаях![]() меньше
меньше
этой величины).
 1/2NO2
+ O2
NO2
1/2NO2
+ O2
NO2
Исходный
состав,
моль
![]()
![]()
![]()
состав при
равновесии,
![]()
![]()
![]()
моль
![]()
![]()
Тогда,
в соответствии с (3.46) и учтя, что
![]() ,
получим
,
получим
![]()
После
упрощений и подстановки значения
![]() :
:
![]()
Решение уравнения с помощью эвм - секунды, но почти с той же
скоростью его можно решить (см. отступление второе), если допустить,
поскольку
![]() очень мала,
очень мала,![]() и подставить это значение в выражение
в скобках. Тогда, если р = 1
и подставить это значение в выражение
в скобках. Тогда, если р = 1![]()
Подставим это значение:
![]() ,
откуда
,
откуда
![]()
Следовательно,
при заданных условиях р = 1 и Т = 1000К
степень пре-вращения χ![]() (3.47)
и мольная доля
(3.47)
и мольная доля![]() в равновесной смеси (3.48)
в равновесной смеси (3.48)![]()
Поскольку исследуемая реакция идет с уменьшением объема, равновесный состав будет зависеть от общего давления p (3.47), однако его увеличение не может привести к заметному изменению степени превращения азота.
Другие реакции можно не рассматривать, поскольку значения констант равновесия еще меньше, чем в исследуемом процессе.
Таким
образом, прямой синтез оксидов азота
не может быть осуществлен в рассматриваемом
температурном интервале. Однако, при
температуре электрической дуги возможно
получение
![]() ,
но выход
,
но выход![]() остается небо-
остается небо-
льшим.
Задача 3.3.8
Д ля
реакции 3H2+N2
2NH3
ля
реакции 3H2+N2
2NH3
cтандартное
изменение энергии Гиббса при 500К
![]()
Возможен ли при такой температуре синтез аммиака из азота и водоро-
да.
Решение.
Величина
![]() дает изменение энергии Гиббса только
для частного
дает изменение энергии Гиббса только
для частного
случая,
когда и исходные вещества, и продукты
реакции находятся в стандартном
состоянии, т.е. при
![]() .
.
Поэтому,
основываясь на приведенном значении
![]() можно сделать вывод, что при стандартных
условиях синтез аммиака из азота и
водорода невозможен: самопроизвольно
будет протекать обратный процесс -
диссоциация аммиака.
можно сделать вывод, что при стандартных
условиях синтез аммиака из азота и
водорода невозможен: самопроизвольно
будет протекать обратный процесс -
диссоциация аммиака.
Возможность протекания процесса при условиях, отличных от стандартных, определяется критерием (3.39), который можно представить в виде:
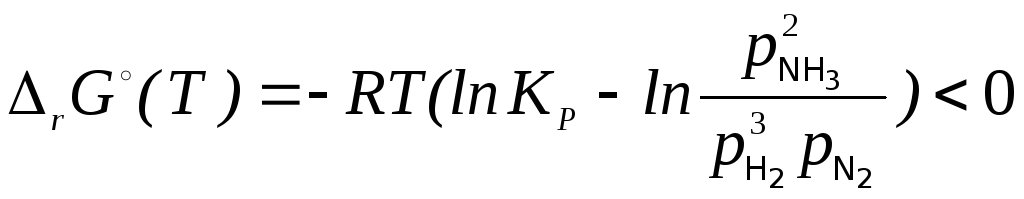 (3.39)
(3.39)
Задача 3.3.9
Определите, при каких давлениях NH3 возможен синтез аммиака по
р еакции
3H2+N2
2NH3
и Т = 800К, если парциальное давление
азота и водорода
еакции
3H2+N2
2NH3
и Т = 800К, если парциальное давление
азота и водорода
![]()
Решение. Воспользуемся критерием (3.39), для чего вначале определим константу равновесия реакции при 800К.
