
- •Расчётные задачи химической термодинамики
- •Глава 1.
- •Если использовать средние значения теплоемкости и плотностив заданном температурном интервале, то объемная плотность аккумулированной энергии равна:
- •Задача 1.3.4
- •Задача 1.3.6
- •Задача 1.38
- •1.4 Задачи
- •Глава 2. Тепловые эффекты физико-химических процессов.
- •2.1. Цели изучения
- •2.2. Основные закономерности.
- •Для реакций с участием идеальных газов
- •2.3. Основные задачи
- •Отметим, что рассматриваемая реакция протекает наряду с реакциями
- •Задача 2.3.4.
- •Глава 3.
- •В некоторых случаях можно воспользоваться значениями средних
- •3.3. Основные задачи.
- •Задача 3.3.2
- •Задача 3.3 Определите возможность протекания процесса
- •Решение
- •Задача. 3.3.4
- •Задача 3.3.5
- •Решение
- •Решение
- •Решение уравнения с помощью эвм - секунды, но почти с той же
- •Задача 3.3.8
- •Согласно [1], логарифм константы равновесия реакции образования
- •Исходя из этих соображений, проследим влияние давления на вели-
- •Выразим связь между константой равновесия и равновесным соста-
- •Задача 3.3.13
- •3.4. Многовариантные задачи.
3.3. Основные задачи.
Задача 3.3.1. Какая из следующих реакций сопровождается наибольшим уменьшением и наибольшим увеличением энтропии при Т=const?
1.![]()
2.![]()
3.![]()
4.![]()
5.![]()
6.![]()
7.![]()
8.![]()
9.![]()
Сделайте вначале качественный вывод, который затем подтвердите расчетом.
Решение.
Поскольку энтропия является мерой
неупорядоченности системы, то ее
качественное изменение (3.9) можно
определить по изменению числа молей
газообразных веществ
![]() в результате реакции: если
в результате реакции: если![]() ,
то энтропия возрастает, причем, чем
больше
,
то энтропия возрастает, причем, чем
больше![]() ,
тем больше возрастание энтропии; если
,
тем больше возрастание энтропии; если![]() <0,
то энтропия уменьшается.
<0,
то энтропия уменьшается.
Тогда для исследуемых реакций:
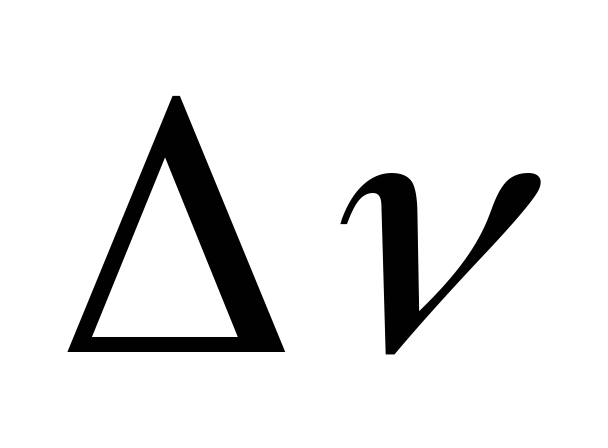 =-1
Максимальное уменьшение числа молей
газообразных ве-
=-1
Максимальное уменьшение числа молей
газообразных ве-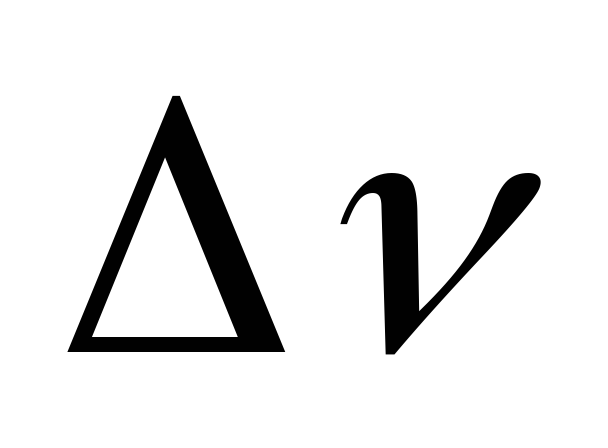 =
0 ществ
=
0 ществ
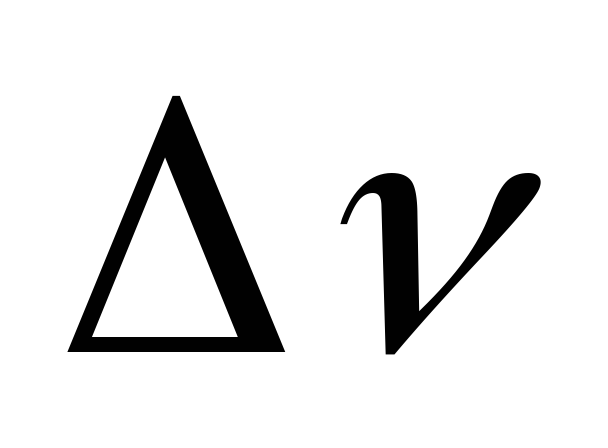 происходит в результате реакции (3):
происходит в результате реакции (3):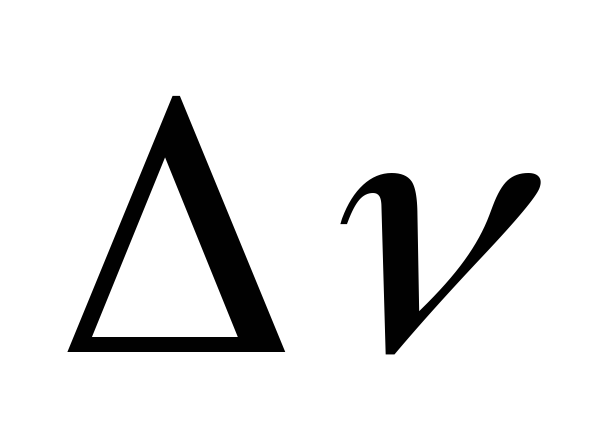 =-3
=-3
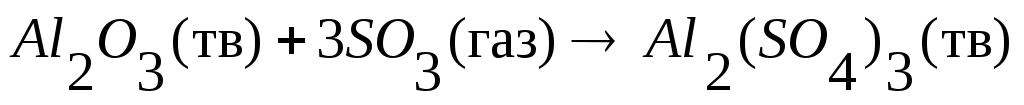 .
.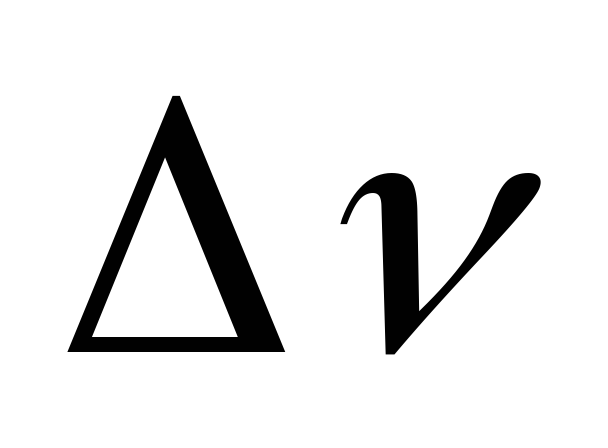 =-2
Максимальное увеличение числа молей
газообразных ве-
=-2
Максимальное увеличение числа молей
газообразных ве- 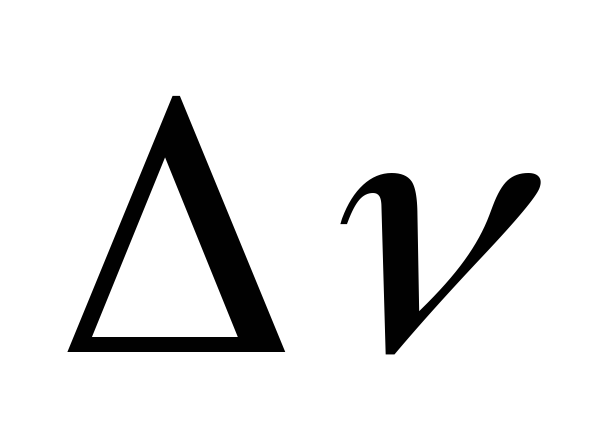 =-2
ществ
=-2
ществ
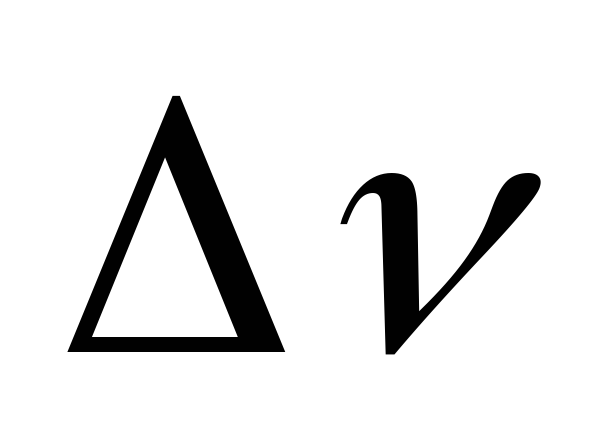 происходит при протекании реакции (7):
происходит при протекании реакции (7):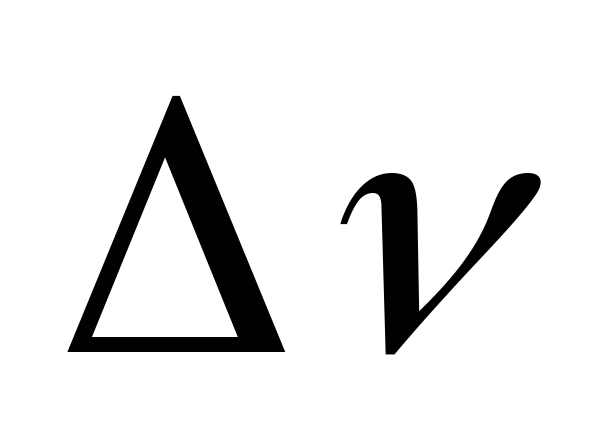 =
1
=
1
 .
.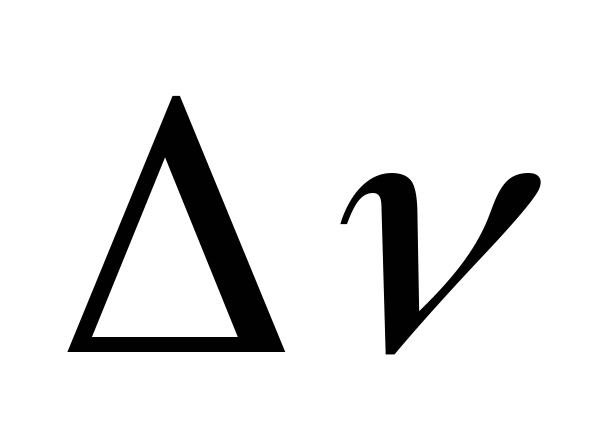 =
3 Следовательно, в результате именно
этих реакций проис-
=
3 Следовательно, в результате именно
этих реакций проис-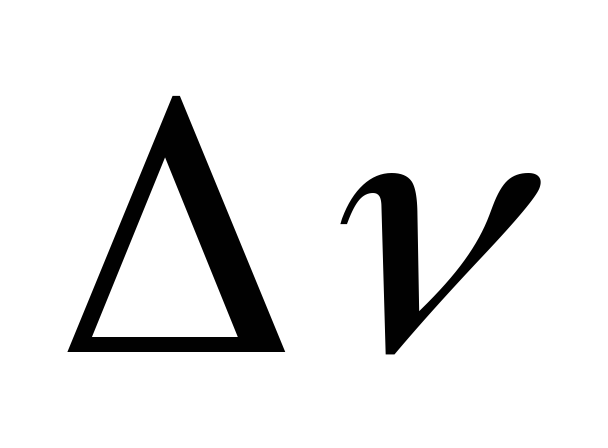 =
1 ходит максимальное уменьшение и
увеличение энтропии
=
1 ходит максимальное уменьшение и
увеличение энтропии 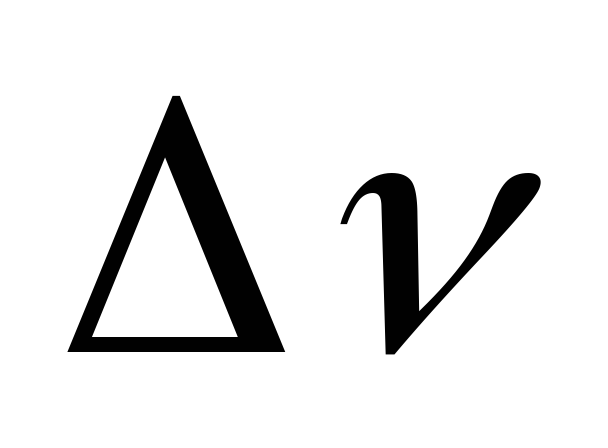 =
1 системы.
=
1 системы.
Теперь
рассчитаем изменение энтропии
![]() согласно закону Гесса, поскольку энтропия
является функцией состояния, т.е. ее
изменение определяется только конечным
и начальным состоянием системы и не
зависит от пути перехода из одного
состояния в другое.
согласно закону Гесса, поскольку энтропия
является функцией состояния, т.е. ее
изменение определяется только конечным
и начальным состоянием системы и не
зависит от пути перехода из одного
состояния в другое.
Значение
энтропии найдем в
![]() .
Расчет будем вести в матричной форме
(см. отступление 1.)
.
Расчет будем вести в матричной форме
(см. отступление 1.)
1.
![]()
![]() ,
,![]() (38.07 188.72 83.39)
(38.07 188.72 83.39)![]() =
=![]() -143.4
-143.4
2.
![]()
![]() ,
,![]() (38.07 69.95 83.39)
(38.07 69.95 83.39)![]() =
=![]() -23.73
-23.73
3.
![]()
![]() ,
,![]() (50.92 256.69 239.20)
(50.92 256.69 239.20)![]() =
=![]() -581.79
-581.79
4.
![]()
![]() ,
,![]() (191.50 130.52 192.66)
(191.50 130.52 192.66)![]() =
=![]() -197.74
-197.74
5.
![]()
![]() ,
,![]() (192.66 186.79 95.81)
(192.66 186.79 95.81)![]() =
=![]() -283.64
-283.64
6.
![]()
![]() ,
,![]() (304.35 240.06)
(304.35 240.06)![]() =
=![]() 175.77
175.77
7.
![]()
![]() ,
,![]() (120.8 192.66 213.66 188.72)
(120.8 192.66 213.66 188.72) 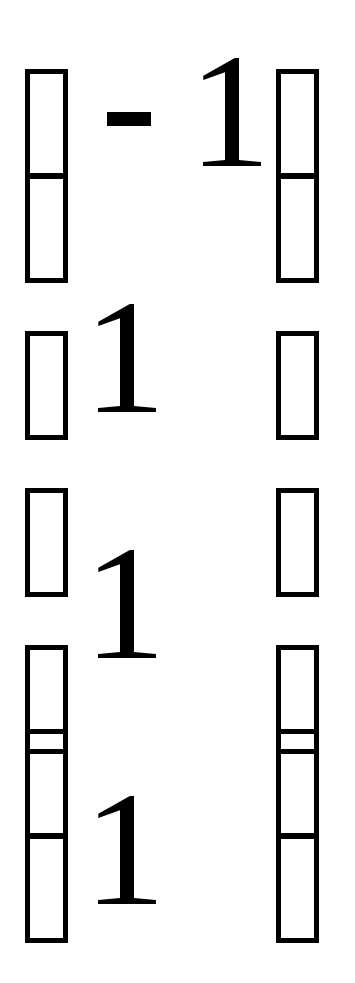 =
=
![]() 474.24
474.24
8. CO2 + C(тв) → 2CO(газ)

9. CaCO3(тв)→CaO(тв) + CO2
![]()
Сравнение полученных данных подтверждает полученный вывод.
Задача 3.3.2
В реакциях:
1. Al2O3(тв)+3SO3(газ)→Al2(SO4)3(тв)
Энтропия при проведении процесса, при постоянной температуре T=298К уменьшается (см. решение предыдущей задачи). Как будет изменяться ∆rS0 в этой реакции при повышении температуры? Выведите уравнения зависимости ∆rS0 (T).
Решение. В области температур, где нет фазовых переходов изменения энтропии в зависимости от температуры описывается уравнением
S0(T)
= S0(298)
+![]() ,(3.4)
,(3.4)
где Cp(T) описывается полиномом вида:
Cp(T)
= a
+
bT
+
![]() ,
,
Коэффициенты которого, так же как и S0(298), табулированы [1].
Для химической реакции зависимость ∆rS0(T) описывается уравнением:
∆rS0
(T)
=
∆rS0(298)
+![]() ,(3.4)
,(3.4)
∆rCp(T)
= ∆a
+
∆bT
+
![]() ,
,
Разумеется, в температурном интервале 298 – T фазовые переходы отсутствуют.
Рассмотрим вначале, как изменяется с температурой ∆rS0 (T).
Необходимые для расчета данные [1] оформим в виде матрицы термодинамических характеристик и вектора – столбца стехиометрических коэффициентов.
Вещество Al2O3 (тв) + 3SO3(газ) → Al2(SO4)3(тв)

И, подставив полученные результаты в (3.4):
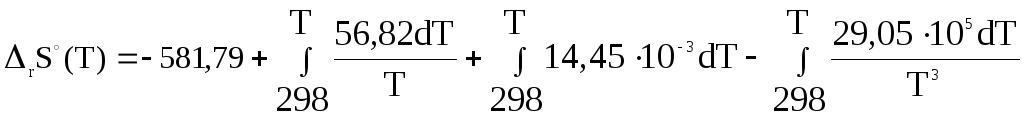
После интегрирования:
![]()
Полученная
зависимость оценивает изменение
![]() в
интервале температур 298 – 1100 К.
в
интервале температур 298 – 1100 К.
Рассчитаем,
используя полученную зависимость,
![]() при
увеличении температуры в этом интервале:
при
увеличении температуры в этом интервале:
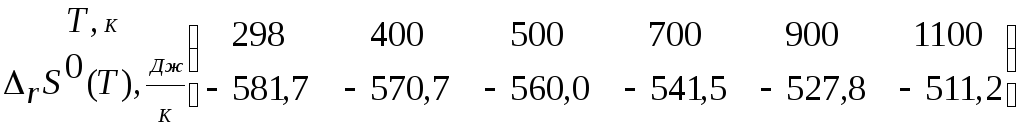
Полученные
результаты свидетельствуют о том, что
![]() при
увеличении температуры увеличивается.
при
увеличении температуры увеличивается.
Возникает
естественный вопрос: чем вызван такой
характер изменения ![]() и
всегда ли наблюдается подобный эффект?
и
всегда ли наблюдается подобный эффект?
В соответствии с (3.3)
![]()
и
изменение энтропии при повышении
температуры определяется знаком ![]() .
.
В рассматриваемом случае
![]()
и
при любой T
рассматриваемого интервала ![]() подтверждает
расчет, данные которого приведены в
таблице:
подтверждает
расчет, данные которого приведены в
таблице:
|
T, K |
298 |
400 |
500 |
700 |
900 |
1100 |
|
|
28,3 |
44,4 |
52,4 |
61,0 |
66,2 |
70,3 |
Результаты иллюстрируются рис.
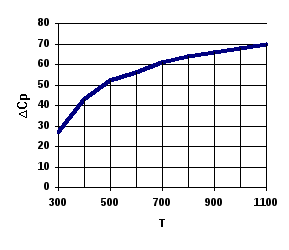
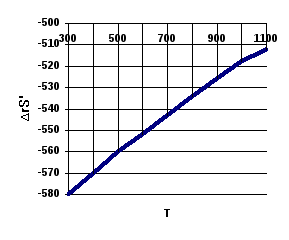
Рис.
Влияния температуры на![]() и
и![]() в реакции
в реакции
Al2O3 (тв) + 3SO3(газ) → Al2(SO4)3(тв)
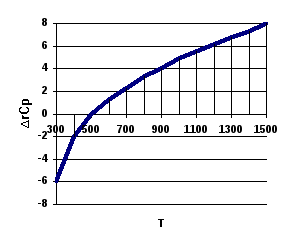
Разумеется, согласно (3.3), могут быть и более «хитрые» варианты.
Так, например, для реакции
![]()
З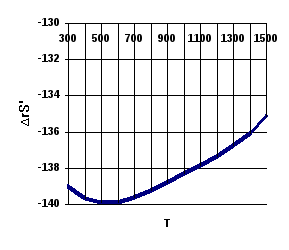 ависимость
ависимость![]() и
и![]() изображены
на рис.
изображены
на рис.
Рис.
Изменение
![]() и
и![]() в
в
зависимости
от температуры в реакции ![]()
В этом случае
зависимость
![]() проходит
через минимум при Т=500К, что обусловлено
изменением знака
проходит
через минимум при Т=500К, что обусловлено
изменением знака
![]() при
этой температуре.
при
этой температуре.
Подтвердим приведенные данные расчетом:
Вещество![]()
Параметр.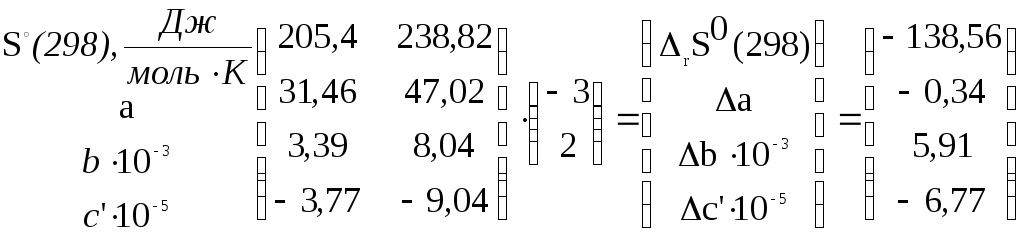
Тогда
![]()
и согласно (3.3)
![]()
И после интегрирования:
![]()
Расчет
значений
![]() и
и![]() в
температурном интервале 298-1500 К по
полученным соотношениям приведен в
таблице:
в
температурном интервале 298-1500 К по
полученным соотношениям приведен в
таблице:
|
T,K |
298 |
400 |
500 |
700 |
900 |
1100 |
1300 |
1500 |
|
|
-6,2 |
-2,1 |
-0,09 |
2,4 |
4,1 |
5,6 |
6,9 |
8,0 |
|
|
-138,6 |
-139,8 |
-140,0 |
-139,6 |
-138,8 |
-137,8 |
-136,8 |
-135,7 |
