
- •Тонка структура спектрів
- •Спектр атома натрію.
- •Опис установки
- •1.Призначення
- •2. Оптична схема і принцип дії приладу
- •Додаток до лабораторної роботи № 7
- •Оптическая схема спектроскопа ум-2
- •Лабораторная работа № 10 Изучение спектра атома натрия
- •Лабораторная Работа № 7 Спектр Атома Натрия
- •Работа 10 изучение спектра атома натрия
Додаток до лабораторної роботи № 7
Енергії станів nl виражаються формулою
= , n = 3,4,…,
(Rhc= А = Ry (Ридберг) 1Ry = 13,6 еВ – енергія іонізациї атома водню (із основного стану)
Відмінність від атома водню полягає у тому, що n – ∆l вже не ціле число, як у випадку водню, а відрізняється від відповідного головного квантового числа n на величину ∆, (∆ > 0), яку називають квантовим дефектом.
n |
l |
|||
0 |
1 |
2 |
3 |
|
s |
p |
d |
f |
|
3 |
1,373 |
0,883 |
0,013 |
– |
4 |
1,358 |
0,867 |
0,011 |
0 |
5 |
1,353 |
0,862 |
0,011 |
0 |
6 |
1,341 |
0,862 |
0,011 |
0 |
Таблиця 1.Значення квантового дефекту для атома натрію
n |
3 |
4 |
5 |
6 |
Ens, еВ |
|
|
|
|
Enp, еВ |
|
|
|
|
End, еВ |
|
|
|
|
Enf, еВ |
|
|
|
|
Довжини хвиль ліній атома лужного металу визначаються із загальної формули:
(Індекси i, k означають залежність квантового дефекту від орбітального квантового числа l=0,1, 2,…(n –1).)
для різкої серії формула приймає вигляд:
, n = 4,5,…,
а для дифузної серії -
, n = 3,4,…
У формулах R – стала Рідберга, ħ – стала Планка, m - маса спокою електрона, e - його заряд, n1, n2 - головні квантові числа,
Z |
елемент |
a |
a1 |
3 |
Li |
1,98 |
2,02 |
11 |
Na |
9,58 |
7,45 |
19 |
K |
17,24 |
13,03 |
37 |
Rb |
34,82 |
26,95 |
55 |
Cs |
52,45 |
40,8 |
Таблиця 2. Значення сталих а і а1 для лужних елементів

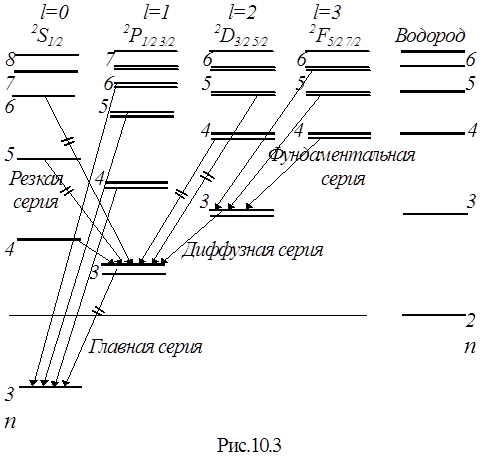
Рис. Схема рівнів атома натрію і переходи між ними, що приводять до утворення серій
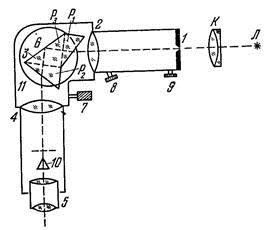
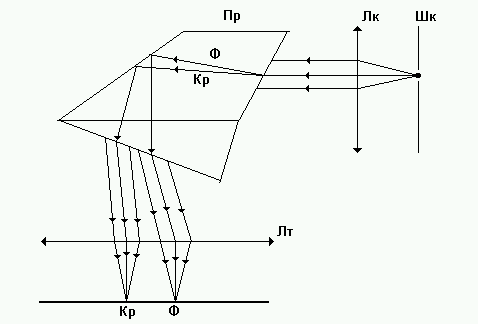
Оптическая схема спектроскопа ум-2
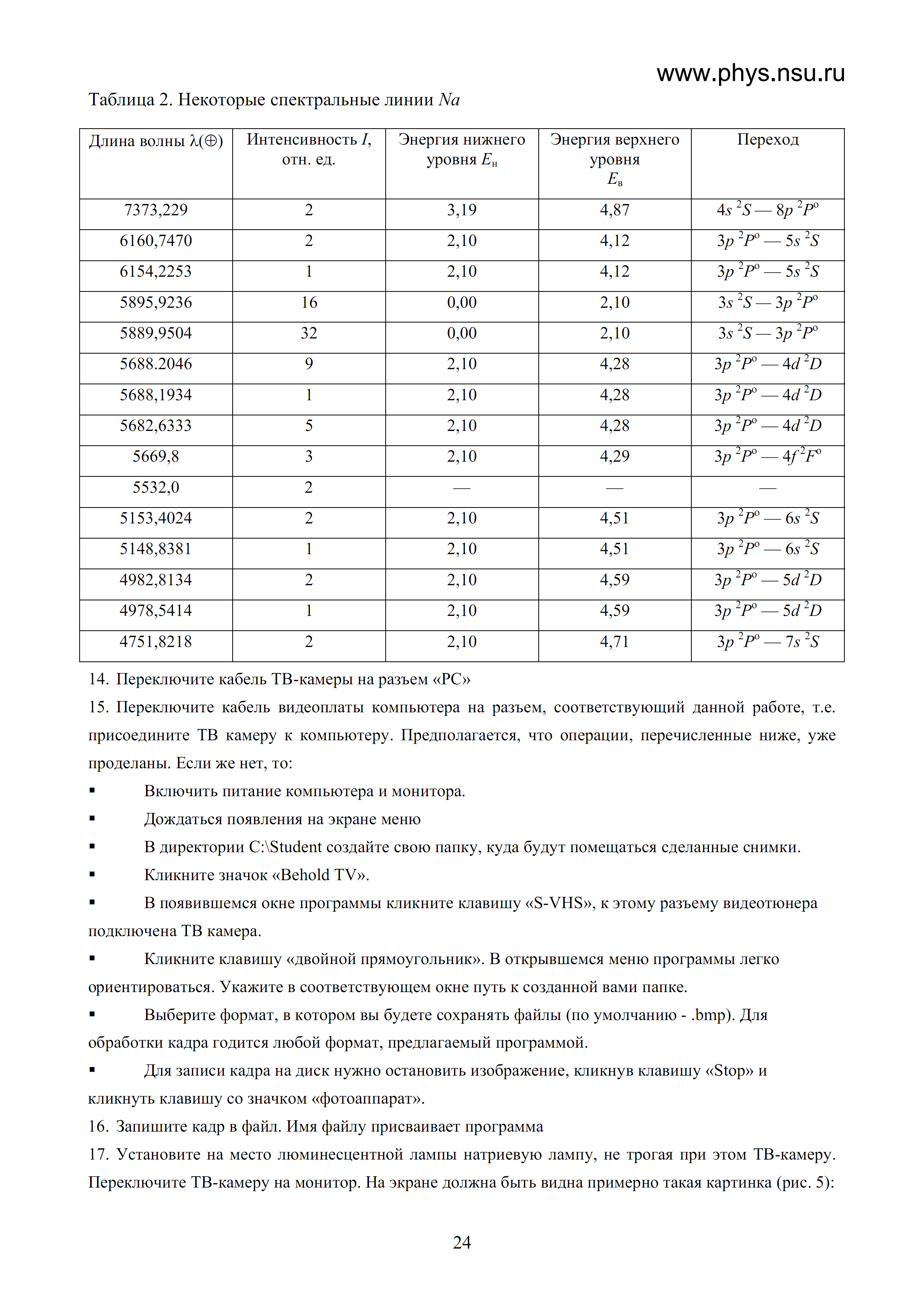
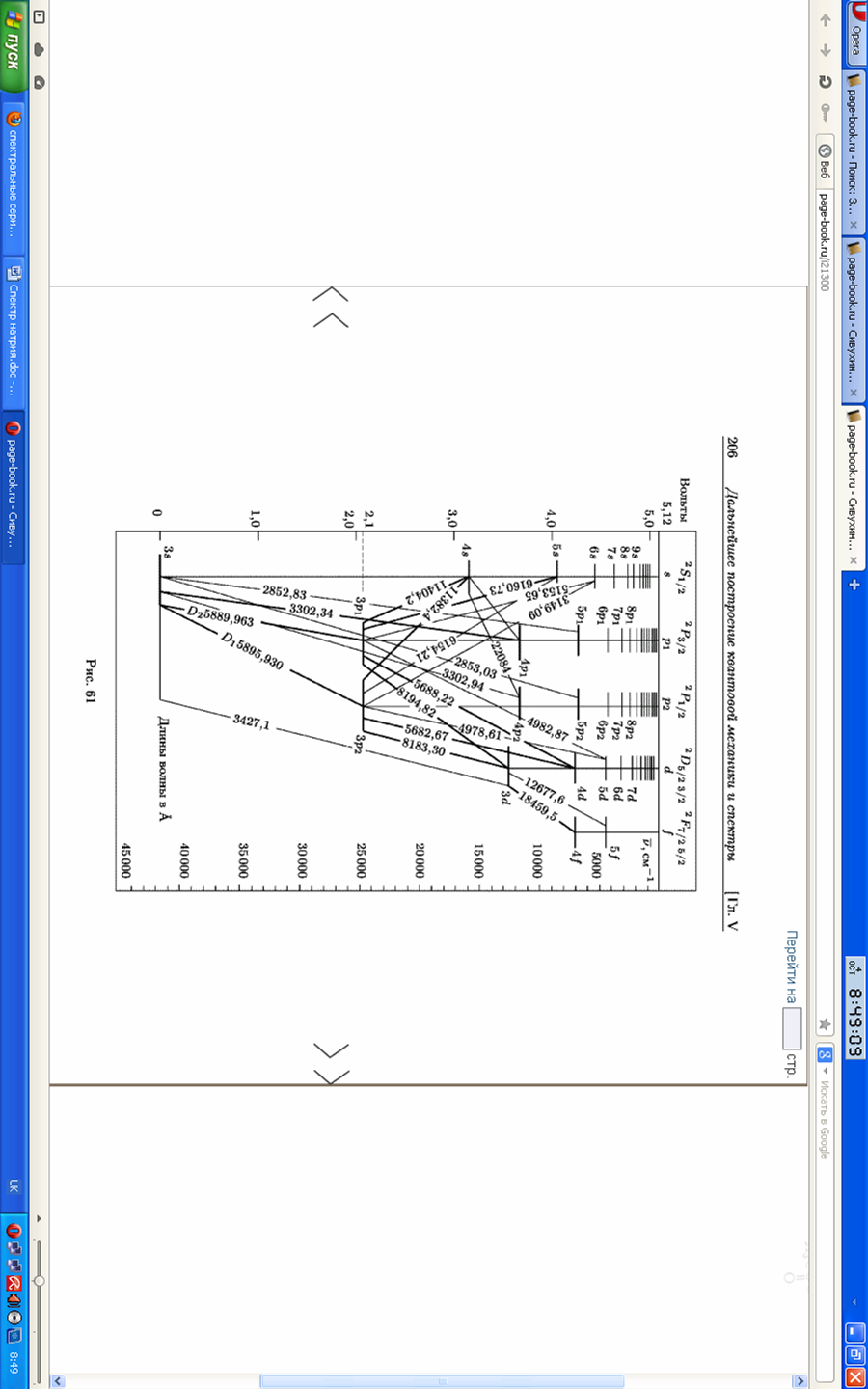
Таблиця 2. Деякі спектральні лінії Na
|
Спектральная линия |
Деления шкалы |
Длина волны, нм |
Н А Т Р И Й |
1.Красно-оранжевая 2. Желтая (яркая) 3. Желто-зеленая 4. Зеленая 5.Зелено-голубая 6. Сине-голубая |
|
|
Таблица 2. Измерение спектральных линий натрия
По длинам волн в спектре излучения натрия рассчитывается постоянная Планка. Данные заносятся в таблицу 3.
№ п/п |
Серия |
нм |
n |
l |
an,l |
n’ |
l’ |
an’,l’ |
hi Дж-с |
<h> Дж-с |
1. 2. 3. 4. 5. 6. |
Краснооранжевая Желтая (яркая) Желто-зеленая зеленая зелено-голубая сине-голубая |
1. 2. 3. 4. 5. 6. |
3 3 3 3 3 3 |
1 0 1 1 1 1 |
9,583 9,156 9,583 9,583 9,583 9,583 |
5 3 4 6 5 6 |
0 1 2 0 2 2 |
9,629 9,583 9,997 9,710 10,000 10,000 |
|
|
Таблица 3. Результаты расчета постоянной Планка.
1. Расчетная формула:

где h - постоянная Планка, m –масса электрона, 9,11*10-31кг, e- заряд электрона, 1,6 *10 -19Кл,
с- скорость света, 3*108м/с, 0- электрическая постоянная, 8,85*10-12Ф/м,
Z- порядковый номер Na (11), n и l - главное и орбитальное квантовые числа соответствующих переходов ( приведены в таблице), an l, an' l' - постоянные экранирования
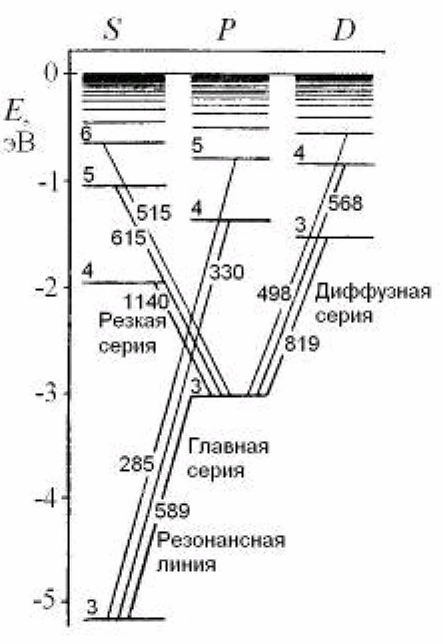
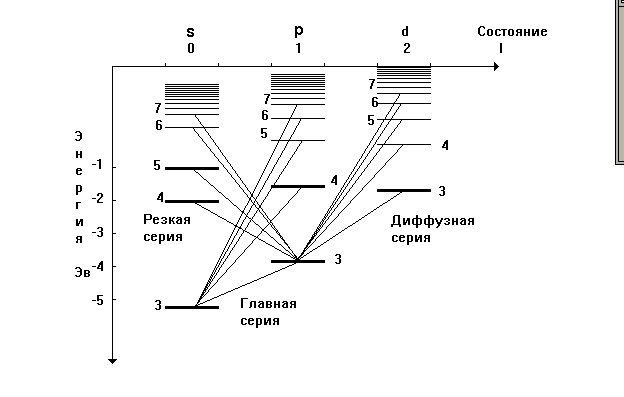
Головна серія спектру поглинання і випромінювання натрію розташована у видимій і ближній ультрафіолетовій області. Вона названа головною, тому що спостерігається при поглинанні світла парами натрію. В ближній інфрачервоній і видимій областях розташовані ще дві серії ліній, що перекриваються, названі різкою і дифузною по вигляду ліній — різка серія складається з різких ліній, а дифузна з розмитих. Кожна з серій подібна серії Бальмера атома водню. В більш дальній інфрачервоній області є ще одна серія, практично співпадаюча з серією Пашена атома водню і тому названа фундаментальною, серія Бергмана (основна).
Квантові розрахунки приводять до залежності енергії оптичного електрона не тільки від головного квантового числа n, але й від орбітального квантового числа l.
Головна серія спектру поглинання натрію утворюється при поглинанні світла з переходами електрона з основного стану 3s в стани пр з азимутальним (орбітальним) квантовим числом l =1 і головними квантовими числами n = 3,4,... Лінії випромінювання головної серії утворюються при зворотних переходах.
Дифузна серія, що складається з розмитих ліній утворюється під час переходу зовнішнього електрона з декількох d-станів у стан Зр. Рівні енергій віддалених від атомної серцевини d-станів мало відрізняються від відповідних енергій електрона в атомі водню
, де Е1 =13,6 еВ — модуль енергії основного стану атома водню.
