
- •6. Образование фаголизосомы.
- •7. Киллинг и расщепление. 8. Выброс продуктов деградации.
- •I. Особенности развития заболевания
- •II. Клинико-морфологический принцип
- •III. Направление дифференцировки опухолевых клеток
- •2. Токсический гепатит:
- •3. Лучевой гепатит (компонент лучевой болезни)
- •4. Гепатиты как следствие аутоиммунных заболеваний
ОБЩАЯ ПАТОФИЗИОЛОГИЯ.
Артериальная гиперемия, виды, признаки, причины, механизмы развития, последствия.
Нарушения периферического кровообращения/-гиперемия/-ишемия/-стаз/-тромбоз/-эмболия/-сладж
Гиперемия – увеличение кровенаполнения органа или ткани за счет увеличения притока артериальной крови по расширенным артериям и артериолам или в результате уменьшения оттока крови по венам.
Различают артериальную и венозную гиперемию.
Артериальная гиперемия
Физиологическая
адекватна воздействию и имеет адаптивное значение.
а) функциональная
б) защитно - приспособительная
2. Патологическая
неадекватна воздействию, не связана с изменением функции и играет повреждающую роль.
Механизмы развития артериальной гиперемии
1. Нейрогенный
а) нейротонический
б) нейропаралитический
2. Гуморальный
3. Миопаралитический
Артериальная гиперемияИзменения гемодинамики:
-увеличение числа и диаметра артериол, прекапилляров и капилляров
-повышение давления в артериолах, капиллярах, мелких венах
-увеличение объемной и линейной скорости кровотока
-повышение содержания гемоглобина в венозной крови
Проявления:
-покраснение органа или ткани
-повышение местной температуры
-пульсация сосудов
-повышение тургора тканей
-повышение интенсивности обмена веществ
-увеличение лимфообращения и лимфоотока
Венозная гиперемия, причины, признаки, механизмы развития, последствия.
Причины:
-обтурация вен тромбом или эмболом
-компрессия вен опухолью, рубцом и др.
-сердечная недостаточность
-низкая эластичность венозных стенок
Венозная гиперемия Изменения гемодинамики:
-увеличение числа и диаметра венозных сосудов
-снижение объемной и линейной скорости кровотока
-повышение проницаемости сосудов
-транссудация
-маятникообразные движения крови
-повышение давления в венах и капиллярах
Венозная гиперемия Проявления:
-цианоз ткани или органа
-местное снижение температуры
-отек
-увеличение объема органа или участка ткани
-кровоизлияния в ткани
-кровотечения
Ишемия, причины, механизмы развития, последствия. Стаз.
Изменения гемодинамики:
-уменьшение количества и диаметра артериальных сосудов
-уменьшение объемной и линейной скорости кровотока
-понижение артериального давления
-понижение напряжения кислорода ниже места препятствия
Ишемия
Проявления:
‘бледность участка ткани или органа
‘местное снижение температуры
‘снижение выраженности пульсации артериальных сосудов
‘уменьшение объема и тургора органа, участка ткани
‘снижение лимфообразования
‘парестезии и болевой синдром
Последствия:
!гипоксия
!избыток в тканях продуктов нарушенного метаболизма, БАВ
В зависимости от исхода ишемия бывает обратимая и необратимая (инфаркт, некроз, гангрена).
Исход ишемии зависит от:
!локализации
!скорости развития
!продолжительности
!степени развития коллатерального кровообращения
Патофизиология периферического кровообращения. Стаз. Тромбоз. Эмболия. Сладж.
Стаз
значительное замедление и прекращение тока крови или лимфы в сосудах ткани или органа.
Виды стаза:
1. истинный
2. ишемический
3. венозный
Тромбоз, причины, механизмы развития, последствия.
Тромбоз
процесс прижизненного образования на внутренней поверхности стенки сосудов сгустков крови, образующихся в результате её свертывания.
Этиология:
!повреждение сосудистой стенки
!изменение активности свертывающей и противосвертывающей систем крови
!замедление и нарушение кровотока
!повышение вязкости крови
Виды тромбов
1. По отношению к просвету сосуда:
- пристеночные
- закупоривающие (обтурирующие)
2. В зависимости от состава:
- белые (лейкоциты + белки плазмы)
- красные (эритроциты)
- смешанные
Тромбообразование
Исходы тромбоза:
1. Благоприятный
!асептический аутолиз тромба
!организация тромба
!обызвествление тромба
Неблагоприятные
!развитие инфаркта, гангрены
!развитие дистрофических изменений в тканях
!отрыв тромба с развитием тромбоэмболии
Эмболия, причины, механизмы развития, последствия.
перенос током крови или лимфы обычно не встречающихся в них частиц или тел (эмболов) и закупорка ими сосудов.
Классификация эмболии
1. По характеру
!экзогенная (воздух, инородные тела)
!эндогенная (тромб, жировая ткань)
2. По локализации
!большого круга кровообращения
!малого круга кровообращения
!воротной вены
!лимфатической системы
3. По направлению перемещения
! ортоградная
! ретроградная
! парадоксальная
последствия
Чаще всего встречаются инфаркты в почках,
селезенке, легких и головном мозгу. Мозговая ткань в области инфаркта
превращается в мягкую студенистую, а потом жидкую массу (размягчение
мозга). В других органах инфаркт при благоприятных условиях
рассасывается, замещаясь рубцовой тканью, причем форма инфаркта
конусообразная, с обращенным к поверхности органа основанием.
вызывая серьезные, нередко смертельный воспаления. Эмболия частицами
злокачественной опухоли дают повод к развитию новых опухолей (так наз.
переносные или метастатические опухоли).
Сладж, его виды, причины, механизмы развития.
Сладж: внутрисосудистое патологическое нарушение микроциркуляции, в основе которого лежит крайняя степень агрегации эритроцитов.
Сладж Особенности
!образование агрегатов эритроцитов
!лейкоциты прилипают к эндотелию сосудов
!меняется характер ламинарного кровотока (замедление, появление вихревых движений
Причины:
!изменение белкового состава крови
!уменьшение скорости кровотока
!повышение вязкости крови
!изменение физико-химических свойств плазмы
Сладж может развиваться при:
! аллергии
! тяжелой интоксикации
! шоковых и терминальных состояниях
! инфекционных болезнях
! местных повреждениях тканей
Типы сладжа
1. Классический
образуется при наличии препятствия движению крови
2. Декстрановый
возникает при введении в кровь высокомолекулярных препаратов декстрана
3. Аморфный
развивается при введение в кровь этилового спирта, тромбина и др.
Механизмы проникновения патологических агентов в клетку.
Пути поступления патологических агентов в клетку
1. Пассивный
- диффузия
2. Активный
а) эндоцитоз
- пиноцитоз
- фагоцитоз
б) адсорбционный эндоцитоз
Механизмы внутриклеточной защиты
-лизосомальная защита
- микросомальная защита
- антиоксидантная защита
Изменения в поврежденной клетке
Специфические
характерны для данного фактора при действии его на клетку.
Неспецифические:
стандартные проявления, которые не зависят от вида патогенного фактора.
Виды острого повреждения клетки
1. Парциальное
2. Тотальноклеточное
а) обратимое
б) необратимое
Механизмы внутриклеточной защиты при остром повреждении клетки.
-лизосомальная защита
- микросомальная защита
- антиоксидантная защита
Необратимое повреждение клетки, причины, механизмы, стадии развития.
Условия развития:
1-действие сильного патологического агента
2-механизмы повреждения преобладают над механизмами внутриклеточной защиты.
Стадии:
1. гиперактивность
2. агония
3. смерть
4. некроз
5. элиминация
Обратимое повреждение клетки (преддепрессионная гиперактивность), причины, механизмы.
Тотальноклеточное обратимое повреждение клетки
Условия развития:
-действие патологического агента умеренной силы
-способность клетки к внутриклеточной регенерации
-механизмы внутриклеточной защиты преобладают над механизмами повреждения.
- Стадии:
-1. гиперактивность
- полное уничтожение патологического агента
-2. депрессия
- восстановление структуры и функции клетки с продолжением жизнедеятельности
Тотальноклеточное обратимое повреждение клетки
В случае повреждения молекулы ДНК и неспособности клетки восстановить свой геном, она уничтожается:
1. путем распознования и уничтожения иммунной системой организма
2. путем апоптоза
Парциальный некроз, причины, механизм развития.
Некро́з (от греч. νεκρός — мёртвый), или омертве́ние — это патологический процесс, выражающийся в местной гибели ткани в живом организме в результате какого-либо экзо- или эндогенного её повреждения. Некроз проявляется в набухании, денатурации и коагуляции цитоплазматических белков, разрушении клеточных органелл и, наконец, всей клетки. Наиболее частыми причинами некротического повреждения ткани являются: прекращение кровоснабжения (что может приводить к инфаркту, гангрене) и воздействие патогенными продуктами бактерий или вирусов (токсины, белки, вызывающие реакции гиперчувствительности, и др.).
По этиологии
Травматический (первичный и вторичный)
Токсигенный
Трофоневротический
Ишемический
Клинико-морфологическая
Коагуляционный некроз (сухой)
Колликвационный некроз (влажный)
Казеозный некроз
Секвестр (медицина)
Гангрена
Инфаркт
Пролежни
По механизму возникновения
Прямой (токсический, травматический)
Непрямой (аллергический, ишемический, трофоневротический)
По макроскопическим признакам
Сухой некроз
Влажный некроз
13-Патология митохондрий.
Патология митохондрий
Причины:
-тканевая гипоксия
-уменьшение осмотического давления
Патология митохондрий
Признаки:
-длительное набухание
-уменьшение или полное исчезновение матрикса
-уменьшение числа митохондрий
Патология митохондрий
Последствия:
-снижается выработка энергии
-недостаточность макроэргических соединений
-нарушение окислительно-восстановительных процессов
-снижается устойчивость к патологическим воздействиям
Патология лизосом.
Патология лизосом
Причины:
-первичная недостаточность ферментных систем
-вторичная недостаточность ферментных систем
-активация лизосомальных ферментов
Патология лизосом
Последствия:
-снижение резистентности клетки к патогенным факторам
-аутолиз клетки (при выходе ферментов из лизосом)
-воспалительные реакции
-нарушение обменных процессов в организме
Патология клеточных мембран.
Патология клеточных мембран
Причины:
-инициация реакций перекисного окисления липидов
-активация эндогенных липаз
-осмотическое растяжение мембраны
-адсорбция на липидном слое чужеродных белков с последующим образованием гидрофильных каналов
Патология клеточных мембран
Последствия:
нарушение транспортных процессов
нарушение метаболических процессов
снижение возбудимости клетки
снижение барьерных свойств
нарушение рецепторных свойств
Изменения на клеточном уровне могут приводить к изменениям на тканевом уровне:
1. метаплазия (видоизменение)
2. дисплазия (образование)
3. неоплазия (сформированное, опухоль)
Внешние барьеры: виды, их функции, механизмы нарушений.
Барьерные функции организма и их нарушения
Биологические барьеры – это специализированные морфо-функциональные структуры, осуществляющие защиту организма от патогенных факторов внешней среды и обеспечивающие сохранение гомеостаза
Барьеры
1- Внешние
Кожа и все слизистые оболочки
2-Внутренние
Гистогематические барьеры
Функции кожи:
защитная
выделительная
участие в терморегуляции
Защита слизистых оболочек:
механическая
химическая
Факторы защиты слизистых оболочек
Клеточные
специфические
( лимфоциты )
неспецифические
( нейтрофилы, моноциты)
Гуморальные
специфические
(антитела s Ig A )
неспецифические
(муцин, лизоцим
Функциональное состояние барьеров может изменяться при:
смене сна и бодрствования
голодании
утомлении
травме
облучении ИК, УФ, рентгеновскими лучами
воздействии УЗ, ультракоротких и высокочастотных волн.
Нарушение барьерной функции слизистой оболочки полости рта и пародонта.
Защита полости рта
1. барьерная функция слизистой оболочки
2. буферные свойства слюны
3. защитная роль ферментов ротовой жидкости
4. механическое смывание с поверхности слизистой патогенов слюной
5. гуморальные и клеточные факторы защиты
6. пародонтальный барьер
Нарушение барьерной функции СОПР и пародонта наблюдается при:
механической травме
химической травме
термической травме
лучевой травме
заболеваниях СОПР, гальванозе
действии лекарственных веществ
действии ядов, токсинов
Гематосаливарный барьер, его нарушения.
Особенности строения гематосаливарного барьера:
@стенка кровеносных и лимфатических микрососудов
@интерстициальное пространство
@эпителиальные трубки, содержащие кровь, лимфу, межтканевую жидкость, секрет
Факторы, вызывающие нарушения ГГБ
@воздействие БАВ
@нарушение нервно – эндокринной регуляции
@действие лекарственных веществ
@действие ядов, токсинов
@повышение АД на 90 мм. рт. ст и выше
@вдыхание газовой смеси с резко повышенной концентрацией СО2
@облучение
@судороги
@изменение рН
Гистогематические барьеры: их строение, виды, механизмы нарушений.
ГГБ
1-Высокопроницаемые
( печень, костный мозг, кишечник, почки )
2- Малопроницаемые
(гематоэнцефалический, гематоофтальмический, гематотиреоидный)
Строение ГГБ
1. капиллярная стенка
2. перикапиллярный слой
3. барьерные структуры клетки
Особенности строения гематосаливарного барьера:
@стенка кровеносных и лимфатических микрососудов
@интерстициальное пространство
@эпителиальные трубки, содержащие кровь, лимфу, межтканевую жидкость, секрет
Факторы, вызывающие нарушения ГГБ
@воздействие БАВ
@нарушение нервно – эндокринной регуляции
@действие лекарственных веществ
@действие ядов, токсинов
@повышение АД на 90 мм. рт. ст и выше
@вдыхание газовой смеси с резко повышенной концентрацией СО2
@облучение
@судороги
@изменение рН
Этиология острого воспаления.
Острое воспаление.
Воспаление – типовой патологический процесс, заключающийся в преимущественно защитной реакции организма в ответ на повреждение различными болезнетворными факторами.
Основные признаки воспаления:
-покраснение (rubor)
-боль (dolor)
-припухлость (tumor)
-местное повышение температуры (calor)
-нарушение функции (functio laesa)
Этиологические факторы
1. Экзогенные
- физические
- химические
- биологические
2. Эндогенные
- уремические токсины
- ишемические токсины
- продукты нарушенного метаболизма
Первичная и вторичная альтерация ткани при остром воспалении.
Альтерация
-повреждение клеточных элементов в патологическом очаге
- является пусковым механизмом воспаления
бывает первичная (в результате прямого повреждающего действия) и вторичная (в результате дополнительного повреждения клеток продуктами распада и др.)
Динамика изменения микроциркуляции при воспалении (стадии сосудистых реакций).
Стадийные изменения в микроциркуляторном русле:
-кратковременный спазм артериол
-воспалительная артериальная гиперемия
-венозная гиперемия
-престаз и стаз
Экссудация при воспалении и её механизмы. Виды экссудатов.
Стадии воспаления
1. Альтерация
2. Экссудация
3. Пролиферация
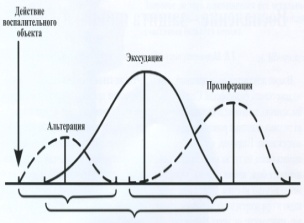
Экссудация
выход жидкой части крови, электролитов, белков и клеток из сосудистого русла в ткани.
Экссудат – жидкость, содержащая белки и форменные элементы крови, скапливающаяся в ткани при воспалении.
Этапы экссудации:
1. повышение проницаемости капилляров для белков крови
2. стадийные изменения в сосудах микроциркуляторного русла
3. эмиграция лейкоцитов
Эмиграция лейкоцитов при воспалении и её значение.
Эмиграция лейкоцитов:
-краевое стояние лейкоцитов
-переход через сосудистую стенку (меж- или трансэндотелиально)
-хемотаксис: перемещение организма по отношению к концентрации химических веществ.
Плазменные и клеточные медиаторы воспаления.
Клетки воспаления:
-макрофаги
-тучные клетки
-нейтрофилы
-эозинофилы
-тромбоциты
-лимфоциты
-фибробласты
Медиаторы воспаления
1. Клеточные
- гистамин
- серотонин/ простагландины/ простациклины
- лейкотриены/ ферменты
2. Плазменные
- кинины
- калликреин
- компоненты комплимента
Фагоцитоз. Стадии, механизмы развития.
1. Хемотаксис. В реакции фагоцитоза более важная роль принадлежит положительному хемотаксису. В качестве хемоаттрактантов выступают продукты выделяемые микроорганизмами и активированными клетками в очаге воспаления (цитокины, лейкотриен В4, гистамин), а также продукты расщепления компонентов комплемента (С3а, С5а), протеолитические фрагменты факторов свертывания крови и фибринолиза (тромбин, фибрин), нейропептиды, фрагменты иммуноглобулинов и др. Однако, «профессиональными» хемотаксинами служат цитокины группы хемокинов.
Ранее других клеток в очаг воспаления мигрируют нейтрофилы, существенно позже поступают макрофаги. Скорость хемотаксического перемещения для нейтрофилов и макрофагов сопоставима, различия во времени поступления, вероятно, связаны с разной скоростью их активации.
2. Адгезия фагоцитов к объекту.
3. Активация мембраны.. Происходит активация протеинкиназы С, выход ионов кальция из внутриклеточных депо. Большое значение играют переходы золь-гель в системе клеточных коллоидов и актино-миозиновые перестройки.
4. Погружение. Происходит обволакивание объекта.
5. Образование фагосомы. Замыкание мембраны, погружение объекта с частью мембраны фагоцита внутрь клетки.
6. Образование фаголизосомы.
7. Киллинг и расщепление. 8. Выброс продуктов деградации.
Фагоцитоз может быть:
завершённым (киллинг и переваривание прошло успешно);
незавершённым (для ряда патогенов фагоцитоз является необходимой ступенью их жизненного цикла, например, у микобактерий и гонококков).
Пролиферация при воспалении.
Пролиферация
размножение клеток и возмещение возникшего ранее дефекта новообразованными клетками.
Одновременно идет процесс активного погашения воспалительного процесса, что проявляется ингибированием ферментов, дезактивацией воспаления, расщеплением и выведением токсических продуктов.
Нарушения обмена веществ в очаге воспаления.
-в первые 2-3 часа интенсивность обмена веществ повышается
-образование большого количества недоокисленных продуктов (полипептиды, ЖК, кетоновые тела)
-уменьшается дыхательный коэффициент
-катаболизм à анаболизм
Влияние воспаления на организм:
-нейтрофильный лейкоцитоз с регенераторным сдвигом
-ускорение СОЭ
-лихорадка
-изменение ферментного состава крови
-компенсированный метаболический ацидоз
-склонность к гиперкоагуляции
-изменение белкового профиля крови
усиление образования белков острой фазы
Особенности воспаления в челюстно-лицевой области
Барьеры воспалительного очага, механизмы их образования и функции, нарушения барьеров воспалительного очага.
Внешними проявлениями венозной гиперемии являются отек ткани, цианоз, снижение обменных процессов и как следствие - снижение температуры в очаге воспаления. Усиление гипоксии и ацидоза стимулирует развитие соединительнотканных элементов по периферии очага воспаления и тем самым обеспечивает формирование барьера, отделяющего воспалительный очаг от здоровой ткани. В образовании барьера принимают участие также нейтрофилы и мононуклеары.
Ограничение кровотока в участке венозной гиперемии и образование барьеров способствуют уменьшению резорбции из очага воспаления продуктов распада, токсических факторов, а также снижают риск распространения инфекционных агентов. Однако при развитии воспаления в паренхиматозных органах длительная венозная гиперемия может привести к снижению их специализированных функций и развитию склерозирования клеток
Взаимоотношения между очагом воспаления и целостным организмом. Значение острого воспаления для организма.
Острое воспаление.
Воспаление – типовой патологический процесс, заключающийся в преимущественно защитной реакции организма в ответ на повреждение различными болезнетворными факторами.
Взаимоотношение между очагом воспаления и целостным организмом
Острая воспалительная реакция оказывает выраженное вли-яние на весь организм. Со стороны обмена веществ наблюдается усиление анаэробных процессов: в связи с чем в крови возрас-тает концентрация недоокисленных продуктов обмена, особенно молочной кислоты - до 15-20 мг%, т.е. в 1,5-2 раза по срав-нению с нормой. Более значительная гиперлактацидемия бывает редко, т.е. образующиеся в зоне воспаления молочная кислота
Динамика раневого процесса.
Динамика раневого процесса
1. Заживление первичным натяжением
а) стадия воспаления
- края раны сближены
- умеренная инфильтрация ткани лейкоцитами
б) стадия пролиферации
- быстрая регенерация эпидермиса
- образование грануляционной ткани
в) стадия созревания рубца
- образование тонкого дермального рубца
Факторы, тормозящие заживление
1. Местные
-инфекция/ишемия/наличие чужеродного материала
-наличие некротической ткани
-подвижность в области раны/ионизирующее облучение
-избыточное давление на раневую поверхность
Факторы, тормозящие заживление
2. Общие
- старость, хронический стресс
- белковая недостаточность
- дефицит витаминов Р, СС и цинка
- избыток кортикостероидов
- тяжелые формы анемии
- кровоточивость
- интоксикация
Основные фазы заживления кожной раны, их нарушения.
Стадии заживления
1. Стадия воспаления
артериальная миопаралитическая гиперемия
венозная гиперемия, отек, стаз
экссудация
через 3 часа – уничтожение патогенных факторов
очищение раны мононуклеарными клетками
выделение БАВ макрофагами, участвующими в регенерации.
2. Стадия пролиферации
формирование грануляционной ткани со 2-3 суток, максимально к 8 -10 дню
на раневую поверхность наползает эпителий
концентрическое стягивание краев раны
размножение эпителиальных клеток вокруг раны
3. Стадия созревания и перестройки рубца
грануляционная ткань замещается коллагеном и превращается в тонкий дермальные рубцы
продолжается рост новых капилляров
после 15 дня исчезают тонкие коллагеновые волокна, образуются толстые пучки коллагена и формируется типичная рубцовая ткань
Этиологические факторы канцерогенеза.
Опухоль – патологическое разрастание тканей, состоящее из качественно измененных клеток со способностью к неограниченному, неконтролируемому росту
Этиологические факторы:
-химические канцерогены
-физические канцерогены
-биологические канцерогены
Факторы риска:
-вредные привычки
-плохие условия труда
-загрязнения окружающей среды
-генетическая предрасположенность
Взаимоотношения опухоли и организма. Раковая кахексия.
Опухоль – патологическое разрастание тканей, состоящее из качественно измененных клеток со способностью к неограниченному, неконтролируемому росту.
Влияние опухоли на организм
1. «ловушка» для питательных веществ
2. источник БАВ, не свойственных нормальному организму и оказывающих токсическое действие
3. раковая кахексия
Кахексия (крайнее истощение организма) – это опасное для жизни осложнение ракового заболевания. При большой потере веса и мышечной массы лечение зачастую становится безуспешным, целесообразными остаются только паллиативные методы. Именно поэтому своевременное предупреждение кахексии очень важно.
По данным Германского Онкологического Общества 40% раковых больных страдают анорексией, 46% - изменением вкусовых ощущений, 60% - чувством переполнения желудка, 40-60% - преждевременной сытостью, 41% - сухостью слизистой рта и почти столько же - тошнотой и рвотой. Все это причины того, что онкологические пациенты едят меньше необходимого и теряют в весе, из-за чего увеличивается риск кахексии. Этот недуг уже давно известен как осложнение раковых заболеваний, он связан со снижением физической работоспособности и плохой переносимостью онкологического лечения, с уменьшением ожидаемой продолжительности жизни.
До 80% раковых пациентов на поздних стадиях могут быть подвержены кахексии
тадии развития опухоли.
Стадии развития опухоли:
1. Инициация
2. Промоция
3. Прогрессия
Свойства опухолевых клеток.
Свойства опухоли:
1. Катаплазия – снижение уровня дифференцировки.
2. Метаплазия – стойкое изменение морфофизиологических свойств клеток (ткани).
3. Дисплазия – нарушения в опухолевом очаге, характерной для данной ткани структуры, её атипия.
Особенности опухолевых клеток
-синтез новых факторов роста
-синтез ферментов, разрушающих компоненты соединительной ткани и сосудов
-значительные изменения цитоскелета
-постоянно пребывают в цикле деления
-нестабильность генетического аппарата
-повышение проницаемости ЦПМ
-когезия
-синтез веществ, которые в норме не образуются в данной ткани
-утрата выработки какого – либо фермента
-активизация синтеза нуклеиновых кислот
-изменение синтеза и метаболизма белков
-аэробный гликолиз
-подавление окисления
-повышенное содержание воды в опухоли
-увеличение отрицательного заряда опухолевых клеток
-утрата прежних функций клеток
-блокирование программы апоптоза
-наличие антигенов, свойственных эмбриональным тканям
-наличие вирусиндуцированных антигенов
-наличие нормальных антигенов, специфичных для данной ткани
Механизмы опухолевой трансформации.
Пути метастазирования
1. Гематогенный
2. Контактный (тканевой)
3. Лимфогенный
Перегревание организма. Причины, стадии, механизмы развития.
Перегревание
повышение температуры сердцевины в результате воздействия на организм высоких температур окружающей среды.
Стадии перегревания
1. компенсация
- уменьшение теплопродукции
- увеличение теплоотдачи
2. декомпенсация
- дегидратация, одышка, судороги
- нарушение деятельности мозга, сердца, почек
- тепловой удар
Охлаждение организма. Причины, стадии, механизмы развития.
Переохлаждение
понижение температуры сердцевины в результате воздействия на организм низких температур окружающей среды.
Стадии переохлаждения
1. компенсация
- увеличение теплопродукции
- уменьшение теплоотдачи
Лихорадка. Этиология.
Лихорадка
типовой патологический процесс, характеризующийся повышением температуры тела вследствие изменения механизмов терморегуляции, вызванного действием пирогенных веществ. Различают инфекционную и неинфекционную лихорадку.
Типы пирогенов:
1. экзопирогены
- бактериальные
- небактериальные
2. эндопирогены
истинные медиаторы лихорадочной реакции. Их образование связано с фагоцитозом бактерий (лейкоциты, макро- и микрофаги)
Патогенез лихорадки. Стадии. Механизмы изменения теплового обмена.
Стадии лихорадки
1. стадия подъема температуры
-уменьшение теплоотдачи
-увеличение теплообразования (сократительный и несократительный термогенез)
Проявления:
-бледность и сухость кожных покровов
-мышечная дрожь
-озноб
2. стадия стояния высокой температуры
характеризуется тепловым балансом.
-относительное увеличение теплоотдачи
-относительное уменьшение теплопродукции
Проявления:
-гиперемия кожных покровов
-кожные покровы горячие на ощупь
-ощущение жара
Изменение функций органов и систем при лихорадке. Значение лихорадочной реакции для организма, принципы пиротерапии.
При лихорадке изменяются функции органов и физиологических систем. Причины: • воздействие на организм первичного пирогенного агента инфекционного или неинфекционного генеза, • колебания (нередко значительные) температуры тела, • влияние регуляторных систем организма, • вовлечение органов в реализацию разнообразных терморегуляторных реакций.
Следовательно, то или иное отклонение функций органов при лихорадочной реакции представляет собой их интегративную реакцию на указанные выше факторы; биологический же «смысл» таких изменений — обеспечение оптимальной жизнедеятельности организма в данных условиях. Однако при лихорадке нередко повреждаются и сами органы.
ПИРОТЕРАПИЯ (от греч. pyr - огонь и терапия) - введение в организм с лечебной целью (при некоторых формах сифилиса, бруцеллезе и др.) агентов, резко повышающих температуру тела: чужеродные белки, вакцины, пирогенал и т. п.
Отёк, основные патогенетические механизмы развития. Патогенетическая классификация.
Отек – типовой патологический процесс, выражающийся в избыточном накоплении жидкости в тканях организма в результате нарушения обмена воды между кровью и тканями.
Факторы патогенеза отека
-положительный водный баланс
-повышение гидростатического давления преимущественно в венозном отделе сосудистого русла
-понижение коллоидно – осмотического давления крови
-повышение коллоидно – осмотического давления в ткани
-повышение проницаемости капиллярных сосудов
-нарушение оттока лимфы
-нарушение нервной и гуморальной регуляции водно – электролитного обмена
Классификация отеков
1. По распространенности
местный (локализованный)
общий (анасарка)
2. По механизму развития
a-механический/b-гипоонкотический/c-мембраногенный/d-лимфогенный/e-гиперосмотический/f-смешанный
Клинические формы отеков
-сердечны/лимфогенные/почечные
-голодные/токсические/неврогенные
аллергические/воспалительные/идиопатические
Патогенетические механизмы развития механических, онкотических и мембраногенных отёков.
Механический отек
Ax vared kon
Причины повышения гидростатического давления:
-сдавление или тромбоз вен
-тромбофлебит
-нарушение клапанного аппарата вен
--сужение венул под влиянием серотонина и других гуморальных факторов
-сердечная недостаточность
Гипоонкотический отек
Причины понижения окотического давления:
-белково – калорийное голодание
-мальадсорбция ( энтерит, панкреатит)
-нарушение синтеза белков в печени (гепатиты, цирроз)
-потеря белка с мочой ( нефрозы, нефриты)
Мембраногенный отек
Повышение проницаемости капиллярной стенки
Vared
Причины повышения проницаемости капилляров:
-действие БАВ (гистамин, кинины, простаглагдины, лейкотриены)
-избыток молочной кислоты, органических кислот цикла Кребса
-действие яда с фосфолипазной и лецитиназной активностью
Патогенез сердечного отёка.
Сердечный отек
-повышение венозного давления
-гипоксия тканей, накопление кислых продуктов и БАВ
-гипоксия печени, снижение синтеза белков крови
-гипоксия почек и включение системы ренин – ангиотензин (АТ) - альдостерон
Нефротический отек
Патогенез почечных отёков.
ax
Ацидоз респираторный, причины, механизмы развития и компенсации.
Респираторный ацидоз
возникает в результате уменьшения выделения из организма СО2 через легкие вследствие нарушения функции легочной ткани, дыхательной мускулатуры и др. или вследствие повышения содержания углекислоты в воздухе.
Причины:
;заболевания легких, ведущие к снижению альвеолярной вентиляции
;угнетение дыхательного центра наркотиками, барбитуратами
;Вдыхание газовых смесей с высоким содержанием СО2
Респираторный ацидоз
Последствия:
-брадикардия
-отеки
-ателектаз легких
-повышение внутричерепного давления
-повышение кислотности мочи
-снижение образования мочи
Механизмы компенсации:
-гемоглобиновый буфер
-усиление реабсорбции Na в почках
Ацидоз метаболический, причины, механизмы развития и компенсации.
развивается в результате увеличения концентрации Н+ выше нормы или уменьшения концентрации НСО3 ниже нормы, что приводит к снижению рН артериальной крови ниже 7,35.
Причины:
-нарушения дыхания
-нарушения метаболизма
Метаболический ацидоз
возникает в результате избыточного образования или поступления в организм органических и неорганических кислот.
Причины:
- глубокая гипоксия
- сахарный диабет
- голодание
- тяжелые поражения почек, печени
- тяжелая лихорадка
- интенсивная физическая работа
- избыточная потеря НСО3- через ЖКТ
Последствия:
- внутриклеточный ацидоз
- повышение проницаемости сосудов
- отеки
- обезвоживание клеток
- усиление диссимиляции HbO2
- уменьшение образования HbO2
- гипоксия
- гипервентиляция
Алкалоз респираторный, причины, механизмы развития и компенсации.
Респираторный алкалоз
Последствия:
-повышение тонуса сосудов головного мозга и сердца
-снижение тонуса периферических сосудов à гипотензия
-обезвоживание организма/-щелочная реакция мочи
Механизмы компенсации:
-снижение возбудимости ДЦ
-снижение реабсорбции гидрокарбонатов в почках
Принципы коррекции нарушений КОС
-нормализация состава буферных систем
-устранение сопутствующих нарушений водно-электролитного обмена
-ликвидация осложнений
-лечение патологических процессов, вызывающих нарушение КОС или поддерживающих их
Кислотно – основное равновесие в полости рта
Регуляция КОС в полости рта осуществляется с помощью:
-слюны
-десневой жидкости
-жевательного аппарата
рН смешанной слюны = 6,8 – 7,7
Факторы, влияющие на рН полости рта:
-пища, вода/- воздух/- профессиональные вредности/- курение
- средства гигиены полости рта
- протезы, пломбы
- лекарственные препараты
Алкалоз метаболический, причины, механизмы развития и компенсации.
Метаболический алкалоз
Причины:
-избыточное поступление солей щелочных металлов
-избыточная потеря кислот
-рвота
-повышение секреции или избыточное введение в организм минералокортикоидов
Последствия:
-гиповентиляция легких
-недостаточность кислородного снабжения тканей
-снижение артериовенозной разницы по О2 à гипоксия мозга
Механизмы компенсации:
-снижение возбудимости дыхательного центра
-выведение избытка гидрокарбонатов почками
Респираторный алкалоз
Причины:
-вдыхание разреженного воздуха при подъеме на высоту
-поражения мозга, сопровождающиеся возбуждением дыхательного центра
-чрезмерная ИВЛ с помощью аппарата
Гипоксия. Основные типы, причины и механизмы развития.
Гипоксия.: типовой патологический процесс, возникающий в результате нарушения доставки кислорода к тканям или его утилизации тканевыми дыхательными системами, что приводит к снижению их энергообеспечения
Классификация гипоксии
1. По распространенности
-местная (локальная)
-общая (генерализованная)
2. По скорости развития
-молниеносная
-острая
-подострая
-хроническая
3. По степени тяжести
-легкая
-умеренная
-тяжелая
-критическая (смертельная)
4. По механизму развития
а) экзогенная
- гипобарическая
- нормобарическая
б) эндогенная
- дыхательная (респираторная)
- сердечно - сосудистая (циркуляторная)
- кровяная (гемическая)
- тканевая (гистотоксическая)
- гипоксия нагрузки
- субстрактная
- смешанная
Стадии гипоксии
1. Стадия компенсации
а) кратковременная срочная компенсация
б) долговременная компенсация
2. Начальная стадия декомпенсации
3. Стадия выраженной декомпенсации
4. Терминальная стадия
Стадия компенсации
1. Кратковременная срочная компенсация
-развивается немедленно при действии гипоксического фактора
-обеспечивается за счет мобилизации резервных возможностей систем кислородо – обеспечения
Компенсаторно – приспособительные реакции:
-увеличение легочной вентиляции
-усиление кровообращения
-повышение количества эритроцитов и гемоглобина
-изменение кривой диссоциации оксигемоглобина
2. Долговременная компенсация
-развивается при продолжительной умеренной или повторяющейся гипоксии
-обеспечивается за счет развития гипертрофии и гиперплазии в системах кислородо – обеспечения
Защитно-приспособительные реакции при гипоксии.
Компенсаторно – приспособительные реакции:
-увеличение легочной вентиляции
-усиление кровообращения
-повышение количества эритроцитов и гемоглобина
-изменение кривой диссоциации оксигемоглобина
51- Ацидоз полости рта
определяется наличием легкоферментируемых углеводов и микрофлоры.
Критический уровень рН = 6,2 – 6,0
Алкалоз полости рта
развивается при избытке мочевины. В ротовую жидкость мочевина поступает с пищей, секретами, десневой жидкостью.
52- Гипоксия в стоматологии
В стоматологии возможно развитие дыхательной гипоксии вплоть до асфиксии и местной циркуляторной гипоксии.
Причины дыхательной гипоксии:
- острый отек гортани
- аспирация протезов
- аспирация слепочных масс
ЧАСТНАЯ ПАТОФИЗИОЛОГИЯ.
59. Эритрон, типовые формы его нарушения. Патогенетическая классификация анемий. Изменение основных гематологичсеких показателей при различных анемиях.
Эритрон – вся совокупность клеток красной крови, включая созревающие в костном мозге и гибнущие в ретикулоэндотелиальной системе.
Патологии красной крови – количественные и качественные изменения эритроцитов – виды дегенеративных форм эритроцитов
-пойкилоцитоз – изменение формы эритроцитов
-анизохромия эритроцитов– изменение окраски
-анизоцитоз – изменение размеров (микро-, макро- и мегалоциты) эритроцитов.
Полицитемия – увеличение количества эритроцитов и гемоглобина в единице объема крови. Они делятся на: Эритемии и Эритроцитозы (истинные и ложные).
Эритроцитозы истинные – реактивное увеличение количества эритроцитов в единице объема крови и увеличение массы эритрона. Компенсаторная стимуляция эритропоэза про гипоксии организма. содержание ретикулоцитов в крови повышается.
Ложные эритроцитозы – увеличение количества эритроцитов в единице объема крови без увеличения массы эритрона. Стимуляции кроветворения нет. Содержание ретикулоцитов в крови не изменяется.
Анемии.
Клинико-патогенетическая классификация анемий.
Классификация основана на делении анемий в зависимости от того на каком этапе развития и жизнедеятельности клеток красного ротка возникает нарушение. Нарушения могут происходить на этапе деления и дифференцировке в костном мозге, на этапе циркуляции эритроцитов в периферической крови и на этапе гибели в ретикулоэндотелиальной сети.
анемии вследствие нарушенного кровообразования (гемопоэза).
нарушение на ранних стадиях кроветворения: гипо- и апластические анемии
нарушение на средних стадиях кроветворения: В12- и фолиеводефицитные анемии
нарушение на поздних стадиях кроветворения а) железодефицитные б) сидеробластные анемии
2) анемии вследствие кровопотери
2.1. острая
2.3. хроническая
3) анемии вследствие повышенного разрушения эритроцитов
3.1. приобретенные
3.2. врожденные
60-Острая постгеморрагическая анемия. Стадии, механизмы развития, гематологические изменения.: В патогенезе ОПА выделяют 3 периода.
1) рефлекторно-сосудитый период – развивается сразу после кровопотери. Выраженная гиповолемия, значительное уменьшение кислородной емкости крови. На гиповолемию реагируют хеморецепторы и валюморецепторы. Активируется симпатоадреналовая система. Увеличивается выделение медиаторов – адреналина и норадреналина они повышают тонус емкостных сосудов, резистивных сосудов. Происходит редепонация крови (кровь из депо – печень и подкожная клетчатка, поступает в общий кровоток). Это приводит к тахикардии, гипертонии, повышению минутного объема крови. Кроме того активируется внешнее дыхание, следовательно организм поглощает больше кислорода. Эта стадия гематологически не выявляется т.к. она протекает очень быстро.
2) гидремический. 1-3 сутки. Жажда. Повышение потребности воды. В почках вследствие гипоксии после кровопотери, активируется ренин-агниотензин-альдостероновой системы. Альдостерон синтезируется в надпочечниках и вызывает реабсорбцию натрия в дистальных отделах почечных канальцев. Возникает гиперосмия. На гиперосмию реагируют осморецепторы гипоталамуса. В гипоталамусе активируется синтез вазопрессина. Он вызывает реабсорбцию воды в дистальных отделах почечных канальцев. Вызывает повышение проницаемости сосудов и межтканевая жидкость поступает в кровь. Происходит восстановление циркулирующей плазмы. Эта стадия диагносцируется по гематокриту (происходит снижение гематокрита)
3) регенераторный период проявляется на 5-7 сутки. Гипоксия тканей, выделение эритропоэтина. Стимуляция функциональной активности эритроидного ростка костного мозга, нормализация кислородной емкости крови и тканевого дыхания.
В почках гипоксия, происходит активация в юкста-гломерулярном аппарате эритропотина. Они повышают функциональную активность эритроидного ростка костного мозга. Эритроцитов образуется больше, кислородная емкость крови становится больше и тканевое дыхание увеличивается.
Гематологическая картина. В 3ю стадию. Ретикулоцитарный криз. Появление в периферической крови регенераторных клеток нормобластов и эритробластов.
Полностью восстанавливается кровь на 30-35 сутки посте кровопотери.
Гипо и апластические анемии. Причины, патогенез, гематологичсекие изменения.
Анемии вследствие нарушенного кровообращения
гипо- и апластические анемии. Виды:
наследственные. Генетически детерминированное нарушение деления и созревания эритроидных клеток.
приобретенные. Прямое повреждающее воздействие на костный мозг (стволовые клетки), цитотоксических химических соединений и лекарственных препаратов, ионизирующего излучения, ингибиторов клеточного деления, при метастазировании злокачественной опухоли в костный мозг, аутоантител.
механизм развития
дозозависимая гибель стволовых клеток в костном мозге. Уменьшение массы кроветворной ткани при сохранении нормального созревании. Возможно замещение кроветворной ткани жировой тканью.
Следствие – развитие гипоксии, инфекционно-токсические нарушения и геморрагический синдром.
Проявления в полости рта. Глосалгия (нарушение эпителиального покрова языка), кровоизлияния в слизистые, кровоточивость при повреждениях.
жлезодефицитная и железорефрактерная анемии. Причины, патогенез, гематологические изменения.
Развивается при:
Дефиците железа в пище – алиментарная форма
Гипоцидном гастрите – гастрогенная форма
Снижение всасывания железа в тонком кишечнике – энтрогенная форма
Нарушение синтеза транспортного белка для железа при патологии печени
Потере железа при хронических кровопотерях
Повышенной потребности в железе
Уменьшение содержания железа в организме приводит:
К снижению гемоглабинизации эритроцитов
Угнетению активности железосодержащих ферментов: дыхательных и антиоксидантных
Дистрофически-дегенеративным изменениям в тканях – сухость и зуд кожи, выпадение волос, ломкость ногтей и изменение и формы, снижение иммунитета.
Проявление в полости рта:
Атрофии сосочков языка, глоссит, изменение вкусовой чувствительности, ангулярный стоматит, слизистая оболочка бледная, чаще сухая. Отпечатков зубов по линии их смыкания на щеках вследствие отека тканей и изменения их тургора.
Гематологическая картина. Выражена гипохромия (ЦП снижен до 0.5-0.6). в мазках периферической крови встречаются кольцевидные эритроциты с расширенной зоной просветления в центре из-за малого количества гемоглобина, выражена анизохромия. На фоне выраженного пойкилоцитоза и анизоцитоза преобладают микроциты, ретикулоцитов обычно меньше. В крови снижено содержание сывороточного железа.
В-12-фолиеводефицитная анемия. Причины, патогенез, гематологические изменения. Причиной заболевания могут быть
-недостаточное поступление витамина И12 (внешний фактор Кастла) и фолиевой кислоты у строгих вегетарианцев
-дефицит гастромукопротеида
-нарушение всасывания витамина В12 при хронических поражениях кишечника
-потребление витамина В12 паразитами ЖКТ
-недостаточный синтез в печени при ее тяжелых поражениях транспортного белка
Дефицит В12.
Нарушение превращения фолиевой кислоты в ее коферментную форму – тетрагидрофолиевую кислоту. Уменьшение синтеза тимидинфосфата
Синтез ДНК нарушается, ДНК находится в ядре поэтому деление и созревание клеток нарушается, отсюда кроветворение переходит на мегалобластический тип. Поэтому появляются клетки мегалобласты, мегалоциты, тельца Жолли. Синтез РНК и гемоглабинизация в цитоплазме не нарушена. Поэтому цитоплазма созревает очень рано. Поэтому цветовой показатель больше единицы.
Кроме того дефицит В12 приводит к нарушению пролиферации витальных клеток ЖКТ. Со стороны нервной ткани отмечается нарушение процессов меринизации аксонов, отсюда появляется боль и нарушается чувствительность. В слизистых оболочках (полости рта) отмечаются стоматиты.
Проявлении в полости рта
Слизистая оболочка полости рта бледная, отмечается лакированный язык вследствие атрофии нитевидных и грибовидных сосочках. Точечные кровоизлияния под слизистой. Появляются полосы ярко-красного цвета (глоссит Гюнтера).
Железодефицитная анемия.
Развивается при:
Дефиците железа в пище – алиментарная форма
Гипоцидном гастрите – гастрогенная форма
Снижение всасывания железа в тонком кишечнике – энтрогенная форма
Нарушение синтеза транспортного белка для железа при патологии печени
Потере железа при хронических кровопотерях
Повышенной потребности в железе
Уменьшение содержания железа в организме приводит:
К снижению гемоглабинизации эритроцитов
Угнетению активности железосодержащих ферментов: дыхательных и антиоксидантных
Дистрофически-дегенеративным изменениям в тканях – сухость и зуд кожи, выпадение волос, ломкость ногтей и изменение и формы, снижение иммунитета.
Проявление в полости рта:
Атрофии сосочков языка, глоссит, изменение вкусовой чувствительности, ангулярный стоматит, слизистая оболочка бледная, чаще сухая. Отпечатков зубов по линии их смыкания на щеках вследствие отека тканей и изменения их тургора.
Гематологическая картина. Выражена гипохромия (ЦП снижен до 0.5-0.6). в мазках периферической крови встречаются кольцевидные эритроциты с расширенной зоной просветления в центре из-за малого количества гемоглобина, выражена анизохромия. На фоне выраженного пойкилоцитоза и анизоцитоза преобладают микроциты, ретикулоцитов обычно меньше. В крови снижено содержание сывороточного железа.
Приобретенные гемолитические анемии. Причины, гематологические изменения.
Наследственные гемолитические анемии. Виды, причины, патогенез, гематологические изменения. Гемолитические анемии.
Врожденные:
1-Гемоглобинопатии,2- ферментопатии, 3-мембранопатии
Приобретенные.: 1-Иммунные, 2-неимунные.
Врожденные гемолитическии анемии. Внесосудистый гемолиз.
Приобретенные гемолитическии анемии. Внутрисосудистый гемолиз, гемоглобинемии, гемоглобинурия, повреждение мембран клубочков почек продуктами распада эритроцитов, развитие уремии
Повышение в крови общего билирубина за счет непрямого билирубина.
Мембранопатии. Возникает при наследственном дефиците белка спектрина и анкирина которые должны соединиться с белками мембраны. Поэтому мембрана становится проницаемой. В клетку поступает натрий, за ним поступает кальций, вода, эритроцит теряет дисковидную форму. Он приобретает вид сфероцита (в виде шара).
Ферментопатии (энзимопатии)
Связаны с дефицитом фермента глюкозо-6-фосфатдегидрогеназы. Он участвует в образовании глютатиона. Поэтому нарушается его восстановление и нарушается антиоксидантная защита. Так же этот фермент участвует в биохимическом обмене эритроцитов.
Гемоглобинопатии
К ней относится серповидно-клеточная анемия. В бета-цепи глобина аминокислота замещается на нейтральный Валин. Образуется патологическая форма гемоглобина (s гемоглобин). Он склонен к кристаллизации, выпадает в осадок и эритроцит принимает вид серпа.
Талассемия. Нарушается синтез альфа или бета цепей гемоглобина. Это будет альфа или бета талассемия. Нарушается последовательность аминокислот в молекуле Hb. Образуется патологические формы гемоглобина. Они выпадают в осадок, и эритроцит становится мишеневидной формы.
Проявлении в полости рта:
Повышенная кровоточивость десен при их травмировании, спонтанная кровоточивость, светло-серая окраска слизистой оболочки полости рта. Гингивит. Язвы.
Причины гемолотических анемий.:
Неимунные.
1-Физические – длительная высокая температура, искусственные клапаны сердца, длительная физическая нагрузка.
2-Химические. Гемолитические яды – соединения свинца, фофсора)
3-Биологические – гемолитичские яды (грибной, змеиный, пчелиный), микробные токсины (стрептококк, анаэробные микробы и т.п.)
Иммунные. Гемолитическая болезнь новорожденных (резус конфликт матери и ребенка)
Гетероимунные – при переливании несовместимой группы крови
Аутоиммунные – лекарственные препараты.
Лейкоцитозы, их виды и механизмы развития. Сдвиги лейкоцитарной формулы, их диагностическое значение.
Лейкоцитозы. Это увеличение количества лейкоцитов в единице объема периферической крови. Лейкоцитозы подразделяются на 1-физиологические и 2-патологические (ложные и истинные).
По механизму развития
ложный это – общее количество лейкоцитов в организме не изменяется, но повышается в единице объема крови (выбросе лейкоцитов из депо, переход из пристеночного состояние в циркулярное).
Истинный – увеличение лейкона (общее количество молодых, циркулирующих и погибающих лейкоцитов) и увеличение лейкоцитов в единице объема крови, сопровождается появлением молодых форм – юных, палочкоядерных и т.д
Лейкоцитозы подразделяются по значимости для организма.
∙Физиологический лейкоцитоз. По механизму развития ложный, скоропроходящий (может быть при беременности, при физической нагрузке, при психическом возбуждении, в предменструальный период)
∙Реактивный. По механизму развития – истинный. Усиливает механизмы неспецифической и специфической защиты организма, обратим
∙Патологический. По механизму развития истинный.
Безудержное бесконтрольное размножение малодифференцированных клеток белого ростка при лейкозах (опухоль кроветворной ткани)
Нейтрофильный лейкоцитоз возникает при:
-острые асептические и септические воспаления, вызванные бактериальной инфекцией (ангина, пневмонии, аппендицит, пиелонефрит, менингит и т.д.), интоксикации, шоки, кровотечения.
Обеспечивает усиление неспецифической и специфической резистентности организма. Отсутствие на фоне острой бактериальной инфекции нейтрофильного лейкоцитоза указывает либо на легкую форму заболевания, либо на снижение реактивности и резистентности организма.
Эозинофильный лейкоцитоз бывает при:
-аллергические реакции, гельминтонизм, детские инфекции, прием ряда лекарственных препаратов, хронические поражения кожи, опухоли.
Моноцитарный лейкоцитоз бывает при
- подострые и хронические инфекции (туберкулез, сифилис, бруцеллез), острые инфекции, лимфогранулематоз.
Лимфоцитарный лейкоцитоз бывает при
-хронический лимфолейкоз, хроническая лучевая болезнь, бронхиальная астма, тиреотоксикоз, после спленэктомии, прием наркотиков, острые вирусные (коклюш, корь, ветрянка), хронические бактериальные заболевания (туберкулез, сифилис, бруцеллез) и протозойные инфекции (токсоплазмоз).
Базофильный лейкоцитоз бывает при-
Встречается редко, в сочетании с эозинофилией может быть признаком миелопролиферативного процесса.
Лейкопении. Их виды и механизмы развития. Агранулоцитозы.
Лейкопении. Бывают ложные и истинные.
Ложные лейкопении – масса лейкона не уменьшается, но большая часть лейкоцитов находится в пристеночном пуле лейкоцитов и в тканевом депо. В результате при определении количества лейкоцитов в единице объема крови меньше нормы.
Возникает при шоке, ознобе, коллапсе, различных невротически реакциях, под влиянием ваготропных веществ.
Истинные лейкопении – подавление костномозговой продукции лейкоцитов, либо повышение их разрушения. Масса лейкона уменьшается, сдвиг лейкоцитарной формулы вправо.
Возникают при воздействии химических веществ, лекарственных препаратов, радиации. При метаплазии костного рака, при наследственной и врожденной патологии выработки лейкоцитов, при дефиците железа, витамина В12 и фолиевой кислоты. При инфекционных заболеваниях, при ряде эндокринных заболеваний.
Лейкопении могут быть при следующих патологических процессах
Нейтропения – при острой лучевой болезни, вирусных заболеваниях, бактериальных инфекциях, малярия, при применении лекарственных препаратов, при аутоиммунной патологии.
Эозинопения – на фоне стрессов, глюкокортикоидной терапии, ответа острой фазы,миелотоксического агранулоцитоз, злокачественных опухолей, при болезни и синдроме Иценко-Кушинга, некоторых вирусных заболеваниях
Моноцитопения – при повреждении костного мозга, на фоне разгара острого инфекционного заболевания, обострении туберкулезного процесса, ревмокардите.
Лимфоцитопения – при избытке в организме глюкокортикоидов, при лучевой болезни и лучевой терапии, при лимфомах, многих хронических заболеваниях (системная красная волчанка, застойная сердечная недостаточность, туберкулез), СПИДе.
В зависимости от причины вызвавшей лейкопению:
- инфекционно-токсические, радиационные, дефицитные, врожденная наследственная
Агранулоцитоз – лейкопения, резкое снижение колчества зернистых лейкоцитов, вплоть до полного исчезновения, ложный лимфоцитоз.
Может развиться при действии инфекционных агентов, токсических и лекарственных веществ и препаратов, ионизирующей терапии. В полости рта – инфекционный процесс сопровождающийся вялотекущим воспалением без нагноения с преобладанием некроза. Язвенно-некротические ангины, стоматиты, хейлиты
Нейтрофильный, базофильный и эзинофильный лейкоцитозы. Механизмы их развития, значение.
Гемобластозы. Классификация, этиология и патогенез.
опухоли, развивающиеся из кроветворных клеток и их производных
Классификация
Лейкемии (лейкозы): (системными гемобластозами) называют гемобластозы, при которых опухолевые клетки образуются в ткани красного костного мозга, в последующем мигрируют в периферическую кровь, с током которой распространяются в различные органы.
Классификация
Лейкемии классифицируют следующим образом:
