
- •1.Дать определение науки экологии
- •3.Из каких компонентов состоят экосистемы?
- •9. Какие теории возникновения жизни на Земле Вы знаете? Что такое хиральная чистота биосферы?
- •11.Нарисуйте и объясните вид зависимости температуры от расстояния до поверхности океана.
- •12.Как изменяется состав компонентов атмосферы с высотой.
- •13.Как меняется содержание озона в атмосфере с изменением:высоты над уровнем моря,географическойшироты,времени года?
- •14.Можно ли сравнитъконц-ю озона в атмосфере,выраженную в единицах Добсона(е.Д) и в ррm?
- •15.Что такое «нулевой»цикл озона?
- •17. Что такое озоновой слой и какие “дыры” в нем могут образоваться?
- •18. Как меняются основные пути стока и время жизни фторхлоруглеводородов в зависимости от их состава?
- •19. Почему свободные радикалы, озон и другие окислители, концентрация которых значительно ниже, чем у кислорода, играют основную роль в процессах окисления примесей в атмосферном воздухе?
- •20. Какие причины приводят к возникновению температурных инверсий в тропосфере?
- •21.Как связаны значения температурного градиента в тропосфере с устойчивостью атмосферы?
- •22. Дайте характеристику природных и антропогенных источников поступления соединений серы в атмосферу.
- •23. Каковы особенности процесса глобального переноса соединений серы?
- •24. Охарактеризуйте источники, масштабы поступления и пути стока соединений азота в его атмосферном цикле.
- •25.Каковы особенности поведения гемиоксида азота (n2o) в атмосфере?
- •26. Назовите основные источники и оцените масштабы поступления органических соединений в атмосферу.
- •27. Приведите схему основных направлений процесса фотохимического окисления метана и его гомологов (брутто уравнения).
- •28. Какие виды смога Вы знаете? Назовите сходства и различия условий образования смога в Лондоне и Лос-Анджелесе.
- •29. Какие процессы могут протекать при окислении выхлопных газов автомобилей в атмосферном воздухе? Что такое пан? Как он образуется?
- •30. Что такое “парниковый эффект”?
- •31. Какие газы вносят заметный вклад в “парниковый эффект”?
- •32. Какие международные соглашения направлены на ограничение поступления парниковых газов в атмосферу?
- •34. Что такое “ядерная ночь” или “ядерная зима”?
- •35. Пдк для воздушной среды. В чем их сходство и различие?
- •36.Какие виды пдк для водоемов Вам известны?
- •37. Является ли пдк константой, почему? Что такое вдк зачем появилось это понятие?
- •38. В каких единицах измеряется пдк? Как определяют пдк?
- •39.Что такое вдк и как его определяют?
- •40. Как по строению органического соединения можно предсказать его относительную токсичность?
- •41. Основные понятия промышленной безопасности: риск, индивидуальный риск, социальный риск, экологический риск.
- •42. Способы классификации риска.
- •43. Приемлемый и пренебрежимый уровень риска.
- •44. Что такое добровольный риск?
- •45. Способы оценки ущерба наносимого окружающей среде.
- •10.Как меняется спектр солнечного излучения при прохождении через атмосферу Земли? Почему происходят изменения спектра?
22. Дайте характеристику природных и антропогенных источников поступления соединений серы в атмосферу.
Основные поступления неорганических соединений серы в тропосферу связаны с антропогенными источниками. На их долю приходится примерно 65% всех поступлений. Почти 95% этого количества составляет диоксид серы. Из природных источников поступления соед-й серы следует выделить волновую деятельность в океанах, приводящую к образованию аэрозолей. Общее количество серы, содержащейся в аэрозолях в виде сульфатов магния и кальция, оценивается в 44 млн т в год, что составляет примерно 30% всех поступлений в атмосферу. Биологические источники серы выделяют преимущественно сероводород (23-49% всех поступлений).
23. Каковы особенности процесса глобального переноса соединений серы?
Происходят процессы окисления соед-й серы. Основные окислители – свободные радикалы. H2S окисляется до SO2, который в ходе газофазных реакциях окис-ся до SO3. Серный ангидрид легко взаимод-ет с частицами атмосферной влаги, образую растворы серной кислоты, которые, реагируя с аммиаком или ионами металлов, частично переходят в соответствующие сульфаты (в основном, сульфаты аммония, натрия, кальция). Сульфаты также образуются на пов-титв. частиц Ме. Также возможна абсорбция SO2 влагой. Оксиды Fe, Cr резко ускоряют процессы окисления. Помимо хим. трансформации, возможен сток путем мокрого (с осадками) и сухого (контакт с почвами и растительностью) осаждения.
24. Охарактеризуйте источники, масштабы поступления и пути стока соединений азота в его атмосферном цикле.
С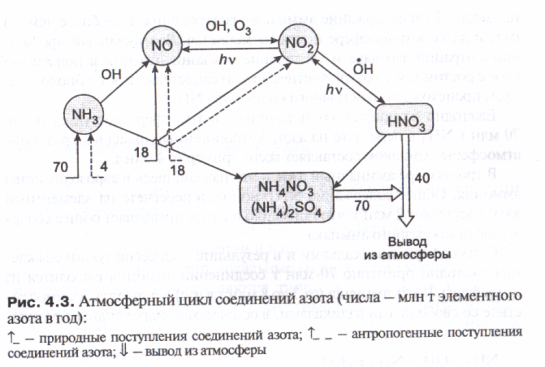 оед-я
азота в тропосфере – это, в основном,
оксиды азота, аммиак и соли аммония,
азотная кислота и нитраты. Среди оксидов
стоит выделить гемиоксид (N2O), оксид
(NO), и диоксид. Другие (NO3, N2O3, N2O4, N2O5) в
условиях тропосферы неустойчивы.
оед-я
азота в тропосфере – это, в основном,
оксиды азота, аммиак и соли аммония,
азотная кислота и нитраты. Среди оксидов
стоит выделить гемиоксид (N2O), оксид
(NO), и диоксид. Другие (NO3, N2O3, N2O4, N2O5) в
условиях тропосферы неустойчивы.
Основные природные источники оксидов (процессы денитрификации, окисление N2O и NH3, физич. фиксация азота) ежегодно дают 21-89 млн т оксидов в тропосферу.
Антропогенные выбросы (сжигание топлива на ТЭЦ и в автомобилях): ок. 20 млн т оксидов.
Загрязнение аммиаком: природные – 70 млн т, антропогенные – 4 млн т.
Сток с химич. превращениями: NH3 частично оксил-ся до NO. NO, взаимод-я с радикалами и озоном, переходит в NO2 (сущ. обратный переход). NO2 при взаимод-и с радикалами обр-ет кислоту (обратимыйпр-с). Основное кол-во кислоты выводится с осадками. Соединения аммиака выводятся с атм. осадками и в рез-те сухого осаждения (ок. 70 млн т).
25.Каковы особенности поведения гемиоксида азота (n2o) в атмосфере?
Общее количество гемиоксида азота, поступающего в атмосферу в основном в резкльтате протекания процессов денитрификации в почве, равно примерно 100 млн т в год. Общее количество N2O в атмосфере оценивается в 2000 млн т, т.о., среднее время пребывания молекул N2O в атм-ре составляет 20 лет. Основные процессы вывода N2O из атм-ры:
-фотодиссоциация: N2O + hv = N2 + O (λ≤250нм)
-взаимодействие с синглетновозбужд. ат. кислорода: N2O + O(1D) = N2 + O2
или: N2O + O(1D) = 2NO.
Поскольку в тропосфере конц-я O(1D) является низкой и нет излучения с λ≤250нм, молекулы N2O облад. большим временем жизни и могут переместиться в стратосферу, где скорость процессов разрушения N2O резко возрастает. Поэтому конц-я N2O на высоте 35 км в 10 раз меньше, чем в тропосфере.
