
- •I.4. Диены
- •I.4.1. Диены с кумулированными двойными связями
- •I.4.2. Диены с сопряженными двойными связями
- •I.4.3. Диены с изолированными двойными связями
- •I.4.4. Некоторые сведения о перициклических реакциях.
- •I.4.5. Природные диены и полиены.
- •I.5. Алкины
- •I.5.1. Получение алкинов.
- •I.5.2.1. Реакции с разрывом тройной связи
- •I.5.2.2. Реакции с сохранением тройной связи.
- •I.6. Арены
- •I.6.1. Основные типы ароматических структур
- •I.6.2. Арены, содержащие бензольные циклы.
- •Свойства аренов
- •Химические свойства аренов
I.6. Арены
Арены (ароматические углеводороды) – простейший класс, входящий в состав большой группы органических соединений, которые называют ароматическими. Это специфическое название появилось потому, что некоторые из первоначально полученных соединений этой группы (ванилин, коричный альдегид и др.) имели сильный приятный запах. Название это закрепилось в литературе, однако сейчас оно имеет иной смысл.
Ароматические соединения – циклические непредельные органические соединения, обладающие особым комплексом свойств – ароматическими свойствами (ароматичностью). Наиболее известный пример – бензол. Понятие «ароматические свойства» никак не связано с запахом; наиболее важные из этих свойств перечислены ниже.
 1.
Ароматические соединения имеют повышенную
устойчивость
(термодинамическую стабильность) по
сравнению с аналогичными неароматическими
соединениями. Это можно наглядно
продемонстрировать на примере сравнения
теплот гидрирования бензола и циклогексена:
1.
Ароматические соединения имеют повышенную
устойчивость
(термодинамическую стабильность) по
сравнению с аналогичными неароматическими
соединениями. Это можно наглядно
продемонстрировать на примере сравнения
теплот гидрирования бензола и циклогексена:
Как уже упоминалось, теплоты гидрирования могут служить мерой устойчивости непредельных соединений (стр. 78): чем устойчивее соединение, тем ниже теплота гидрирования. Теплота гидрирования двойной связи циклогексена составляет 119 кДж/моль; теплота гидрирования бензола составляет 206 кДж/моль; это на 151 кДж/моль меньше, чем суммарная теплота гидрирования трех двойных связей. Таким образом, энергия стабилизации бензола составляет весьма значительную величину.
2. Характерной особенностью химического поведения ароматических соединений является то, что несмотря на высокую формальную ненасыщенность, эти соединения имеют пониженную склонность к реакциям присоединения; для многих из них (прежде всего для бензола и его производных) более характерными являются реакции замещения.
3. Ароматические соединения имеют характерные особенности физических свойств; это находит отражение в электронных и инфракрасных спектрах, но особенно заметно – в спектрах ядерного магнитного резонанса. В ароматических системах при внесении их в магнитное поле возникают кольцевые токи, что весьма сильно сказывается на химических сдвигах протонов в спектрах ПМР и на ряде других характеристик спектров ЯМР (подробно это будет рассмотрено в курсе физ. методов); это используется для обнаружения ароматических структур.
Для разных типов ароматических соединений перечисленные особенности выражены в различной степени – иногда весьма четко, иногда не очень заметно; в наибольшей степени комплекс ароматических свойств проявляется для соединений, содержащих бензольные кольца и, в первую очередь, – для бензола и его производных.
Основная причина появления ароматических свойств – делокализация π-электронной плотности по всей циклической системе молекулы ароматического соединения. Ранее уже неоднократно подчеркивалось, что делокализация электронной плотности приводит к выигрышу в энергии (стабилизации молекулы). В ароматических соединениях имеется полное сопряжение в циклической системе, поэтому делокализация здесь более полная, чем в ациклических сопряженных системах, а следовательно и стабилизация здесь более значительная. В наибольшей степени такая делокализация выражена для производных бензола; для самого бензола наблюдается полная делокализация:
 Молекулу
бензола можно представить в виде
резонансного гибрида (184) двух идентичных
канонических структур (182) и (183) (формул
Кекуле). Естественно, в такой структуре
все связи, образующие цикл, идентичны
и являются как бы промежуточными между
ординарной и двойной связями. Длина
данных связей составляет 0,140 нм, в то
время как длина ординарной связи (в
этане) равна 0,154 нм, а длина связи С=С (в
этилене) – 0,133нм. Соответственно все 6
атомов углерода идентичны, равно как и
6 атомов водорода. Для изображения
бензольного кольца часто используют
формулу (185) со вписанной окружностью;
при дальнейшем изложении мы будем однако
использовать формулы Кекуле (182) или
(183), поскольку они позволяют более
наглядно объяснять химическое поведение
бензола и его производных; будем, однако,
помнить, что формулы Кекуле – абстрактные
канонические структуры, а истинное
строение бензола более адекватно
отражается формулами (184) и (185).
Молекулу
бензола можно представить в виде
резонансного гибрида (184) двух идентичных
канонических структур (182) и (183) (формул
Кекуле). Естественно, в такой структуре
все связи, образующие цикл, идентичны
и являются как бы промежуточными между
ординарной и двойной связями. Длина
данных связей составляет 0,140 нм, в то
время как длина ординарной связи (в
этане) равна 0,154 нм, а длина связи С=С (в
этилене) – 0,133нм. Соответственно все 6
атомов углерода идентичны, равно как и
6 атомов водорода. Для изображения
бензольного кольца часто используют
формулу (185) со вписанной окружностью;
при дальнейшем изложении мы будем однако
использовать формулы Кекуле (182) или
(183), поскольку они позволяют более
наглядно объяснять химическое поведение
бензола и его производных; будем, однако,
помнить, что формулы Кекуле – абстрактные
канонические структуры, а истинное
строение бензола более адекватно
отражается формулами (184) и (185).
Полная делокализация π-электронной плотности в молекуле бензола представлена структурой 186: электронная плотность распределена симметрично выше и ниже кольца в виде двух торов.
Кроме бензола, можно представить себе множество циклических систем (карбо- и гетероциклических), в которых имеется возможность циклического сопряжения π- и р-электронов. Однако не все такие соединения проявляют ароматические свойства. Критерием здесь является правило Хюккеля:
Ароматические свойства проявляют плоские моноциклические сопряженные системы, содержащие 4n+2 π-электронов (где n=0,1,2…).
[система должна быть плоской, потому что только при этом условии происходит делокализация электронной плотности].
Таким образом, необходимое число π-электронов в ароматической системе – 2, 6, 10 и т.д. Бензол удовлетворяет правилу Хюккеля для n=1. Циклобутадиен, не удовлетворяющий правилу Хюккеля (содержит четыре π-электрона), не проявляет ароматических свойств; более
того, он имеет пониженную устойчивость, и причиной дестабилизации является именно делокализация электронной плотности. Такое на первый взгляд парадоксальное явление называется антиароматичностью.
 Правило
Хюккеля, ароматичность и антиароматичность
можно объяснить исходя из теории
молекулярных орбиталей.
Правило
Хюккеля, ароматичность и антиароматичность
можно объяснить исходя из теории
молекулярных орбиталей.
В «хюккелевских» системах все π-электроны находятся на связывающих орбиталях. Часть связывающих орбиталей вырождена (имеет одинаковую энергию); это дополнительно стабилизирует молекулу. В частности, в бензоле шесть π-электронов расположены на трех связывающих орбиталях, причем две верхних орбитали (ψ2 и ψ3) вырождены.
В «анти-хюккелевском» циклобутадиене картина иная: в нем имеется только одна связывающая орбиталь, на которой, естественно, могут поместиться только два π-электрона; остальные два находятся на двух несвязывающих орбиталях – по одному на каждой (в соответствии с правилом Гунда на несвязывающих орбиталях располагается по одному электрону); спины этих электронов параллельны. Таким образом, циклобутадиен представляет собой бирадикал, т.е. неустойчивую структуру.
Сказанное выше можно наглядно проиллюстрировать, используя специальную диаграмму - так называемый «круг Фроста». Для этого «подозреваемую на ароматичность» систему в виде правильного многоугольника вписывают в окружность так, чтобы одна из вершин многоугольника находилась в нижней точке окружности. Для бензола (А) и циклобутадиена (В) это будет выглядеть следующим образом:
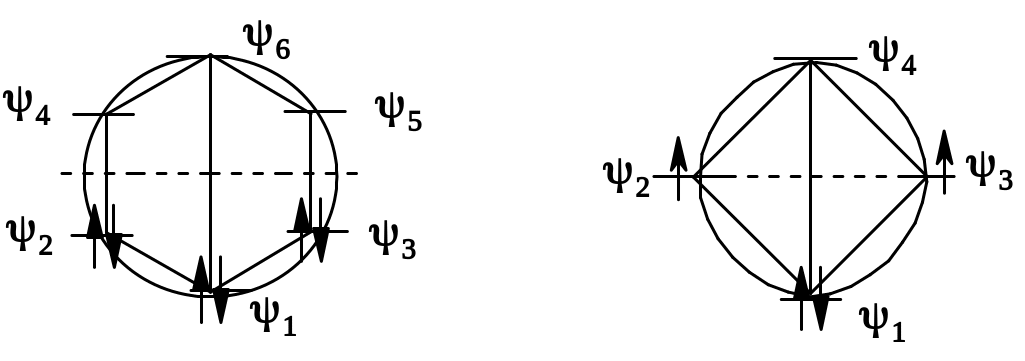 А
В
А
В
Точки, в которых вершины многоугольника касаются окружности, отвечают уровням энергии молекулярных орбиталей ψi; горизонтальный (пунктирный) диаметр окружности – нулевая линия (соответствует энергии несвязывающих орбиталей). Орбитали ниже этой линии – связывающие, выше – разрыхляющие, находящиеся на ее уровне – несвязывающие. Размещая на орбиталях π-электроны, можно убедиться, что у бензола 6 π-электронов находятся попарно на трех связывающих орбиталях (в том числе на двух вырожденных) а у циклобутадиена два электрона находятся на несвязывающих орбиталях, как и было сказано выше.
