
- •I.4. Диены
- •I.4.1. Диены с кумулированными двойными связями
- •I.4.2. Диены с сопряженными двойными связями
- •I.4.3. Диены с изолированными двойными связями
- •I.4.4. Некоторые сведения о перициклических реакциях.
- •I.4.5. Природные диены и полиены.
- •I.5. Алкины
- •I.5.1. Получение алкинов.
- •I.5.2.1. Реакции с разрывом тройной связи
- •I.5.2.2. Реакции с сохранением тройной связи.
- •I.6. Арены
- •I.6.1. Основные типы ароматических структур
- •I.6.2. Арены, содержащие бензольные циклы.
- •Свойства аренов
- •Химические свойства аренов
I.4.3. Диены с изолированными двойными связями
Как уже упоминалось, диены с изолированными двойными связями, за немногочисленными исключениями, вполне аналогичны алкенам; одним из таких исключений является перегруппировка Коупа, которая происходит при нагревании 1,5-диенов:
 Легко
заметить, что в результате перегруппировки
происходит перемещение
(миграция) простой связи (σ-связи),
включенной в систему π-связей;
перегруппировки такого типа называют
сигматропными.
В данном случае связь между атомами с
номерами 1 перемещается таким образом,
что связывает атомы с номерами 3 (такая
схема нумерации принята для сигматропных
перегруппировок); таким образом,
перегруппировка Коупа
относится
к [3,3]-сигматропным перегруппировкам. В
случае, если R=Н,
соединения (142) и (143) идентичны; в этом
случае перегруппировка является
вырожденной.
Легко
заметить, что в результате перегруппировки
происходит перемещение
(миграция) простой связи (σ-связи),
включенной в систему π-связей;
перегруппировки такого типа называют
сигматропными.
В данном случае связь между атомами с
номерами 1 перемещается таким образом,
что связывает атомы с номерами 3 (такая
схема нумерации принята для сигматропных
перегруппировок); таким образом,
перегруппировка Коупа
относится
к [3,3]-сигматропным перегруппировкам. В
случае, если R=Н,
соединения (142) и (143) идентичны; в этом
случае перегруппировка является
вырожденной.
Сигматропные перегруппировки, как правило, протекают по перициклическим механизмам.
I.4.4. Некоторые сведения о перициклических реакциях.
В предыдущих разделах были приведены некоторые перициклические реакции: реакции циклоприсоединения (димеризация алкенов, диеновый синтез), электроциклические реакции и сигматропные перегруппировки. Вообще же круг перициклических реакций значительно шире приведенных выше примеров, и их роль в органическом синтезе значительна. Перициклические реакции отличаются резко выраженными особенностями, отличающими их от
других типов реакций.
А. Перициклические реакции идут при нагревании (термически) или освещении ультрафиолетовым излучением (фотохимически); катализаторы здесь не требуются.
Б. Результат любой перициклической реакции точно «запрограммирован»: одни реакции идут при нагревании и не идут при освещении, другие – наоборот; некоторые реакции идут и при нагревании и при освещении, но если для продукта реакции возможна стереоизомерия, то при нагревании и при освещении образуются разные стереоизомеры. Перициклические реакции абсолютно стереоспецифичны: из субстрата определенной конфигурации образуется только один стереоизомер продукта; альтернативный стереоизомер не удается обнаружить самыми чувствительными методами. Иными словами, определенные реакции или образование определенных стереоизомеров «разрешены», альтернативные им реакции или стереоизомеры «запрещены». Поскольку термодинамические параметры альтернативных реакций мало отличаются, очевидно, столь резкая разница в результатах связана с кинетикой: «разрешенные» реакции проходят через достаточно устойчивые переходные состояния, напротив, протекание «запрещенных» реакций требует образование переходных состояний с очень высокой энергией; высокая энергия активации делает прохождение этих реакций практически невозможным.
Природа переходных состояний перициклических реакций была раскрыта Р.Б. Вудвардом и Р. Хоффманом (1965 г.); сформулированные ими представления позволили предсказывать устойчивость переходных состояний, следовательно, результаты перициклических реакций.
Чтобы понять суть данных представлений (в наиболее простом изложении), необходимо помнить, что при образовании переходного состояния перициклической реакции происходит синхронные разрыв и образование связей в циклической системе (переходные состояния перициклических реакций всегда циклические, см. выше). Это происходит путем взаимодействия или перестройки молекулярных орбиталей исходных веществ. Переходное состояние перициклической реакции будет устойчивым в том случае, если в нем достигается максимальное связывание; такое связывание достигается тогда, когда при взаимодействии или перестройке π-орбиталей сближаются их доли с одинаковым знаком волновой функции:
![]() Связывание
Антисвязывание (разрыхление)
Связывание
Антисвязывание (разрыхление)
(условно будем считать закрашенную долю имеющей знак «+», незакрашенную – знак «-»).
Сближение долей с разным знаком означает разрыхление (антисвязывание); переходное состояние неустойчиво и реакция «запрещена».
Какие конкретно молекулярные орбитали взаимодействуют или перестраиваются в ходе перициклических реакций? При взаимодействии двух молекул (реакции циклоприсоединения) взаимодействуют высшая занятая молекулярная орбиталь (ВЗМО) одной молекулы и низшая свободная молекулярная орбиталь (НСМО) другой молекулы. Если перициклическая реакция идет с участием одной молекулы (электроциклические реакции), то перестройке подвергается ее высшая занятая молекулярная орбиталь.
ВЗМО и НСМО называются граничными орбиталями.
Рассмотрим теперь некоторые типы перициклических реакций; ограничимся наиболее простыми примерами.
1. Димеризация этилена с образованием циклобутана ([2+2]-циклоприсоединение). В данном случае реагируют ВЗМО одной молекулы алкена и НСМО другой молекулы алкена. Алкены имеют всего две π-орбитали: одну связывающую и одну разрыхляющую. Рассмотрим возможные варианты:
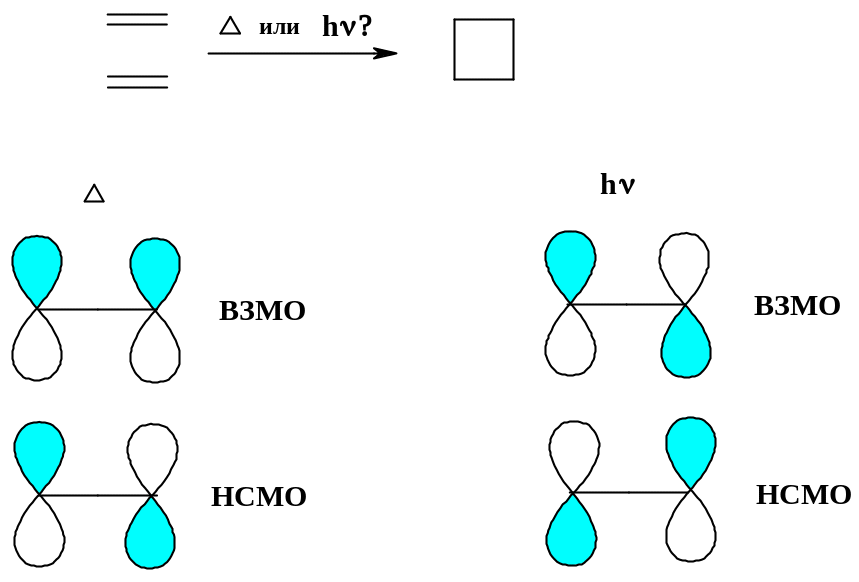 А.
Антисвязывание Б.
Связывание
А.
Антисвязывание Б.
Связывание
Реакция запрещена Реакция разрешена
Как уже упоминалось, перициклические реакции могут идти термически, либо фотохимически.
А. Термическое взаимодействие. В данном случае обе молекулы реагируют в основном состоянии; в этом случае ВЗМО – связывающая орбиталь, НСМО – разрыхляющая орбиталь. При сближении двух молекул (по вертикали) сближаются доли π-орбиталей разных знаков (А., левые «половинки» орбиталей); максимальное перекрывание не достигается, реакция «запрещена».
Б. Фотохимическое взаимодействие. В этом случае одна из молекул реагирует в фотовозбужденном состоянии: ее ВЗМО уже не связывающая, а разрыхляющая (при фотовозбуждении пара электронов переходит со связывающей орбитали на разрыхляющую); НСМО второй молекулы, естественно, тоже разрыхляющая. При сближении молекул возможно сближение долей орбиталей только с одноименными знаками, т.е. максимальное перекрывание; реакция «разрешена».
Таким образом, димеризация алкенов по перициклическому механизму возможна только при освещении, но не при нагревании. Известны примеры термической димеризации алкенов, но они идут не по перициклическому механизму, а по асинхронному.
2. Диеновый синтез ([4+2]-циклоприсоединение). В данном случае могут реагировать ВЗМО диена и НСМО диенофила или, наоборот, ВЗМО диенофила и НСМО диена – результат будет идентичным. Рассмотрим первый вариант; предварительно вспомним структуру четырех π-орбиталей 1,3-диена:
О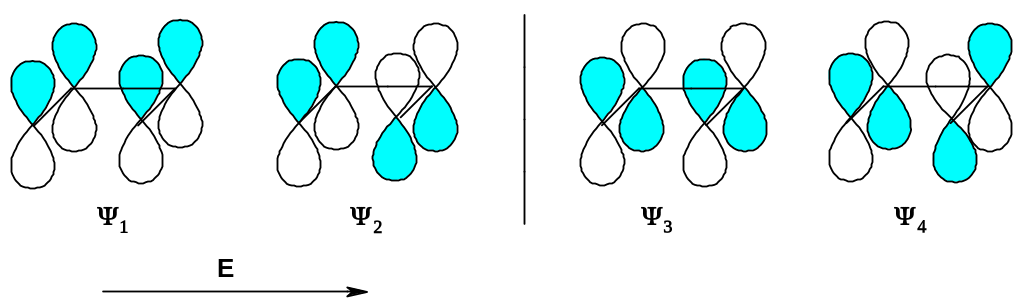 рбитали
ψ
и
ψ2-
связывающие, орбитали
ψ3 и
ψ4
- разрыхляющие; энергия орбиталей
возрастает от ψ
до
ψ 4
рбитали
ψ
и
ψ2-
связывающие, орбитали
ψ3 и
ψ4
- разрыхляющие; энергия орбиталей
возрастает от ψ
до
ψ 4
 Рассмотрим
взаимодействие ВЗМО диена и НСМО алкена:
Рассмотрим
взаимодействие ВЗМО диена и НСМО алкена:
А. Связывание Б. Антисвязывание
Реакция разрешена Реакция запрещена
А. Термическое взаимодействие. Молекула диена реагирует в основном состоянии; ее ВЗМО является связывающей: это орбиталь ψ2. НСМО диенофила, естественно, аналогична НСМО этилена. При сближении молекул диена и диенофила сближаются доли орбиталей с одинаковым знаком; реакция «разрешена». Действительно, диеновый синтез идет при нагревании.
Б. Фотохимическое взаимодействие. В этом случае пара электронов диена «перескакивает» на низшую разрыхляющую орбиталь; ВЗМО диена – орбиталь ψ3. При сближении диена и диенофила сближаются доли орбиталей с разными знаками; реакция «запрещена».
Таким образом, для [4+2]-циклоприсоединения картина обратная [2+2]-циклоприсоедине- нию. Такая альтернация сохраняется и далее; для [4+4]- циклоприсоединения разрешена фотохимическая реакция и запрещена термическая. В общем случае [x+y]-циклоприсоединения: если сумма участвующих в реакции π-электронов равна 4n, то разрешена фотохимическая перициклическая реакция и запрещена термическая; если она равна 4n+2, картина меняется на противоположную.
3. Электроциклические реакции. Рассмотрим простейший случай – циклизацию 1,3-диена в производное циклобутена (обратную реакцию здесь рассматривать не будем). В самом общем виде реакция приводилась выше; при более внимательном рассмотрении легко можно заметить, что реакция может приводить к разным стереоизомерам производного циклобутена (цис- и транс-). В случае циклизации, например, диена с Е,Е-конфигурацией это выглядит следующим образом:
П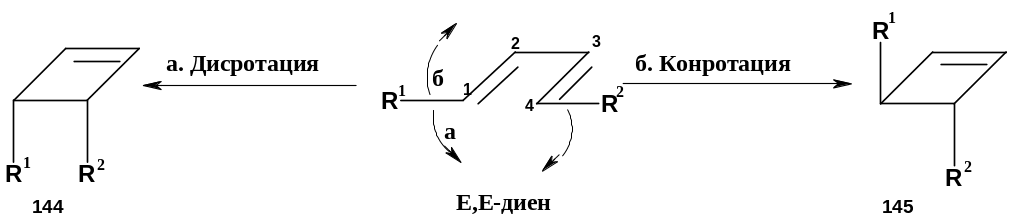 ри
циклизации атомы С-1 и С-4 диена изменяют
гибридизацию (sp2sp3);
вследствие этого происходит поворот
связей С1-R1
и С4-R2;
при этом возможны два варианта:
ри
циклизации атомы С-1 и С-4 диена изменяют
гибридизацию (sp2sp3);
вследствие этого происходит поворот
связей С1-R1
и С4-R2;
при этом возможны два варианта:
а. Связи поворачиваются в разных направлениях (на схеме заместитель R2 поворачивается по часовой стрелке, а заместитель R1 – против нее). Такой вариант называется дисротацией (дисротаторным поворотом). Для Е,Е-диена дисротация приводит к образованию цис-изомера циклобутена (144).
б. Связи поворачиваются в одном и том же направлении (на схеме оба заместителя поворачиваются по часовой стрелке). Этот вариант называют конротацией (конротаторным поворотом). Для Е,Е-диена результатом конротации является образование транс-изомера (145).
Разумеется, для диенов, имеющих иную конфигурацию (например, Z,Е-), стереохимические результаты дисротации и конротации будут иными.
 Данная
перициклическая реакция идет путем
перестройки ВЗМО диена с разрывом двух
π-связей и образованием σ-связи и новой
π -связи:
Данная
перициклическая реакция идет путем
перестройки ВЗМО диена с разрывом двух
π-связей и образованием σ-связи и новой
π -связи:
А. Термическая реакция. Как уже упоминалось, в этом случае ВЗМО – орбиталь ψ2. На рисунке видно, что для образования σ-связи необходима конротация – только в этом случае произойдет перекрывание долей одного знака; при дисротации сближались бы доли с разными знаками. Таким образом, при термическом процессе разрешена конротация и запрещена дисротация.
Б. При фотохимической реакции ВЗМО – орбиталь ψ3 здесь картина обратная: разрешена дисротация и запрещена конротация.
Таким образом, электроциклические реакции могут идти как термически, так и фотохимически, но при этом получаются разные стереоизомеры продуктов реакции. Например, из Е,Е-диена при нагревании образуется транс-изомер (145), а при освещении – цис-изомер (144).
Для циклизации 1,3,5-триенов в циклогексадиены правила альтернативны циклизации 1,3-диенов: запрещенные варианты становятся разрешенными и наоборот.
Другие, более сложные случаи, в частности, сигматропные перегруппировки, рассматриваются в специальных курсах. В общем же можно сделать вывод, что открытые Вудвардом и Хоффманом закономерности позволяют точно предсказывать результаты перициклических реакций; эта область органических реакций является наиболее предсказуемой.
