
- •Глава 1 Теоретический обзор литературы……………….6
- •Глава 2 Результаты экспериментального исследования ……………….…………………………………………………..33
- •Введение
- •Глава 1 Теоретический обзор литературы
- •Выводы к главе 1
- •Глава II Результаты экспериментального исследования
- •Выводы к главе 2
- •Суд над кока-колой, фантой, спрайтом.
Выводы к главе 1
Собирая, анализируя собранный теоретический материал по данной проблеме, мы узнали, какие вещества входят в состав газированных напитков, с некоторыми вещества мы уже были знакомы, но со многими веществами мы познакомились впервые, изучая этикетки на емкостях с газированными напитками. Мы узнали об истории возникновения газированного напитка. Для нас стало неожиданным, то, что современный напиток «Schweppes» назван в честь Иоганна Якоба Швеппа, который внес вклад в развитие производства газированного напитка. Мы так же узнали, что при процессе брожения выделяется углекислый газ, и если его пропустить через воду, то она приобретает совершенно неповторимый и новый вкус, который и придает газированному напитку кажущуюся свежесть и неповторимость. Для нас стало открытием, что компания кока-кола производит 200 других газированных напитков. Нам было интересно изучить историю появления такого напитка, как кока-кола, узнать из каких веществ раньше изготавливали кока-колу, кому принадлежит идея назвать столь популярный и всеми любимый и знаменитый на весь мир напиток.
В ходе теоретического исследования был изучен состав сладких газированных напитков. Определены вещества, их принадлежность к классу органических и неорганических.
В состав газированных напитков входят следующие органические вещества: углеводы, лимонная кислота, бензоат натрия, цитрат натрия и другие пищевые добавки.
Неорганические вещества: ортофосфорная кислота, углекислый газ, вода.
Глава II Результаты экспериментального исследования
Наше экспериментальное исследование состоит из двух частей: первая часть – это социологический эксперимент, вторая часть – химический эксперимент.
Социологический эксперимент. В целях выяснения, какой же напиток, является самым популярным среди учащихся 8,10,11 классов мы провели анкетирование указанных классов. Нами были опрошены учащиеся 8а, 8в, 10А, 11А. Всего в анкетировании приняли участия 93 желающих.
Результаты анкетирования.
1.Как часто ты употребляешь газированные напитки?
А) Часто б) 1 раз в неделю в) 1 раз в месяц г) очень редко
Д) никогда
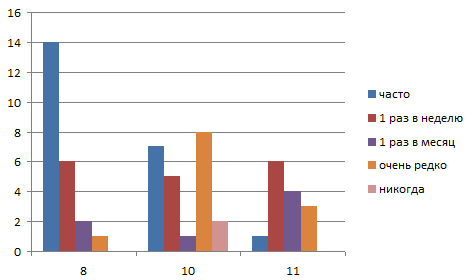
2. Какие газированные напитки ты предпочитаешь?
А ) Coca-cola б)7Up в)Спрайт г)Pepsi
Д) Фанта е)Газированная вода ж)другие:______________________
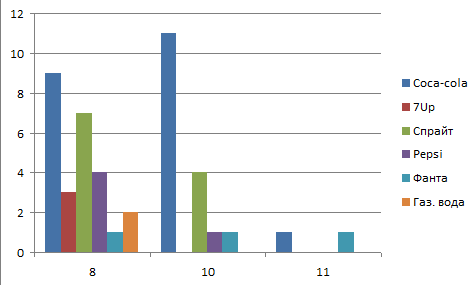
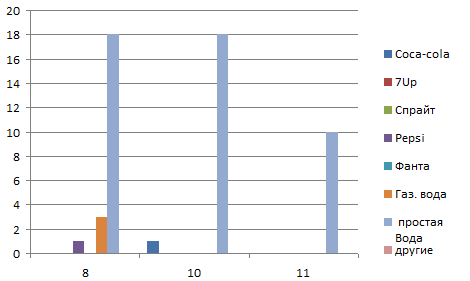
3. Какой, напиток, по-твоему лучше утоляет жажду?
А)Coca-cola б)7Up в)Спрайт г)Pepsi
Д)Фанта е) простая вода ж)другие
4 Пробовали ли вы энергетические напитки?
А) Да б) нет
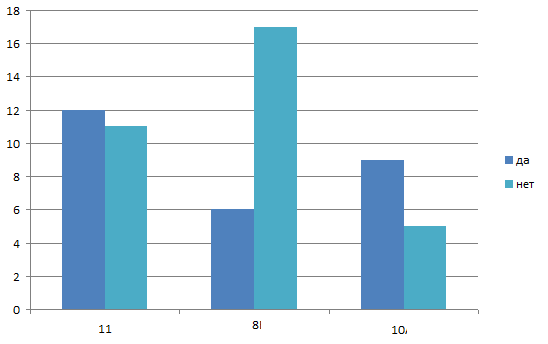
5 Чувствовал ли ты после этого прилив сил, повышение работоспособности ?
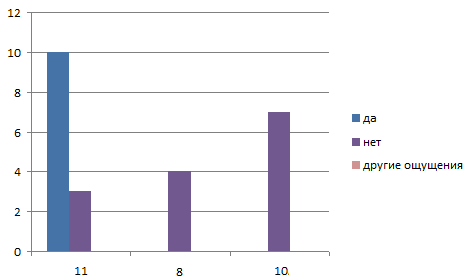
В результате мы выяснили, что самым популярным напитком среди учащихся 8 – х и 10-х классов является кока-кола. Нам стало интересно, с чем это связано? Может быть, все дело в рекламе, которая транслируется с экранов телевизоров, в интернете? Или же все дело в особом вкусе, который делает кока-колу неповторимым напитком непохожим на другие известные нам вкусы.
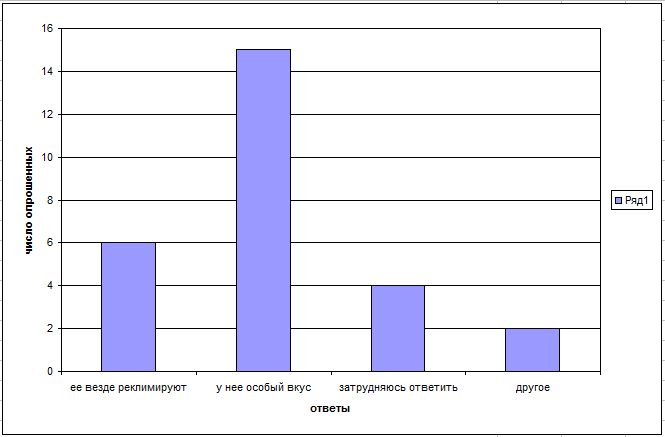
Мы решили отдельно опросить учащихся, для которых любимым напитком является кока-кола, о причине их предпочтений.
Вашим любимым напитком является кока-кола потому что…
Ее везде рекламируют
У нее особый вкус
Затрудняюсь ответить
Другое__________________________
Химический эксперимент. Мы изучили состав самых популярных газированных напитков, используя данные приведенные на этикетках емкостей с напитками.
Coca-Cola |
Фанта |
Спрайт |
Общее |
||
Очищенная газированная вода Сахар Натуральные ароматизаторы |
||
Различия |
||
Красители |
||
Натуральный краситель карамель |
нет |
Бета-каротин |
Регуляторы кислотности |
||
Ортофосфорная кислота |
Лимонная кислота, цитрат натрия |
Лимонная кислота |
Остальное - пищевые добавки |
||
Кофеин |
Подсластители (аспартам, ацесульфат калия) |
Апельсиновый сок 3%, витамин С (не менее 4,5 мг/100 мл), стабилизаторы (эфиры глицерина и смоляных кислот, гуаровая камедь) |
Общие сахара (на 100 мл) |
||
10,6 г |
7 г |
11,6 г |
Из таблицы видно, что наибольшее количество сахара содержится в спрайте – 11,6 г. Мы предполагаем, что в тех углеводах, которые содержатся в газированных напитках, присутствует глюкоза, так ли это можно проверить с помощью качественной реакции с гидроксидом меди II.
Проведение эксперимента:
В пробирку поместить 2 мл сульфата меди (II) прилить гидроксид натрия. К полученному осадку прилить поочередно кока-колу, затем фанту, затем спрайт. Затем нагреть содержимое пробирки. Сначала раствор становится желто-зеленого цвета, затем краснеет.
Правила техники безопасности: соблюдать осторожность при работе со щелочью, соблюдать правила нагревания веществ в пробирке.
C uSO4
+ 2NaOH
= Cu(OH)2
+ Na2SO4
uSO4
+ 2NaOH
= Cu(OH)2
+ Na2SO4
Рис. 3 качественная реакция на глюкозу с гидроксидом меди II
СН2ОН – (СНОН)4 – СОН + Сu(ОН)2 = СН2ОН – (СНОН)4 – СООН + Сu2О↓+ Н2О
Мы узнали, что в газированных напитках есть сахар с помощью качественной реакции. Так же мы может узнать его количество.
В 100мл – 11,6 г сахара (как указано на этикетке емкости со спрайтом)
В 2000 мл - х
Х = 232 г
Значит в 2-х литровой бутылке 232 г сахара. Мы решили рассчитать, сколько это в чайных ложках.
Чайная ложка сахара без горки весит 6,3 г

Рис. 4 взвешивание чайной ложки сахара
1 ч.л. – 6,3 г сахара
Х - 232 г
Х = 37 ложек
37 ложек сахара в 2-х литровой бутылке спрайта.
Следующие вещества, входящие в газированные напитки - это кислоты. В кока-коле присутствует ортофосфорная кислота, а в остальных органические кислоты – лимонная. Для того, чтобы доказать наличие в газированных напитках кислот мы прибегли к помощи универсального индикатора лакмуса.
В три химических стакана мы налили индикатор лакмус, затем прилили к каждому газированный напиток.

Рис. 5 Окраска лакмуса в нейтральной среде – до взаимодействия с газированными напитками.

Рис. 6 Результат изменения окраски раствора лакмуса после добавления кока-колы, спрайта, фанта (слева направо).
В каждом стакане индикатор лакмус изменил цвет, что является доказательством присутствия кислот в газированных напитках.
Мы уже познакомились с неорганическими кислотами - серной, азотной, соляной. Мы знаем, что они изменяют цвет индикатора, взаимодействуют с основаниями и с основными оксидами. Мы решили проверить, а будут ли кислоты в газированных напитках проявлять такие же химические свойства тех кислот, которые мы изучали на уроках химии.
Мы решили провести реакции между кислотами в газированных напитках и оксидом меди (II)
Для этого мы поместили в три чистых пробирки порошок с оксидом меди (II)затем прилили газированные напитки и стали нагревать. В результате только в пробирке со спрайтом были виды изменения цвета на светло-голубой. В остальных пробирках раствор цвет не поменял.
|
|
Рис. 7 Оксид меди (II) и кока-кола |
Рис.8 нагревание кока-колы и оксида меди (II) |
|
|
Рис. 9 Оксид меди (II) и спрайт |
Рис. 10 нагревание спрайта и оксида меди (II) |
|
|
Рис. 11 После реакции между спрайтом и оксидом меди (II) |
|
|
|
Рис. 12 Нагревание смеси фанты и оксида меди (II) |
|
|
|
Рис. 13 Результаты реакций между кислотами в газированных напитках и оксидом меди (II) |
|
Взаимодействие с основаниями.
2.1 Проведение реакций между раствором гидроксида натрия и газированными напитками.
В три химических стакана налили несколько миллилитров гидроксида натрия. Добавили каплю фенолфталеина. Индикатор фенолфталеин приобрел розовый цвет, так как щелочная среда.
Затем в каждый стакан поочередно приливали газированные напитки. Фенолфталеин стал светлее только во втором стакане, где был налит спрайт.
|
|
Рис. 14. Раствор гидроксида натрия до взаимодействия с газированными напитками |
Рис. 15. раствор гидроксида натрия после добавления фенолфталеина |
р |
|
Проведение реакций между гидроксидом меди (II) и газированными напитками.
В три химических стакана поместили раствор гидроксида натрия, прилили раствор сульфат меди (II). Выпал голубой осадок – гидроксид меди (II)
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
К каждому стакану с осадком поочередно добавляли кока-колу, фанту, спрайт. Осадок не растворился ни в одном из газированных напитков.
|
|
Рис. 17 химические стаканы с раствором гидроксида натрия |
Рис. 18 Получение гидроксида меди (II) |
|
|
Рис. 19 результаты реакций между гидроксидом меди (II) и газированными напитками. |
|
|
|
Рис. 20 результат реакции фанты с гидрокисдом меди (II) |
Рис. 21 результат реакции спрайта с гидрокисдом меди (II) |
Рис. 22 результат реакции кока-колы с гидроксидом меди (II) |
|
М ожет
ли кока-кола удалить ржавчину?
ожет
ли кока-кола удалить ржавчину?
Для проведения эксперимента был взят ржавый гвоздь и опущен в стакан с кока-колой на 24 часа. В результате эксперимента ржавчина частично была удалена.

Рис. 23 рис. 24 Частичное удаление ржавчины после пребывания ржавого гвоздя в кока-коле.
2.4 Проведение химических реакций между газированными напитками и основным карбонатом меди.
В три чистых пробирки поместили основный карбонат меди, прилили поочередно газированные напитки. Ни в одной пробирке не произошло изменений.
|
|
Рис. 25 Проведение реакции между основным карбонатом меди и кока-колой. |
|
|
|
Рис. 26 Проведение реакции между основным карбонатом меди и спрайтом. |
|
|
|
Рис. 27 Проведение реакции между основным карбонатом меди и фантой. |
|
Сравнительная таблица химических свойств кислот входящих в состав газированных напитков и соляной кислоты.
Реагент |
Признаки химической реакции с кислотами в газированных напитках |
Признаки химической реакции с соляной кислотой |
1. Лакмус |
Стал светлее |
Изменил цвет на красный |
2. Оксид меди |
Нет |
Изменение цвета раствора CuO + 2HCl = CuCl2 + H2O |
3. NaOH |
Фенолфталеин стал светлее |
Фенолфталеин обесцветился Взаимодействует NaOH + HCl = NaCl + H2O |
4. Cu(OH)2 |
Голубой осадок не растворяется |
Осадок растворяется Cu(OH)2 + HCl = CuCl2 + H2O |
5. Оксид железа III (входит в состав ржавчины) |
Ржавчина растворяется
|
Ржавчина растворяется Fe2O3 + HCl = FeCl3 + H2O |
7. С цинком |
нет
|
Выделяется газ – водород Zn+ 2HCl = ZnCl2 + H2 |
8. С магнием |
нет
|
Выделяется газ водород Mg + 2HCl = MgCl2 + H2 |
9. С основным карбонатом меди |
нет
|
Выделяется углекислый газ (CuOH)2CO3 + 2HCl = CuCl2 + H2O+ CO2 |
Проведение химических реакций, подтверждающих наличие в газированных напитках углекислого газа.
3.1 Доказательством того, что в газированных напитках растворен углекислый газ может служить качественная реакция на углекислый газ – взаимодействие с известковой водой.
В три химических стакана налили 3 мл известковой воды. Осторожно прилили в каждый стакан с известковой водой поочередно кока-колу, фанту, спрайт. Мы наблюдали в каждом случае помутнение газированного напитка. Во всех трех случаях выпадал в осадок карбонат кальция.
Ca(OH)2 + CO2 = CaCO3 + H2O
|
|
Рис. 28 Проведение реакции между углекислым газом, растворенным в газированных напитках и известковой водой. |
|
3.2. Проведение химического эксперимента с углекислым газом, входящим в состав газированного напитка.


Рис. 29 Углекислый газ не поддерживает горения.













 ис.
16 результат реакции между раствором
гидроксида натрия и газированными
напитками.
ис.
16 результат реакции между раствором
гидроксида натрия и газированными
напитками.














