
- •Перелік абревіатур
- •Лабораторна робота № 1 Якісні реакції на білки
- •Лабораторна робота № 2 Фізико-хімічні властивості білків
- •Лабораторна робота № 3 Висолювання білків
- •Лабораторна робота № 4 Визначення ізоелектричної точки білків
- •Лабораторна робота № 5
- •Лабораторна робота № 6 Фракціонування білків сульфатом амонію
- •Лабораторна робота № 7 Спектрофотометричний і колориметричний методи визначення концентрації речовин
- •Лабораторна робота № 8 Колориметричне визначення концентрації білка методом Бредфорда
- •Лабораторна робота № 9 Спектрофотометричний метод визначення концентрації білка, який ґрунтується на здатності поглинати ультрафіолетове світло
- •Лабораторна робота № 10 Визначення вмісту сечовини в сечі
- •Лабораторна робота № 11 Електрофорез білків у поліакриламідному гелі
- •Іі. Вуглеводи Лабораторна робота № 12 Якісні реакції на вуглеводи
- •Лабораторна робота № 13 Кількісне визначення глюкози і глікогену
- •Лабораторна робота № 14 Кількісне визначення фруктози на основі реакції Селіванова
- •Лабораторна робота № 15 Кількісне визначення піровиноградної кислоти колориметричним методом
- •Лабораторна робота № 16 Визначення концентрації лактату ензиматичним методом
- •Лабораторна робота № 17 Вивчення властивостей жирів
- •Лабораторна робота № 18 Визначення йодного числа ліпідів
- •Лабораторна робота № 19 Кількісне визначення холестеролу (за Блюром)
- •Іv. Нуклеїнові кислоти Лабораторна робота № 20 Визначення сумарного вмісту нуклеїнових кислот
- •Лабораторна робота № 21 Визначення вмісту нуклеїнових кислот з дифеніламіном
- •Лабораторна робота № 22 Визначення активності дезоксирибонуклеаз
- •V. Вітаміни і гормони Лабораторна робота № 23 Кількісне визначення вітаміну с (за Тильманом)
- •Лабораторна робота № 24 Кількісне визначення вітаміну р (катехінів) за Левенталем
- •Лабораторна робота № 25 Реакція вітаміну рр з гідросульфітом натрію
- •Лабораторна робота № 26 Окислення вітаміну в1 до тіохрому
- •Лабораторна робота № 27 Відновлення рибофлавіну
- •Лабораторна робота № 28 Кількісне визначення вітаміну а
- •Лабораторна робота № 29 Кількісне визначення вітаміну d
- •Лабораторна робота № 30 Кількісне визначення вітаміну е
- •Лабораторна робота № 31 Якісні реакції та кількісне визначення адреналіну
- •VI. Ферменти Лабораторна робота № 32 Визначення активності ферментів спектрофотометричним методом
- •Лабораторна робота № 33 Вплив різних чинників на активність α-амілази слини
- •Лабораторна робота № 34 Визначення кінетичних характеристик ферментів на прикладі лактатдегідрогенази
- •Лабораторна робота № 35 Активація та інгібування ферментів (на прикладі фосфофруктокінази)
- •Лабораторна робота № 36 Інгібування лактатдегідрогенази надлишком субстрату
- •Лабораторна робота № 37 Визначення активності амф-дезамінази
- •Лабораторна робота № 38 Очистка амф-дезамінази
- •Лабораторна робота № 39 Очистка лактатдегідрогенази шляхом висолювання сульфатом амонію
- •Vіі. Вільнорадикальні процеси Лабораторна робота № 40 Визначення активності супероксиддисмутази (сод)
- •Лабораторна робота № 41 Визначення активності глутатіонпероксидази
- •Лабораторна робота № 42 Визначення активності глутатіонредуктази
- •Лабораторна робота № 43 Визначення активності глутатіон-s-трансферази
- •Лабораторна робота № 44 Визначення вмісту карбонільних груп у білках
- •Лабораторна робота № 45 Визначення вмісту пероксидів ліпідів
- •Лабораторна робота № 46 Визначення вмісту тбк-активних продуктів
- •Лабораторна робота № 47 Визначення вмісту тіолових груп
- •Лабораторна робота № 48 Визначення вмісту глутатіону
- •Питання контролю рівня знань на підсумкових заняттях
- •Програмові вимоги до куpсу “Біохімія”
- •Рекомендована література Теоретичний курс
- •Практичний курс
VI. Ферменти Лабораторна робота № 32 Визначення активності ферментів спектрофотометричним методом
Потрібно знати:
1) визначення понять “активність ферменту”, “енергія активації”, “активний центр ферменту”;
2) одиниці кількісного вираження активності ферментів та “види” активності;
3) приклади різних методів визначення активності ферментів: колориметричного, манометричного, титриметричного тощо; переваги і недоліки спектрофотометричного методу;
4) умови, при яких можливе визначення активності ферментів спектрофотометричним методом;
5) сутність методу застосування спряжених реакцій при спектрофотометричному визначенні активності ферменту;
6) теоретичні принципи спектрофотометрії (лабораторна робота № 7).
Потрібно вміти:
1) виводити формулу для розрахунку питомої активності ферменту при визначенні її спектрофотометричним методом.
Визначення активності ферментів спектрофотометричним методом ґрунтується на поглинанні світла згідно із законом Бугера-Ламберта-Бера (див. також лабораторну роботу № 7):
де: І0 – початкова інтенсивність світла,
І – інтенсивність світла після проходження через розчин,
l – довжина оптичного шляху променя у розчині, см,
с – концентрація (молярна) речовини, яка поглинає світло,
– коефіцієнт молярного поглинання, М–1см–1.
Величина “lg (I0/I)” називається оптичною густиною (D).
Активність ферментів визначається як швидкість зміни концентрації субстрату або продукту реакції. За одну одиницю активності ферменту прийнята така його кількість, яка каталізує використання 1 мкмоля субстрату або утворення 1 мкмоля продукту за одну хвилину при 25С.
Для розрахунку специфічної активності ферменту підраховують, скільки одиниць активності ферменту припадає на 1 мг білка.
Активність ферменту розраховують за формулою:
![]()
де: А – специфічна активність, Од/мг білка;
D – зміна оптичної густини за 1 хв.;
Vпр – об’єм проби, в якій визначається швидкість реакції, в мл;
– коефіцієнт молярного поглинання, М–1см–1;
l – довжина оптичного шляху променя світла;
nпреп – об’єм препарату (в мл), який додається в пробу;
[білок]преп – концентрація білка в препараті, мг/мл.
Реактиви.
200 мМ калій-фосфатний буфер (КФБ), рН 7,0; 100 мМ розчин пірувату, 100 мМ розчину динатрієвої солі етилендиамінтетраацетату (ЕДТА), 16 мМ NADH, 1 М Н2О2, екстракти тканин.
Хід роботи.
1) Визначення активності лактатдегідрогенази (ЛДГ) в препараті м’язів
Лактатдегідрогеназа каталізує наступну реакцію:

Активність ферменту в прямій реакції визначається за зміною концентрації NADH. Коефіцієнт молярного поглинання NADH при 340 нм становить 6220 М–1см–1. Зміну оптичної густини реєструють на ФЕК через кожні 10 сек протягом 2 хв або на спектрофотометрі СФ-46 в циклічному режимі при 340 нм. В останньому випадку використовують лампу розжарювання.
Перед визначенням розрахувати склад середовища для визначення активності ЛДГ (табл. 1). Об’єм проби становить 2 мл.
Таблиця 1. Склад середовища для визначення активності ЛДГ
-
Компоненти
Кінцева концентрація
Вихідна концентрація
На 1 пробу
(2 мл), мкл
На 5 проб
(10 мл), мкл
КФБ
50 мМ
200 мМ
Піруват
1 мМ
100 мМ
ЕДТА
0,5 мМ
100 мМ
NADH
160 мкМ
16 мМ
Препарат
–
–
5–10 мкл
Вода
–
–
В кювету додати 1,990–1,995 мл середовища для визначення активності ферменту, а потім 5–10 мкл препарату. Оптимальною слід вважати зміну оптичної густини в 0,05–0,1 одиниць за хвилину.
Окремо визначити концентрацію білка методом Бредфорда (лабораторна робота № 8) і розрахувати специфічну активність ЛДГ.
Правила коректного визначення активності ферменту:
1) Правило 1 (Мал. А): Для розрахунків активності ферменту слід вибирати діапазон, в якому кількість використаного субстрату (утвореного продукту) – S/P – змінюється протягом часу лінійно.
Для цього треба на початку роботи реєструвати швидкість реакції протягом кількох хвилин, щоб вибрати лінійний діапазон зміни оптичної густини в часі. Як правило, швидкість реакції максимальна на початку, а потім поступово знижується, чим порушується лінійність вказаної залежності. Проте є реакції (наприклад, каталізована глутатіонпероксидазою (див. роботу №41)), в яких швидкість реакції зростає з часом; в цих випадках розрахунки ведуть в діапазоні найвищої швидкості реакції.
2) Правило 2 (Мал. Б): Розрахунки активності ферменту слід проводити на основі визначень, для яких швидкість реакції (пронормована на використаний об’єм препарату) не залежить від кількості внесеного в суміш препарату.
Для цього необхідно визначити швидкість реакції для кількох (3–4) різних об’ємів препарату і побудувати графік, на осі абсцис якого відкласти об’єми препарату (або вміст білка в ньому), а на осі ординат – зміну оптичної густини за хвилину. Вибирається такий об’єм, який потрапляє в лінійний діапазон графіка.
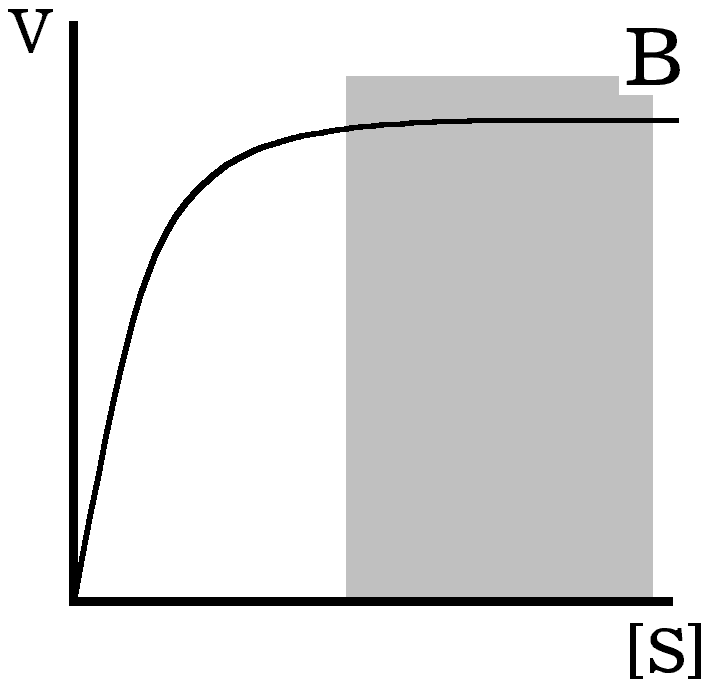
3) Правило 3 (Мал. В): Розрахунки активності ферменту слід проводити на основі визначень, в яких швидкість реакції мало залежить від концентрації субстратів. Як правило, використовують такі концентрації субстратів, які забезпечують 95% від мак симальної активності, а концентрації субстратів в ході визначення знижуються не біль ше, ніж на 10%.
Малюнки, наведені нижче, ілюструють три правила визначення активності ферментів. Сірим кольором позначені ділянки, які використовуються для коректного визначення активності.


2) Визначення активності каталази в препаратах печінки
Каталаза перетворює пероксид водню до води і молекулярного кисню:
2Н2О2 → О2 + 2Н2О
Швидкість реакції реєструється за зміною концентрації пероксиду водню при 240 нм. Робота виконується на спектрофотометрі СФ-46 (дейтерієва лампа). Коефіцієнт молярного поглинання пероксиду водню при вказаній довжині хвилі становить 39,4 М–1см–1 (див. роботу №7). Перед визначенням розрахувати склад суміші на 5 проб (табл. 2). Об’єм однієї проби становить 2 мл. Пероксид водню в суміш не додавати!
Таблиця 2. Склад середовища для визначення активності каталази
Компоненти |
Кінцева концентрація |
Вихідна концентрація |
На 1 пробу (2 мл), мкл |
На 5 проб (10 мл), мл |
КФБ |
50 мМ |
200 мМ |
|
|
ЕДТА |
0,5 мМ |
100 мМ |
|
|
Н2О2 |
10 мМ |
1 М |
|
|
Препарат |
– |
– |
2–5 |
|
Вода |
– |
– |
|
|
В кварцову кювету для спектрофотометрії додати послідовно 1,975 мл суміші для визначення активності, 5 мкл препарату ферменту і, в останню чергу, 20 мкл пероксиду водню. Визначити швидкість зміни оптичної густини. Визначити концентрацію білка у препараті і розрахувати активність каталази.
Для коректного розрахунку активності ферменту спочатку необхідно знайти залежність швидкості реакції від часу (правило 1), кількості внесеного препарату (правило 2) і кількості субстрату (правило 3).
