
- •Перелік абревіатур
- •Лабораторна робота № 1 Якісні реакції на білки
- •Лабораторна робота № 2 Фізико-хімічні властивості білків
- •Лабораторна робота № 3 Висолювання білків
- •Лабораторна робота № 4 Визначення ізоелектричної точки білків
- •Лабораторна робота № 5
- •Лабораторна робота № 6 Фракціонування білків сульфатом амонію
- •Лабораторна робота № 7 Спектрофотометричний і колориметричний методи визначення концентрації речовин
- •Лабораторна робота № 8 Колориметричне визначення концентрації білка методом Бредфорда
- •Лабораторна робота № 9 Спектрофотометричний метод визначення концентрації білка, який ґрунтується на здатності поглинати ультрафіолетове світло
- •Лабораторна робота № 10 Визначення вмісту сечовини в сечі
- •Лабораторна робота № 11 Електрофорез білків у поліакриламідному гелі
- •Іі. Вуглеводи Лабораторна робота № 12 Якісні реакції на вуглеводи
- •Лабораторна робота № 13 Кількісне визначення глюкози і глікогену
- •Лабораторна робота № 14 Кількісне визначення фруктози на основі реакції Селіванова
- •Лабораторна робота № 15 Кількісне визначення піровиноградної кислоти колориметричним методом
- •Лабораторна робота № 16 Визначення концентрації лактату ензиматичним методом
- •Лабораторна робота № 17 Вивчення властивостей жирів
- •Лабораторна робота № 18 Визначення йодного числа ліпідів
- •Лабораторна робота № 19 Кількісне визначення холестеролу (за Блюром)
- •Іv. Нуклеїнові кислоти Лабораторна робота № 20 Визначення сумарного вмісту нуклеїнових кислот
- •Лабораторна робота № 21 Визначення вмісту нуклеїнових кислот з дифеніламіном
- •Лабораторна робота № 22 Визначення активності дезоксирибонуклеаз
- •V. Вітаміни і гормони Лабораторна робота № 23 Кількісне визначення вітаміну с (за Тильманом)
- •Лабораторна робота № 24 Кількісне визначення вітаміну р (катехінів) за Левенталем
- •Лабораторна робота № 25 Реакція вітаміну рр з гідросульфітом натрію
- •Лабораторна робота № 26 Окислення вітаміну в1 до тіохрому
- •Лабораторна робота № 27 Відновлення рибофлавіну
- •Лабораторна робота № 28 Кількісне визначення вітаміну а
- •Лабораторна робота № 29 Кількісне визначення вітаміну d
- •Лабораторна робота № 30 Кількісне визначення вітаміну е
- •Лабораторна робота № 31 Якісні реакції та кількісне визначення адреналіну
- •VI. Ферменти Лабораторна робота № 32 Визначення активності ферментів спектрофотометричним методом
- •Лабораторна робота № 33 Вплив різних чинників на активність α-амілази слини
- •Лабораторна робота № 34 Визначення кінетичних характеристик ферментів на прикладі лактатдегідрогенази
- •Лабораторна робота № 35 Активація та інгібування ферментів (на прикладі фосфофруктокінази)
- •Лабораторна робота № 36 Інгібування лактатдегідрогенази надлишком субстрату
- •Лабораторна робота № 37 Визначення активності амф-дезамінази
- •Лабораторна робота № 38 Очистка амф-дезамінази
- •Лабораторна робота № 39 Очистка лактатдегідрогенази шляхом висолювання сульфатом амонію
- •Vіі. Вільнорадикальні процеси Лабораторна робота № 40 Визначення активності супероксиддисмутази (сод)
- •Лабораторна робота № 41 Визначення активності глутатіонпероксидази
- •Лабораторна робота № 42 Визначення активності глутатіонредуктази
- •Лабораторна робота № 43 Визначення активності глутатіон-s-трансферази
- •Лабораторна робота № 44 Визначення вмісту карбонільних груп у білках
- •Лабораторна робота № 45 Визначення вмісту пероксидів ліпідів
- •Лабораторна робота № 46 Визначення вмісту тбк-активних продуктів
- •Лабораторна робота № 47 Визначення вмісту тіолових груп
- •Лабораторна робота № 48 Визначення вмісту глутатіону
- •Питання контролю рівня знань на підсумкових заняттях
- •Програмові вимоги до куpсу “Біохімія”
- •Рекомендована література Теоретичний курс
- •Практичний курс
Лабораторна робота № 26 Окислення вітаміну в1 до тіохрому
Потрібно знати:
1) у яких біохімічних процесах бере участь вітамін В1 та до складу яких ферментних систем він входить;
2) поширення в природі вітаміну В1;
3) причини та наслідки авітамінозу, викликаного нестачею тіаміну;
4) добову потребу у вітаміні В1 та шляхи її забезпечення.
Потрібно вміти:
1) написати структурну формулу тіаміну та тіамінпірофосфату;
2) написати рівняння реакції окислення тіаміну в тіохром.
Вітамін В1 (аневрин, тіамін) бере участь у реакціях, які каталізують деякі карбоксилази, декарбоксилази і дегідрогенази (наприклад, піруватдегідрогеназний комплекс). При нестачі вітаміну В1 порушуються окисно-відновні процеси, обмін білків, жирів і вуглеводів.
У кристалічному стані тіамін це тонкі безбарвні голки з температурою плавлення 248–250С, добре розчинні у воді і погано – в етанолі, ефірі, хлороформі та інших органічних розчинниках.
Вітамін В1 легко руйнується при високій температурі у нейтральному і особливо в лужному середовищі; при рН 3,0–4,5 тіамін стійкий і витримує нагрівання до 120–140С. В природі зустрічається у вільному та зв’язаному станах. Продукти рослинного походження (дріжджі, злаки) багатші на цей вітамін, ніж продукти тваринного походження.
Принцип реакції, яка лежить в основі наведеного методу визначення, полягає у здатності тіаміну в лужному середовищі за наявності K3[Fe(CN)6] перетворюватись у тіохром, який флуоресціює в ізобутиловому спирті.
Окислення тіаміну в тіохром можливе і за дії пероксиду водню. Реакція при цьому відбувається наступним чином:
Р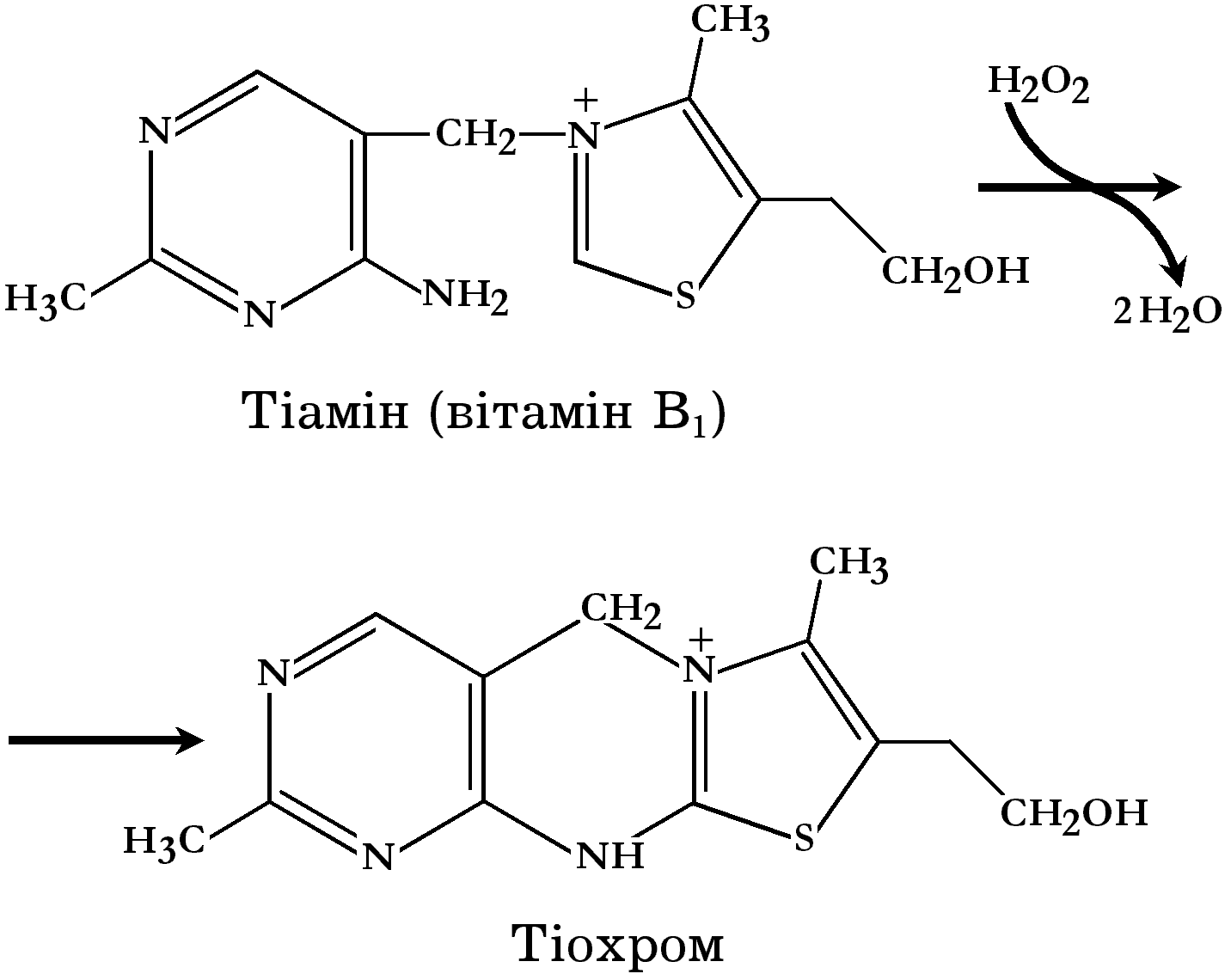 еактиви.
еактиви.
5% розчин K3[Fe(CN)6], 30% розчин NaOH, ізобутанол, розчин вітаміну В1 (5 мкг/мл).
Хід роботи.
До 1 мл розчину вітаміну В1 додати 2 мл 5% розчину K3[Fe(CN)6] і 1 мл 30% розчину NaOH, добре перемішати і екстрагувати ізобутанолом. Спостерігати в ультрафіолеті інтенсивну синю флуоресценцію ізобутанольного екстракту тіохрому.
Лабораторна робота № 27 Відновлення рибофлавіну
Потрібно знати:
1) до складу яких життєво важливих сполук входить рибофлавін і яка біологічна роль;
2) біохімічні реакції, у яких беруть участь флавінвмісні сполуки;
3) поширення в природі рибофлавіну;
4) наслідки нестачі рибофлавіну в організмі;
5) добову потребу у вітаміні В2.
Потрібно вміти:
1) написати структурні формули рибофлавіну, флавінмононуклеотиду (FMN) та флавінаденіндинуклеотиду (FAD);
2) написати рівняння реакції окислення/відновлення рибофлавіну.
Р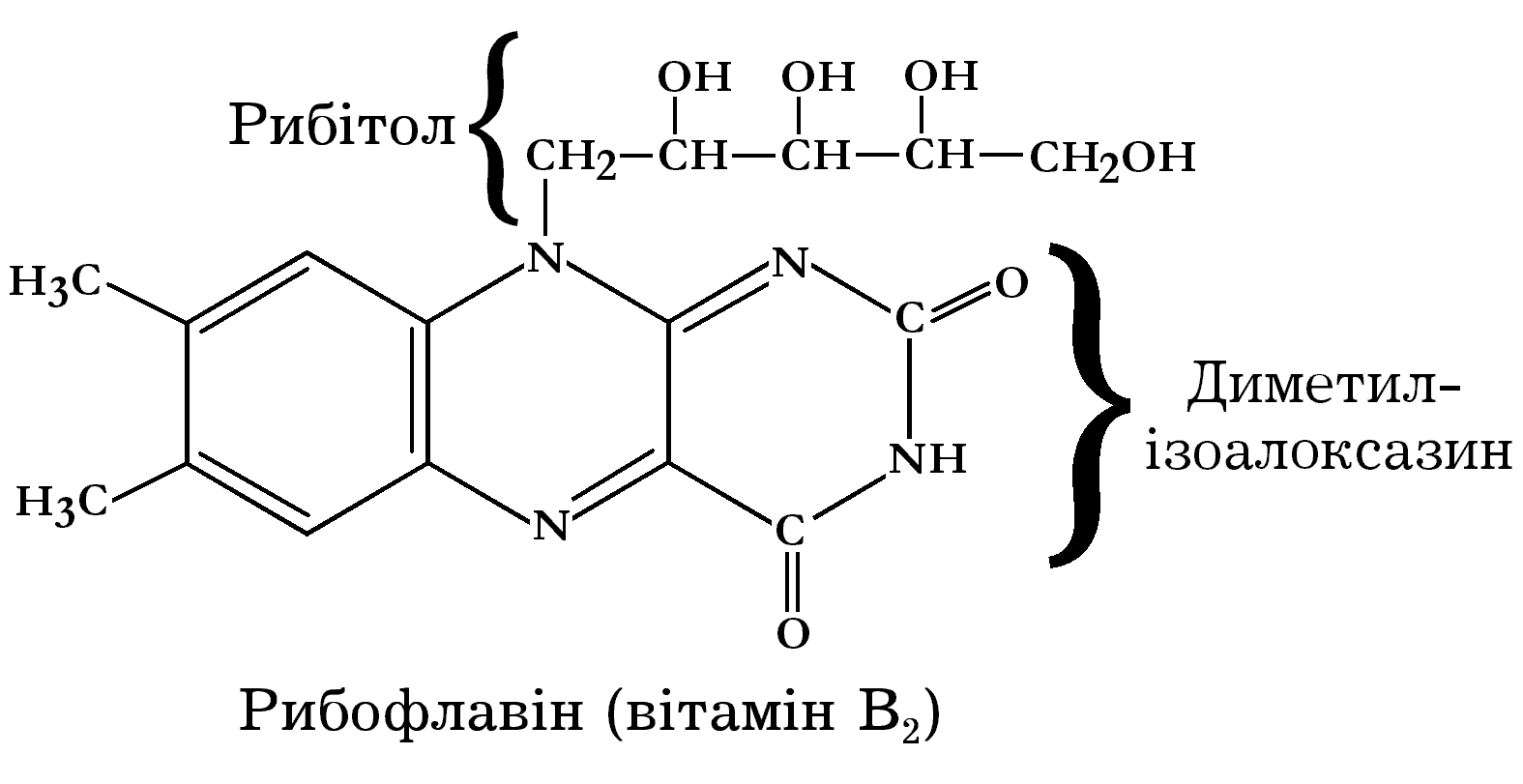 ибофлавін,
або вітамін В2,
є складовою частиною флавінвмісних
оксидоредуктаз. Нестача цього вітаміну
в організмі людини і тварин призводить
до зниження ваги, порушення апетиту,
запалення слизової оболонки та інших
па-тологічних змін. Рибофлавін є
метильованим ізоалоксазином, сполученим
з п’ятиатомним спиртом рибітолом.
ибофлавін,
або вітамін В2,
є складовою частиною флавінвмісних
оксидоредуктаз. Нестача цього вітаміну
в організмі людини і тварин призводить
до зниження ваги, порушення апетиту,
запалення слизової оболонки та інших
па-тологічних змін. Рибофлавін є
метильованим ізоалоксазином, сполученим
з п’ятиатомним спиртом рибітолом.
У природі рибофлавін зустрічається у вільній формі, а також у складі флавінаденіндинуклеотиду та флавінмононуклеотиду, міцно зв’язаних з білками. У чистому вигляді – це речовина жовтого кольору. Вітамін В2 стійкий у кислому середовищі, а в лужному він руйнується. Багато рибофлавіну в дріжджах, пшениці, картоплі та інших рослинних продуктах.
При відновленні рибофлавіну змінюється забарвлення: від жовтого (рибофлавін) до червоного (родофлавін) і, зрештою, безбарвного (лейкофлавін).
Реактиви.
0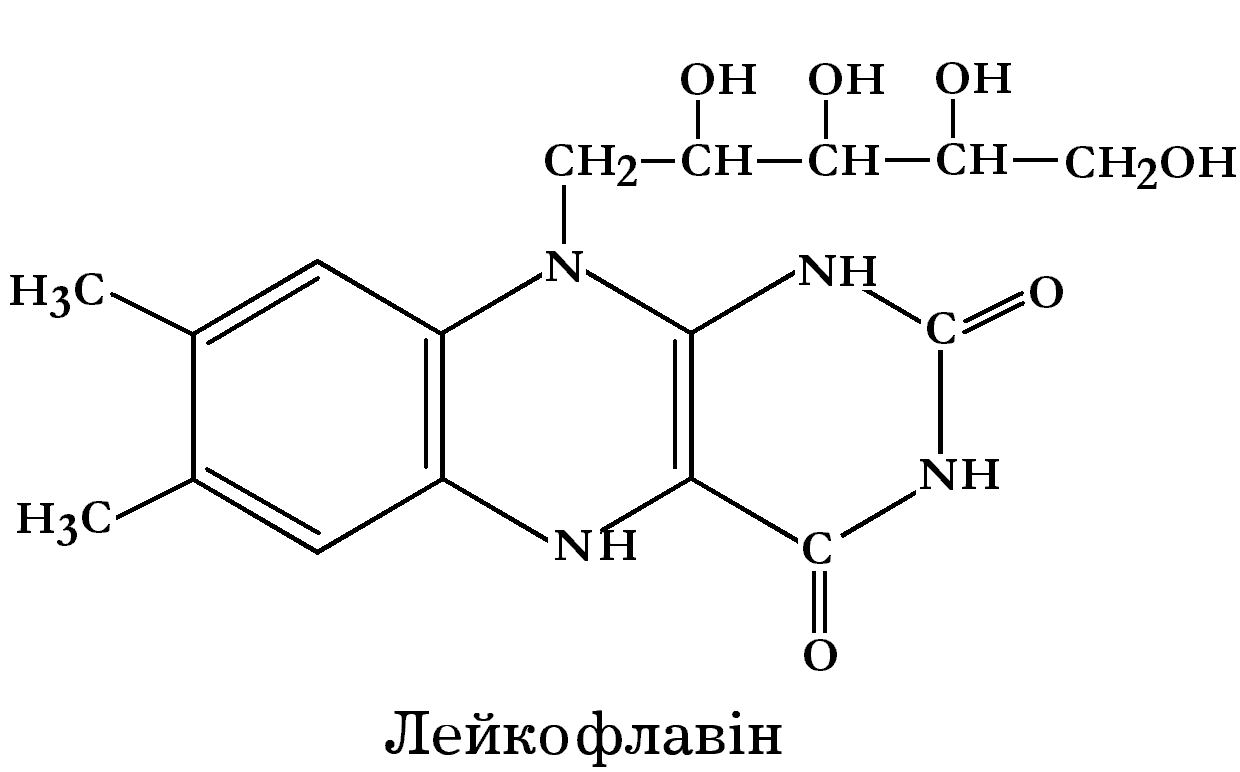 ,025%
розчин вітаміну В2,
концентрована соляна кислота, металічний
цинк.
,025%
розчин вітаміну В2,
концентрована соляна кислота, металічний
цинк.
Хід роботи.
Налити в пробірку 1 мл розчину рибофлавіну і додати 0,5 мл концентрованої соляної кислоти і 50 мг металічного цинку. У присутності HCl і Zn рибофлавін перетворюється спочатку в червону сполуку, а потім знебарвлюється.
