
- •Перелік абревіатур
- •Лабораторна робота № 1 Якісні реакції на білки
- •Лабораторна робота № 2 Фізико-хімічні властивості білків
- •Лабораторна робота № 3 Висолювання білків
- •Лабораторна робота № 4 Визначення ізоелектричної точки білків
- •Лабораторна робота № 5
- •Лабораторна робота № 6 Фракціонування білків сульфатом амонію
- •Лабораторна робота № 7 Спектрофотометричний і колориметричний методи визначення концентрації речовин
- •Лабораторна робота № 8 Колориметричне визначення концентрації білка методом Бредфорда
- •Лабораторна робота № 9 Спектрофотометричний метод визначення концентрації білка, який ґрунтується на здатності поглинати ультрафіолетове світло
- •Лабораторна робота № 10 Визначення вмісту сечовини в сечі
- •Лабораторна робота № 11 Електрофорез білків у поліакриламідному гелі
- •Іі. Вуглеводи Лабораторна робота № 12 Якісні реакції на вуглеводи
- •Лабораторна робота № 13 Кількісне визначення глюкози і глікогену
- •Лабораторна робота № 14 Кількісне визначення фруктози на основі реакції Селіванова
- •Лабораторна робота № 15 Кількісне визначення піровиноградної кислоти колориметричним методом
- •Лабораторна робота № 16 Визначення концентрації лактату ензиматичним методом
- •Лабораторна робота № 17 Вивчення властивостей жирів
- •Лабораторна робота № 18 Визначення йодного числа ліпідів
- •Лабораторна робота № 19 Кількісне визначення холестеролу (за Блюром)
- •Іv. Нуклеїнові кислоти Лабораторна робота № 20 Визначення сумарного вмісту нуклеїнових кислот
- •Лабораторна робота № 21 Визначення вмісту нуклеїнових кислот з дифеніламіном
- •Лабораторна робота № 22 Визначення активності дезоксирибонуклеаз
- •V. Вітаміни і гормони Лабораторна робота № 23 Кількісне визначення вітаміну с (за Тильманом)
- •Лабораторна робота № 24 Кількісне визначення вітаміну р (катехінів) за Левенталем
- •Лабораторна робота № 25 Реакція вітаміну рр з гідросульфітом натрію
- •Лабораторна робота № 26 Окислення вітаміну в1 до тіохрому
- •Лабораторна робота № 27 Відновлення рибофлавіну
- •Лабораторна робота № 28 Кількісне визначення вітаміну а
- •Лабораторна робота № 29 Кількісне визначення вітаміну d
- •Лабораторна робота № 30 Кількісне визначення вітаміну е
- •Лабораторна робота № 31 Якісні реакції та кількісне визначення адреналіну
- •VI. Ферменти Лабораторна робота № 32 Визначення активності ферментів спектрофотометричним методом
- •Лабораторна робота № 33 Вплив різних чинників на активність α-амілази слини
- •Лабораторна робота № 34 Визначення кінетичних характеристик ферментів на прикладі лактатдегідрогенази
- •Лабораторна робота № 35 Активація та інгібування ферментів (на прикладі фосфофруктокінази)
- •Лабораторна робота № 36 Інгібування лактатдегідрогенази надлишком субстрату
- •Лабораторна робота № 37 Визначення активності амф-дезамінази
- •Лабораторна робота № 38 Очистка амф-дезамінази
- •Лабораторна робота № 39 Очистка лактатдегідрогенази шляхом висолювання сульфатом амонію
- •Vіі. Вільнорадикальні процеси Лабораторна робота № 40 Визначення активності супероксиддисмутази (сод)
- •Лабораторна робота № 41 Визначення активності глутатіонпероксидази
- •Лабораторна робота № 42 Визначення активності глутатіонредуктази
- •Лабораторна робота № 43 Визначення активності глутатіон-s-трансферази
- •Лабораторна робота № 44 Визначення вмісту карбонільних груп у білках
- •Лабораторна робота № 45 Визначення вмісту пероксидів ліпідів
- •Лабораторна робота № 46 Визначення вмісту тбк-активних продуктів
- •Лабораторна робота № 47 Визначення вмісту тіолових груп
- •Лабораторна робота № 48 Визначення вмісту глутатіону
- •Питання контролю рівня знань на підсумкових заняттях
- •Програмові вимоги до куpсу “Біохімія”
- •Рекомендована література Теоретичний курс
- •Практичний курс
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ПРИКАРПАТСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ
імені ВАСИЛЯ СТЕФАНИКА
ІНСТИТУТ ПРИРОДНИЧИХ НАУК
КАФЕДРА БІОХІМІЇ
МЕТОДИЧНІ ВКАЗІВКИ
ДО ЛАБОРАТОРНИХ ЗАНЯТЬ
З БІОХІМІЇ
для студентів ІІ-ІІІ курсів спеціальності “Біологія”
Друге видання, виправлене та доповнене
Івано-Франківськ
2006
Методичні вказівки склали: д.б.н. В.І. Лущак, к.б.н. Т.В. Багнюкова,
к.б.н. Г.М. Семчишин, к.б.н. Д.В. Господарьов
Затверджено на засіданні кафедри біохімії інституту природничих наук Прикарпатського національного університету ім. В. Стефаника
12 травня 2006 р. (протокол № 9).
Затверджено до друку вченою радою Інституту природничих наук (протокол № 6 від 29 травня 2006 р.)
Рецензенти:
Доцент кафедри біохімії Івано-Франківського державного медичного університету, кандидат біологічних наук Т.П. Максимчук
Професор кафедри біохімії інституту природничих наук Прикарпатського національного університету імені Василя Стефаника, доктор медичних наук І.В. Мазепа
Прикарпатський університет ім. В. Стефаника, 2006
Вступ
Лабораторні заняття з курсу “Біохімія” виконуються відповідно до навчального плану підготовки бакалаврів, спеціалістів та магістрів біології денної та заочної форм навчання за спеціальністю 7.070402 (8.070402) – “Біологія”.
Мета проведення лабораторних занять з курсу “Біохімія” – поглибити теоретичні знання, отримані з лекційного курсу, дати основні навички роботи в біохімічній лабораторії, ознайомити з методами якісного та кількісного аналізу хімічного складу живих організмів, принципами оцінки динаміки вмісту основних метаболітів, очистки та дослідження властивостей ферментів.
В результаті проведення лабораторних занять студенти повинні:
отримати знання про:
правила техніки безпеки при роботі в біохімічній лабораторії.
хімічний склад та основні класи сполук, які входять до складу живих організмів;
основні метаболічні шляхи та регуляцію обміну вуглеводів, білків, нуклеїнових кислот та ліпідів;
механізми регуляції активності ферментів, їх кінетичні характеристики;
навчитись:
користуватись приладами біохімічної лабораторії;
отримувати препарати для вивчення складу та функціонального стану організмів;
визначати вміст білків, вітамінів, вуглеводів, нуклеотидів та жирів;
досліджувати активність та регуляторні властивості ферментів;
проводити математичну та статистичну обробки експериментальних даних;
оформлювати результати лабораторних робіт;
користуватись довідниками та каталогами.
Підготовка до лабораторного заняття включає теоретичне опрацювання матеріалу даної теми, знайомство з методикою виконання роботи та технікою безпеки. Принцип методу і хід роботи повинні бути записані в робочому зошиті до початку заняття. По закінченні практичної частини студенти захищають роботу у викладача. До захисту допускаються тільки повністю оформлені роботи. Оформлення передбачає занесення отриманих даних до таблиць, проведення необхідних розрахунків, відображення підсумків роботи у вигляді висновку. Кожен етап обробки результатів роботи і проведення розрахунків повинен бути коротко описаний, наприклад:
1) В ході роботи отримано наступні значення оптичної густини для стандартних і дослідних проб:
[ТАБЛИЦЯ]
2) За даними, наведеними в таблиці, будуємо калібрувальний графік:
[КАЛІБРУВАЛЬНИЙ ГРАФІК]
3) Згідно з калібрувальним графіком, вміст білка в дослідній пробі становить [значення] мкг. Оскільки в пробу вносили [значення] мкл білкового розчину, то концентрація білка в пробі становитиме [розрахунок] = [значення] мкг/мкл = [значення] мг/мл.
4) Значення оптичної густини дослідної проби знаходиться в діапазоні лінійної залежності оптичної густини від вмісту білка. Розрахуємо концентрацію білка за формулою: [розрахунок]= [значення] мкг/мкл = [значення] мг/мл.
Висновок. Концентрація білка в дослідній пробі становила [значення] мг/мл (якщо розраховувати за калібрувальним графіком), і [значення] мг/мл при розрахунку за формулою.
Абсолютно необхідним є наведення у формулах одиниць розмірності всіх величин, оскільки це дозволяє перевірити вірність розрахунків. У висновку повинні бути відображені всі результати, отримані в роботі, і спостереження. У висновку не варто подавати теоретичний матеріал за темою роботи; повинна бути представлена інформація, отримана лише при виконанні даної лабораторної роботи. При оформленні роботи, зокрема при написанні висновків, неприпустимі скорочення слів, окрім загальновживаних – хв, мл, мг і т. п. Повністю оформленою вважається робота, в якій заповнені всі таблиці, наведені всі розрахунки і зроблений висновок з отриманих результатів.
Перелік абревіатур
АДФ |
Аденозиндифосфорна кислота |
АМФ |
Аденозинмонофосфорна кислота |
АТФ |
Аденозинтрифосфорна кислота |
АФК |
Активовані форми кисню |
GSH |
Глутатіон відновлений |
GSSG |
Глутатіон окислений |
ДНК |
Дезоксирибонуклеїнова кислота |
ДНФГ |
2,4-Динітрофенілгідразин |
ДТНБ |
5,5′-Дитіобіс(2-нітробензойна) кислота |
ДФА |
Диметилформамід |
ДХФІФ |
2,6-Дихлорфеноліндофенол |
ЕДТА |
Етилендиамінтетраоцтова кислота |
КФБ |
Калійфосфатний буфер |
ЛДГ |
Лактатдегідрогеназа |
NAD / NADH |
Нікотинамідаденіндинуклеотид: окислений / відновлений |
NADP / NADPH |
Нікотинамідаденіндинуклеотидфосфат: окислений / відновлений |
ПОЛ |
Перекисне окислення ліпідів |
РНК |
Рибонуклеїнова кислота |
СОД |
Супероксиддисмутаза |
ТБК |
2-тіобарбітурова кислота |
ТЕМЕД |
N,N,N′,N′-тетраметилетилендиамін |
Трис |
Трисметил-(гідрокси)-амінометан |
ТХО |
Трихлороцтова кислота |
FAD / FADH2 |
Флавінаденіндинуклеотид: окислений / відновлений |
ФЕК |
Фотоелектроколориметр |
FMN / FMNH2 |
Флавінмононуклеотид: окислений / відновлений |
ФМСФ |
Фенілметилсульфонілфторид |
ФФК |
Фосфофруктокіназа |
ХДНБ |
1-хлоро-2,4-динітробензен |
|
|
І. Білки
Лабораторна робота № 1 Якісні реакції на білки
Потрібно знати:
1) хімічну природу білків;
2) хімічну структуру та властивості амінокислот, які входять до складу білків, та їхню класифікацію: а) за зарядом, б) за кількістю аміно- та карбоксильних груп, в) за розчинністю у воді (гідрофільні і гідрофобні амінокислоти);
3) методи ідентифікації С- та N-термінальних амінокислот.
Потрібно вміти:
1) написати формулу трипептиду будь-якого амінокислотного складу;
2) написати рівняння всіх хімічних перетворень, які відбуваються в біуретовій, ксантопротеїновій, нінгідриновій реакціях, реакціях Фоля та Адамкевича.
Присутність білків у біологічних об’єктах можна виявити за допомогою кольорових реакцій, зумовлених наявністю амінокислот в білках, їх специфічними групами або пептидними зв’язками.
Існують універсальні кольорові реакції, характерні для всіх білків незалежно від амінокислотного складу (біуретова, нінгідринова), а також специфічні реакції, у яких беруть участь тільки певні амінокислоти молекули білка (ксантопротеїнова, Міллона, Фоля та ін.).
Біуретова реакція
В лужному середовищі, за присутності іонів міді (ІІ), розчини білків набувають фіолетового забарвлення з червоним або синім відтінками, що залежить від концентрації пептидних зв’язків у розчині. Червонувате забарвлення дають продукти неповного гідролізу білків – пептони. Позитивну біуретову реакцію можуть давати речовини, які містять у молекулі не менше двох пептидних зв’язків, а також окремі амінокислоти, наприклад, гістидин. Біуретова реакція зумовлена наявністю пептидних зв’язків, які у лужному середовищі утворюють із сульфатом міді забарвлені комплекси:

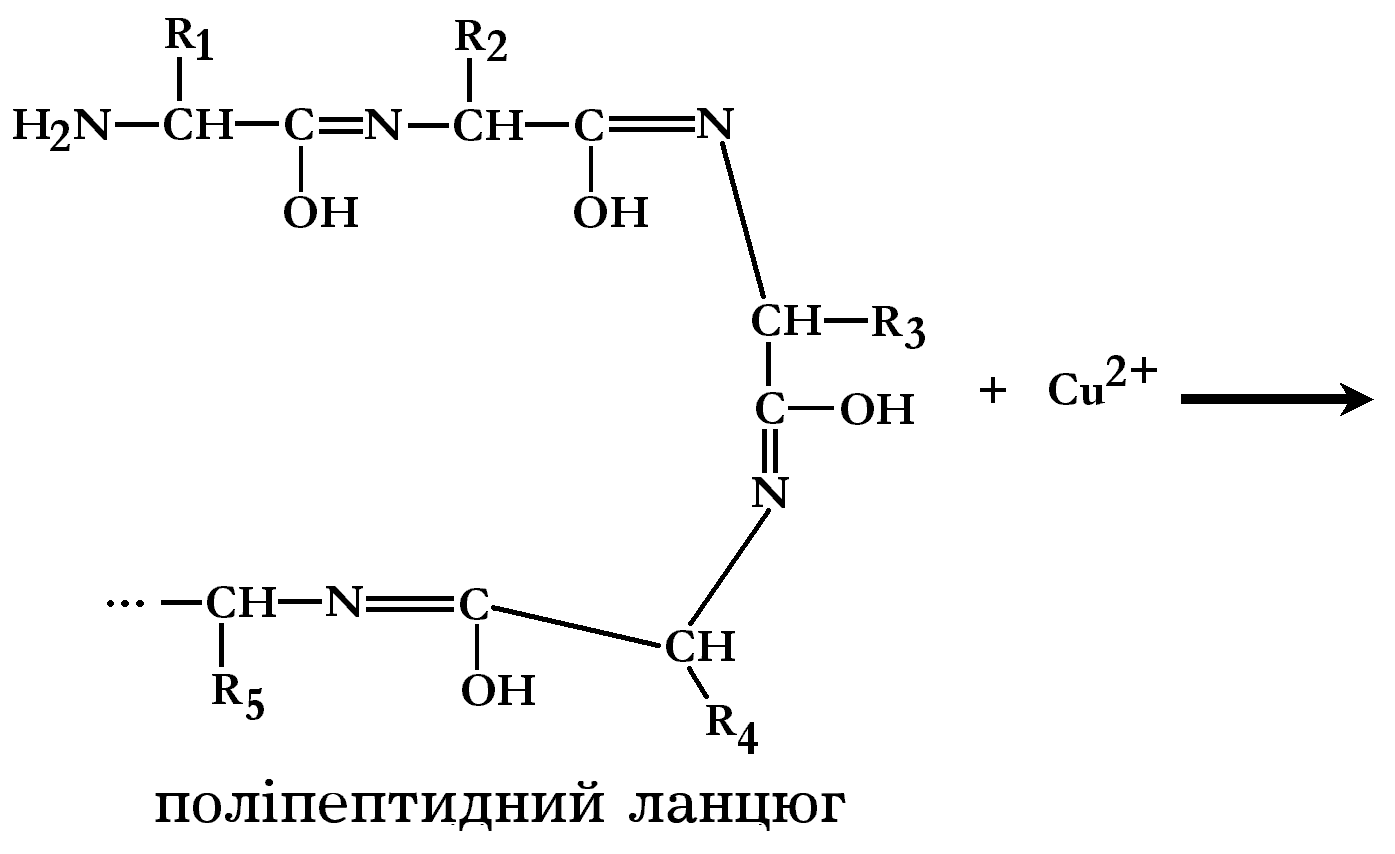
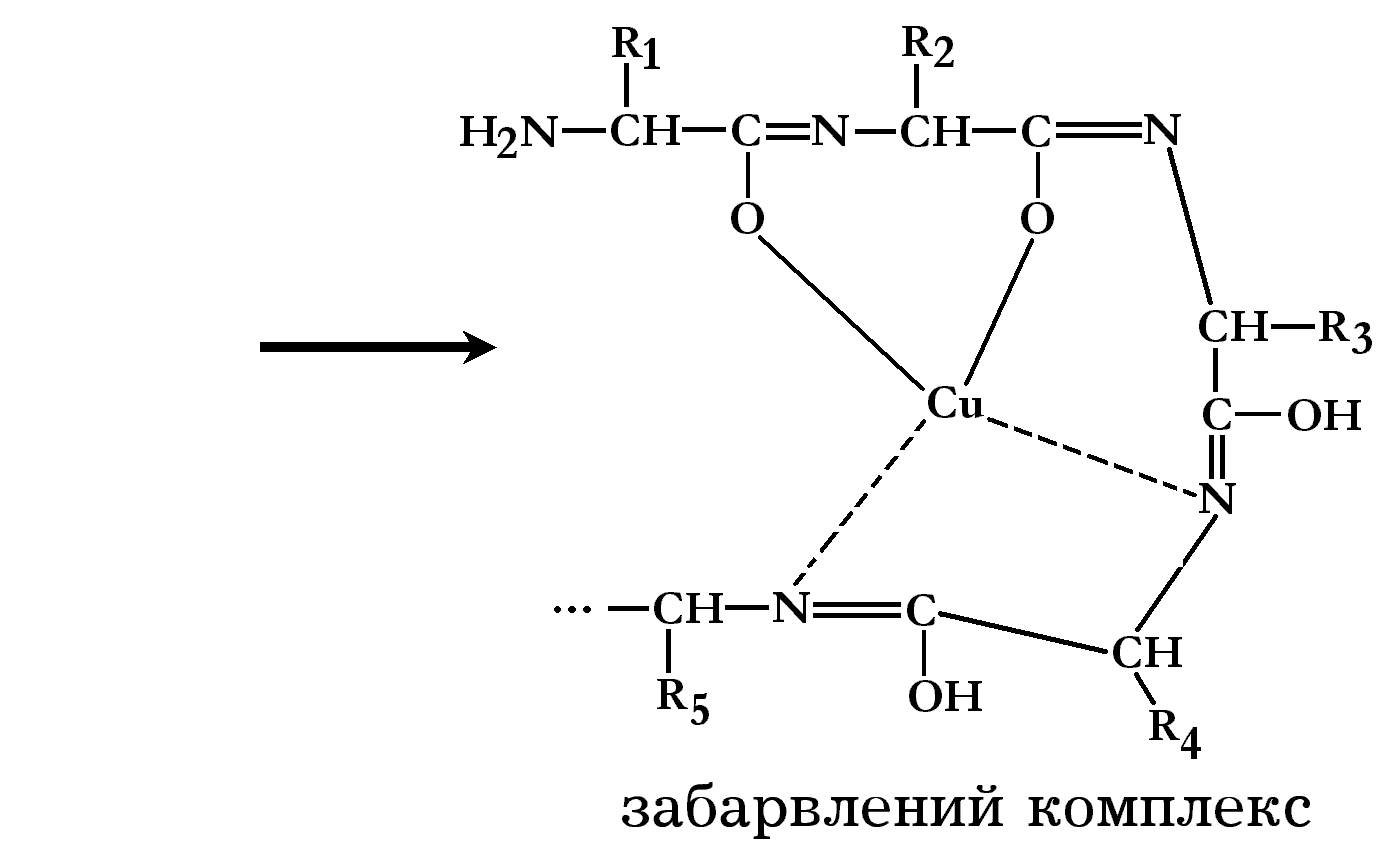 Група,
яка бере участь в утворенні пептидного
зв’язку,
в лужному середовищі знаходиться в
таутомерній енольній формі (див.
малюнок). При надлишку лугу відбувається
дисоціація ОН-групи, з’являється
негативний заряд, за рахунок чого кисень
взаємодіє з міддю, утворюючи солеподібні
зв’язки.
Мідь також утворює координаційні
зв’язки
з атомами азоту пептидного зв’язку.
Утворений комплекс стабільний.
Інтенсивність забарвлення залежить
від концентрації білка і кількості
сульфату міді в розчині.
Група,
яка бере участь в утворенні пептидного
зв’язку,
в лужному середовищі знаходиться в
таутомерній енольній формі (див.
малюнок). При надлишку лугу відбувається
дисоціація ОН-групи, з’являється
негативний заряд, за рахунок чого кисень
взаємодіє з міддю, утворюючи солеподібні
зв’язки.
Мідь також утворює координаційні
зв’язки
з атомами азоту пептидного зв’язку.
Утворений комплекс стабільний.
Інтенсивність забарвлення залежить
від концентрації білка і кількості
сульфату міді в розчині.
Реактиви.
10% розчин NaOH, 1% розчин CuSO4, 10% розчин яєчного білка (для збільшення розчинності яєчного білка в дистильованій воді її підлужнюють розчином NaOH).
Хід роботи.
В пробірку налити 1 мл 10% розчину яєчного білка, додати 2 мл 10% NaOH і 0,2 мл 1% розчину сульфату міді (ІІ). Результати спостережень занести до таблиці.
Нінгідринова реакція
Ця реакція властива як для вільних α-амінокислот, так і тих, які входять до складу білків та поліпептидів. При кип’ятінні білка з розчином нінгідрину (трикетогідринденгідрат), амінокислоти окислюються з утворенням вуглекислого газу, аміаку і альдегіду. Нінгідрин при цьому відновлюється. Відновлений нінгідрин конденсується з аміаком і молекулою окисленого нінгідрину, утворюючи сполуку синьо-фіолетового кольору:
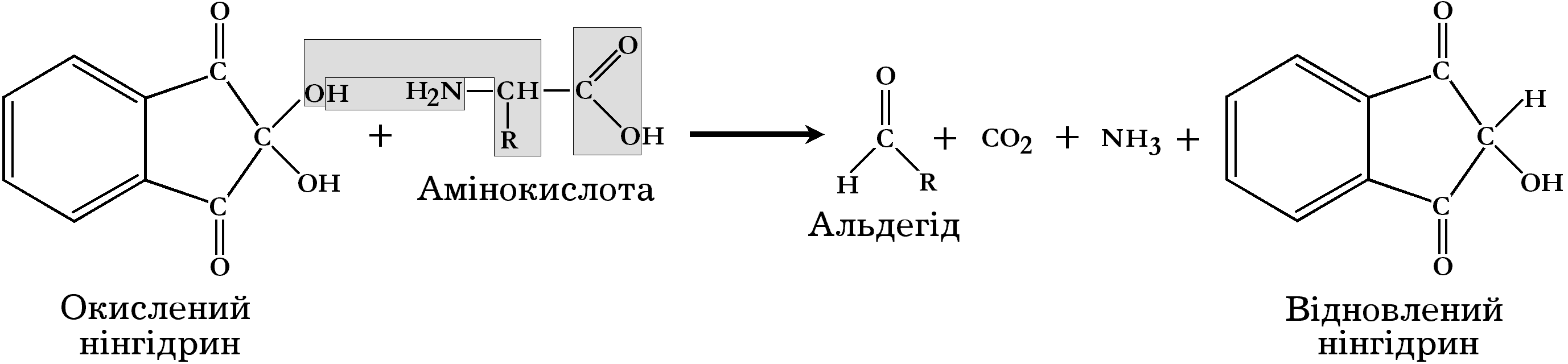
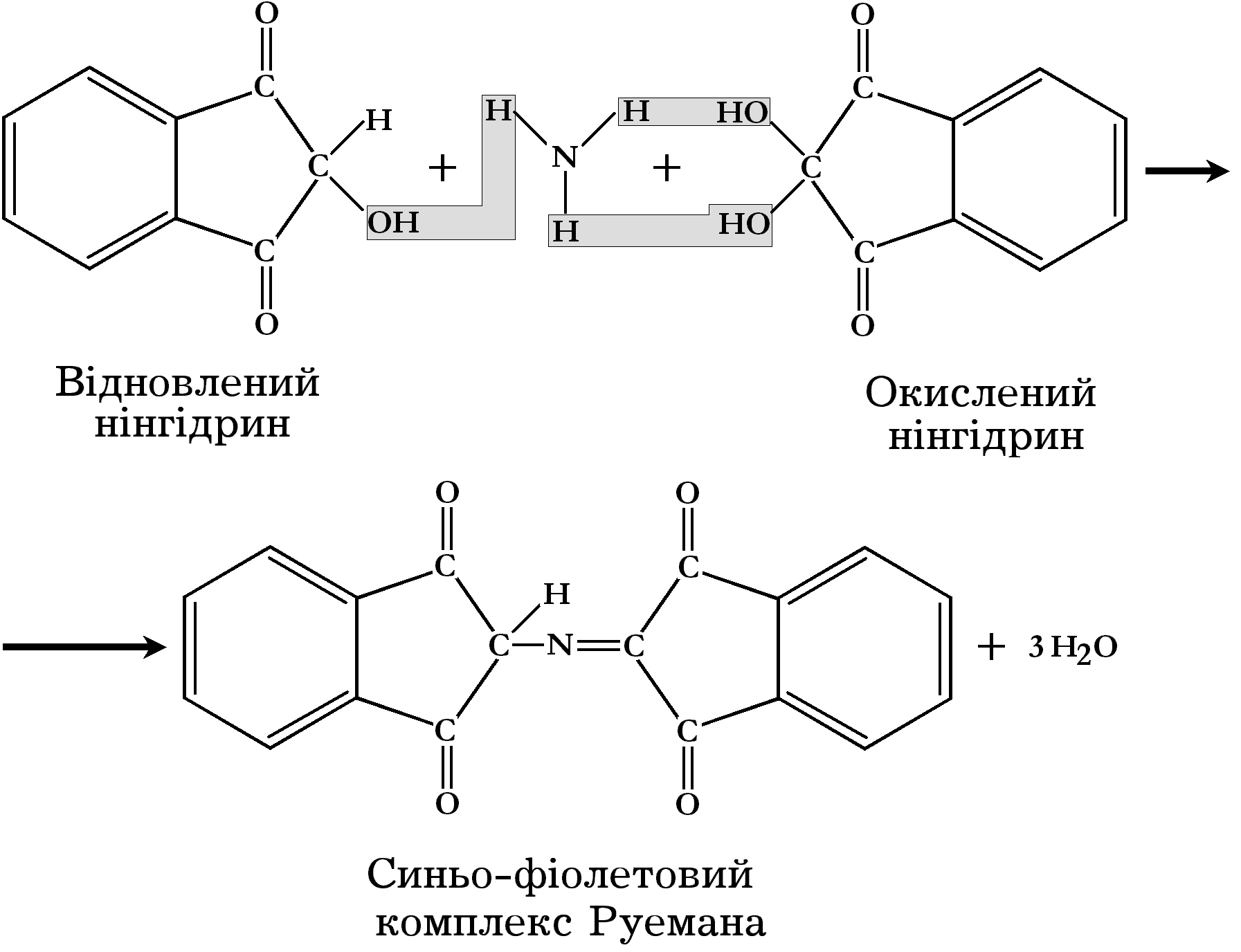
Реактиви.
0,5% розчин нінгідрину, 10% розчин яєчного білка.
Хід роботи.
В пробірку внести 1 мл 10% розчину білка і додати 1 мл 0,5% розчину нінгідрину. Суміш кип’ятити 1–2 хвилини. В пробірці поступово з’явиться рожеве, червоне, а потім синьо-фіолетове забарвлення. Результати спостережень занести до таблиці.
Ксантопротеїнова реакція
Ц я
реакція є специфічною на ароматичні
амінокислоти: триптофан,
фенілаланін,
тирозин. При
обробці білків концентрованою азотною
кислотою білок спочатку випадає в осад,
а при нагріванні розчиняється. Після
цього розчин набуває жовтого кольору,
який після додавання лугу переходить
в оранжевий.
я
реакція є специфічною на ароматичні
амінокислоти: триптофан,
фенілаланін,
тирозин. При
обробці білків концентрованою азотною
кислотою білок спочатку випадає в осад,
а при нагріванні розчиняється. Після
цього розчин набуває жовтого кольору,
який після додавання лугу переходить
в оранжевий.
Реактиви.
10% розчин NaOH, HNO3 (концентрована), 2% розчин яєчного білка.
Хід роботи.
Роботу проводити у витяжній шафі! В пробірку внести 1 мл розчину яєчного білка, додати 0,5 мл концентрованої азотної кислоти і обережно нагріти. З’явиться лимонно-жовте забарвлення. Після охолодження в пробірку внести 2 мл гідроксиду натрію. Забарвлення зміниться з жовтого на оранжеве. Результати спостережень занести до таблиці.
4) Реакція Фоля
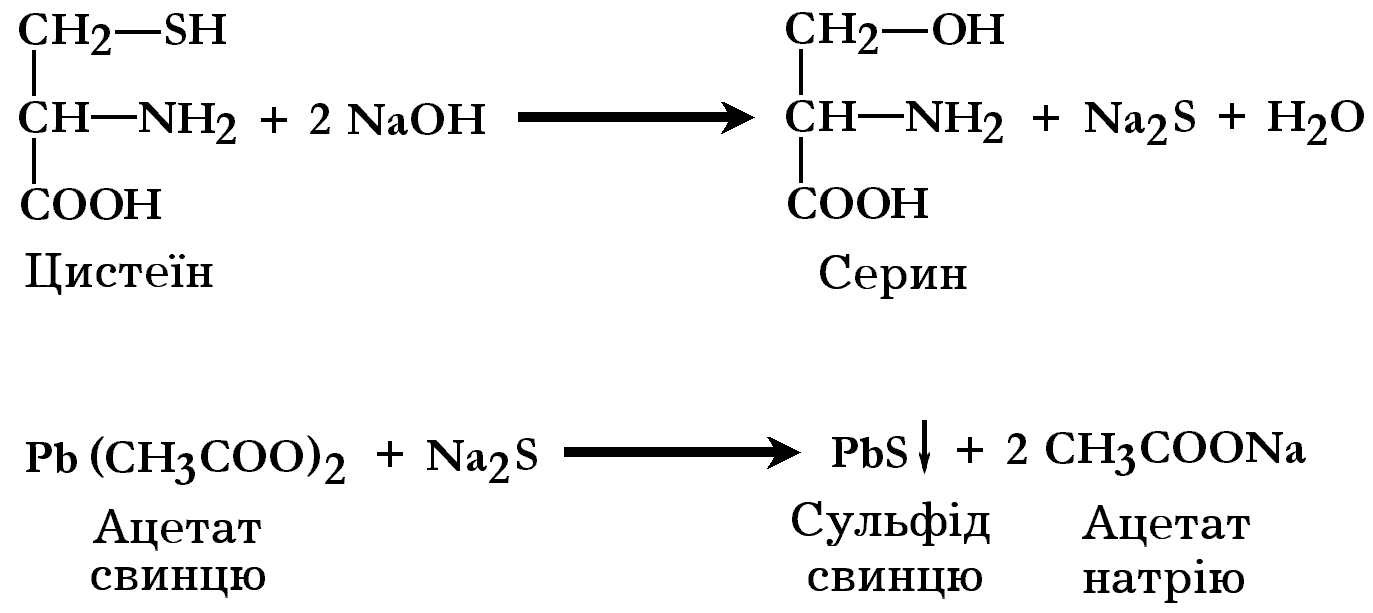
Ця реакція так само, як і ксантопротеїнова залежить від наявності певних амінокислот в молекулах білків. Її принцип полягає в тому, що сірковмісні амінокислоти (цистин, цистеїн та метіонін) білків при нагріванні в присутності NaOH руйнуються з утворенням сірчистого натрію:
Сірчистий натрій реагує з ацетатом свинцю з утворенням чорного осаду сульфіду свинцю:
Реактиви.
1% розчин яєчного білка, 1% розчин желатини, 5% розчин ацетату свинцю, 30% розчин NaOH.
Хід роботи.
В першу пробірку налити 1 мл 1% розчину яєчного білка, а в другу – 1 мл 1% розчину желатини. Потім в обидві пробірки додати по 1 мл розчину гідроксиду натрію і по одній краплі 5% розчину ацетату свинцю. Нагрівати впродовж трьох хвилин. Результати спостережень занести в таблицю.
5) Реакція Адамкевича
Принцип реакції полягає в тому, що амінокислота триптофан, яка міститься в білку, в кислому середовищі взаємодіє з альдегідами або альдегідокислотами з утворенням забарвлених продуктів конденсації. Інтенсивність забарвлення залежить від кількості триптофану в білках. Концентрована сірчана кислота бере участь у реакції як гігроскопічна речовина.
Реактиви.
1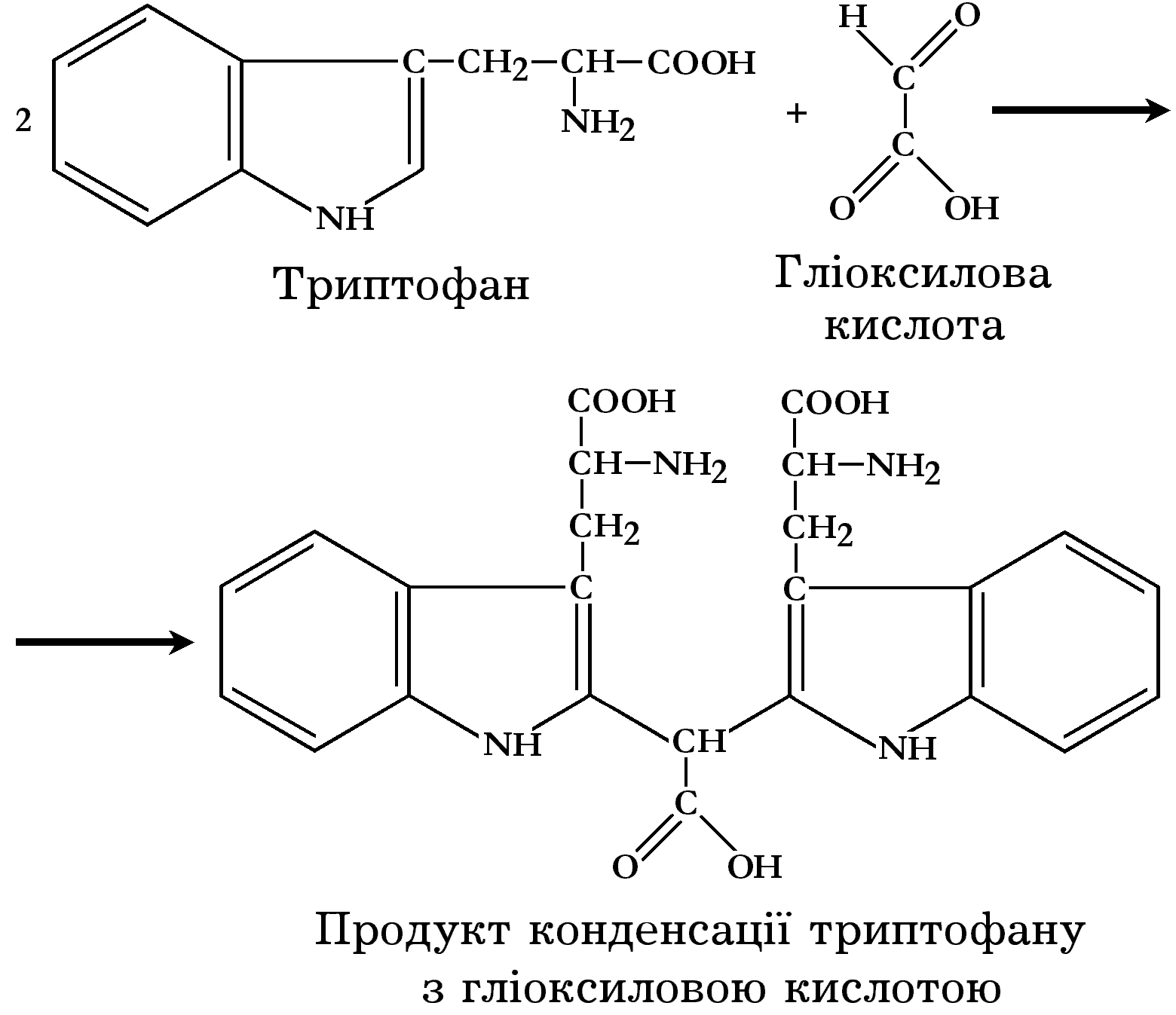 %
розчин яєчного білка, 10% розчин желатини,
5% розчин сахарози, оцтова кислота,
сірчана кислота.
%
розчин яєчного білка, 10% розчин желатини,
5% розчин сахарози, оцтова кислота,
сірчана кислота.
Хід роботи.
Роботу проводити у витяжній шафі! В першу і другу пробірки налити по 1 мл 1% розчину яєчного білка, в третю – 1 мл 1% розчину желатини. Потім у першу пробірку додати 1 мл 5% розчину сахарози, в другу і третю пробірки – по 1 мл концентрованої оцтової кислоти. Розчини спочатку нагріти, потім охолодити і, нахиливши пробірки, в кожну з них обережно по стінках влити по 2 мл концентрованої сірчаної кислоти так, щоб рідини не змішувались. Помістити пробірки в киплячу водяну баню. Результати спостережень занести до таблиці:
Назва реакції |
Досліджуваний матеріал |
Реактиви |
Забарвлення |
Чим зумовлена реакція |
|
|
|
|
|
