
- •2 Загорання
- •2.1. Основні поняття хімічної кінетики
- •2.2. Теплова теорія Самозапалювання
- •2.3. Границя самозаймання
- •2.4. Період індукції
- •2.5. Температура самозаймання газів і рідин
- •2.6. Температура самозаймання твердих тіл
- •2.7. Математична теорія теплового вибуху
- •Тепловий вибух в неадіабатичних умовах
2.7. Математична теорія теплового вибуху
Перебіг екзотермічної хімічної реакції в будь яку ізольовану (замкнуту) систему повинно привести до вибуху.
Адіабатичний тепловий вибух
Розглянемо граничний випадок - адіабатичну (теплоізольовану) систему, в якій протікає екзотермічна хімічна реакція. Швидкість реакції описується кінетичним рівнянням
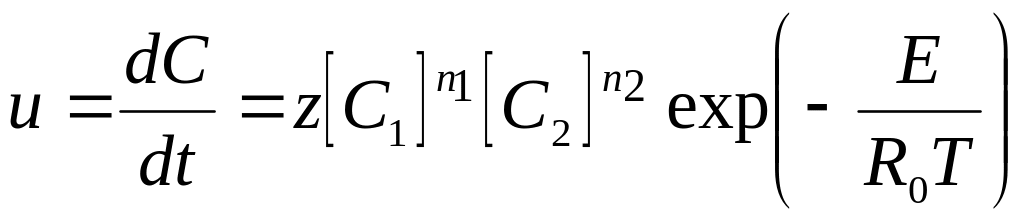
де С, С1, С2 - концентрації продуктів реакції і реагентів;
z, E - предекспонент і енергія активації;
Т - абсолютна температура;
R0 - універсальна газова постійна;
n1, n2 - Порядок реакції по першому і другому реагентів.
Нехай q - тепловий ефект реакції на один моль продукту С, що утворюється в ході реакції. Оскільки система теплоізольована і займає постійний обсяг, то швидкість зміни температури Т в системі визначається рівнянням
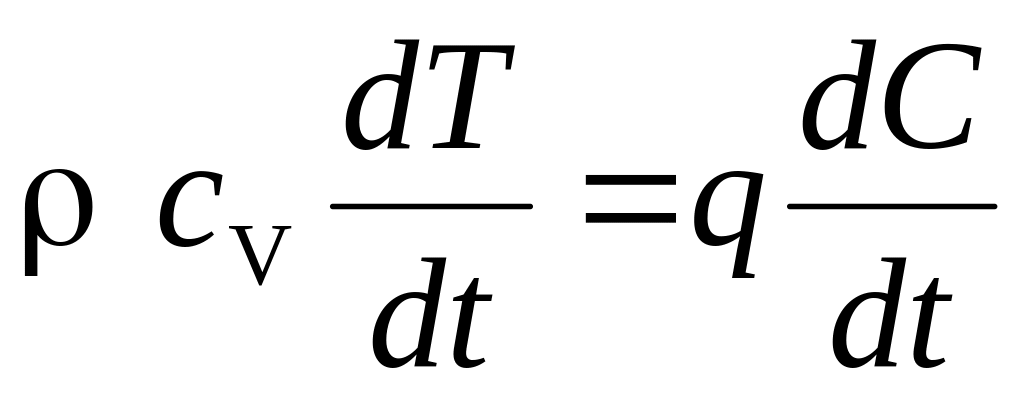
де
-
![]() питома
теплоємність
при
постійному
обсязі;
питома
теплоємність
при
постійному
обсязі;
ρ - щільність суміші.
Припустимо, що q >> сV T0 (початкової енергії системи).
Тоді протікання екзотермічної реакції в ізольованій системі буде приводити до істотного підвищення температури навіть при малому вигорянні вихідних компонентів суміші. Рівняння (2.2) з урахуванням (2.1) можна представити у вигляді
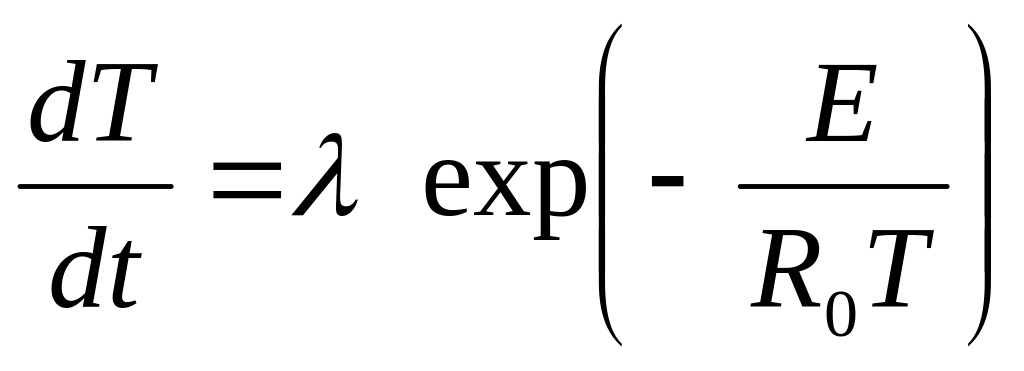
де
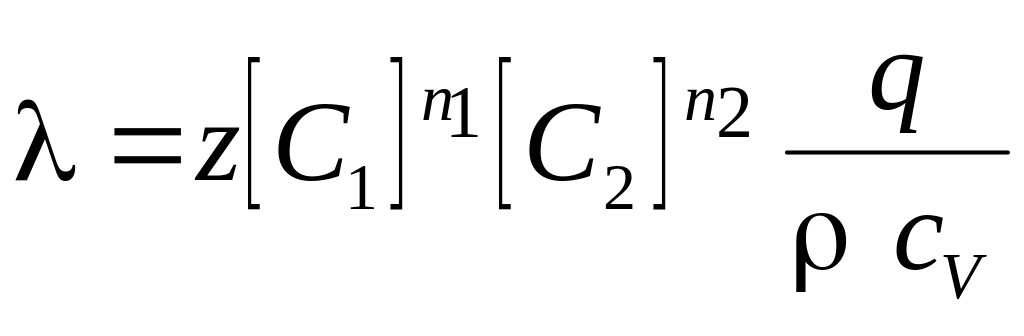
Інтегруючи рівняння (2.3) з урахуванням початкової умови Т (t = 0) = T0, одержимо
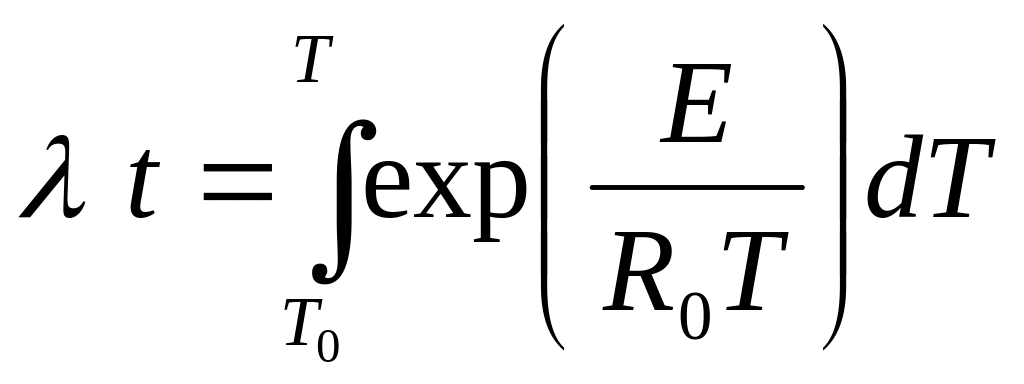
Або
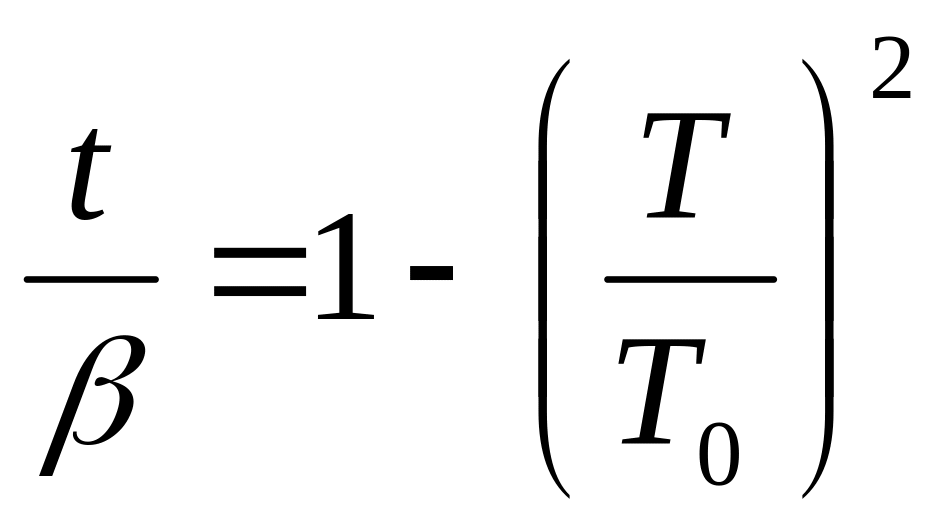
Де
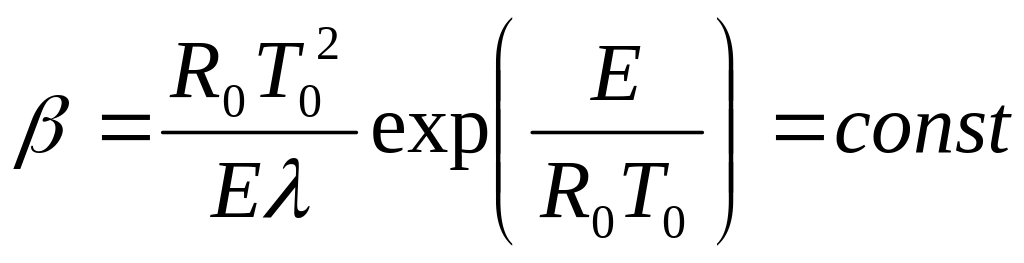
Результати розрахунків за рівнянням (2.4), наведені на рис. 2.7, показують, що зі зростанням часу t температура Т плавно зростає до моменту часу t/β = 1, а потім зростання температури різко прискорюється. Це явище називається тепловим вибухом. Проміжок часу tв = називається періодом індукції (часом затримки запалення) теплового вибуху в теплоізольованій системі з екзотермічною реакцією:
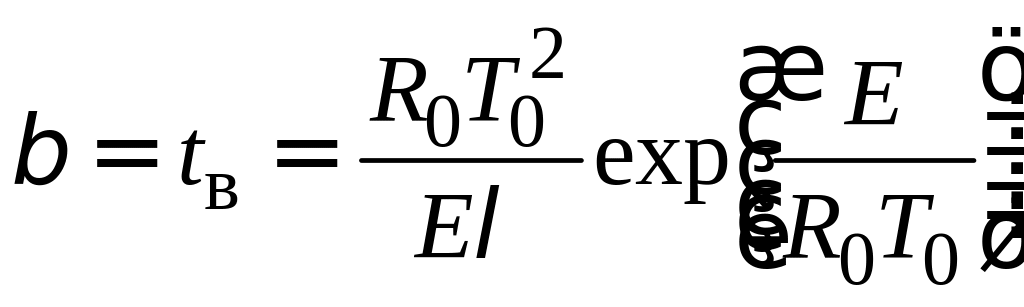

Рис. 2.7. Залежність температури адіабатичної системи від часу для різних значень параметра Е/(R0T0)
З графіків, наведених на рис. 2.7, випливає, що зі збільшенням початкової температури Т0 час затримки запалення (період індукції) tв знижується.
Тепловий вибух в неадіабатичних умовах
У реальних системах завжди відбуваються втрати теплоти за рахунок теплопровідності через стінки, конвекції, випромінювання і т.д. При цьому екзотермічна реакція буде або прискорюватися, призводячи до вибуху, або протікати з постійною швидкістю при постійній температурі T=const, яка визначається тепловим балансом системи. Так, зокрема, протікають екзотермічні реакції горіння в газових печах, котельних топках та інших теплотехнічних агрегатах. При наявності теплових втрат рівняння (2.2) набуде вигляду
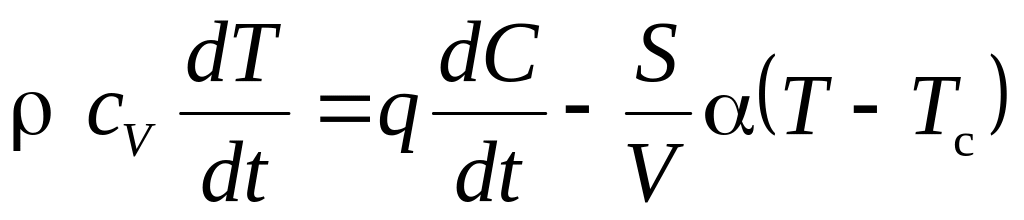
де V - об'єм реактора;
S - площа поверхні стінок реактора;
Tс - температура стінок реактора;
α - коефіцієнт теплопередачі.
Перша
складова різниці
в правій
частині
рівняння
(2.5)
описує
швидкість
виділення
тепла
в
системі
за
рахунок
хімічної
реакції.
Друга
складова
-
швидкість
відводу
тепла
за
рахунок
теплопровідності
стінок,
яка
лінійно
залежить
від
температури
реагуючої
суміші.
Швидкість
припливу
тепла
зростає
по
статичному
закону
із
зростанням
початкової
концентрації
компонентів
![]() ,
,![]() і
експоненціально
зростає
із
зростанням
температури
T
відповідно
до закону Арреніуса.
і
експоненціально
зростає
із
зростанням
температури
T
відповідно
до закону Арреніуса.
Позначимо
через
![]() графіки
залежності
швидкості
тепловиділення
Q
+
і
швидкості
тепловтрат
Q-від
температури
Т,
які наведені
на
рис.
2.8
для
трьох
значень
D:
графіки
залежності
швидкості
тепловиділення
Q
+
і
швидкості
тепловтрат
Q-від
температури
Т,
які наведені
на
рис.
2.8
для
трьох
значень
D:
D1 > Dкр > D2.
З аналізу наведених графіків, які представляють собою діаграму Семенова, випливає, що при D = D1, криві Q +, Q-не мають точок перетину; при D = Dкр, криві Q+, Q-мають одну точку дотику; при D = D2, криві Q +, Q-мають дві точки перетину. У першому випадку (D = D1) швидкість тепловиділення завжди перевищує швидкість тепловтрат, і в системі обов'язково відбудеться тепловий вибух, так як температура суміші буде необмежено зростати. Другий випадок (D = Dкр), коли має місце торкання кривих тепловиділення і тепловтрат, визначає максимальне значення концентрації реагентів (параметра D), при якому швидкість тепловиділення дорівнює швидкості тепловтрат.

Рис. 2.8. Вплив температури неадіабатичної системи на швидкість тепловиділення та швидкість тепловтрат
Всі інші криві Q + для більш низьких значень концентрації реагентів перетинають криву Q-двічі. Причому, стійкому стану системи відповідає лише нижня точка з більш низькою температурою Туст.
Таким чином, якщо концентрація реагентів не перевищує певного критичного для даної системи значення, то температура суміші в реакторі буде постійною T = Туст т = const, причому Туст > Тс.
При виконанні цієї умови після деякого перехідного періоду в хімічному реакторі встановлюється стаціонарний режим, при якому швидкість екзотермічної реакції буде мати постійне значення u = const. На рис. 2.9 наведено три режими роботи реактора у вигляді залежності температури від часу T = f(t).

Рис. 2.9. Режими роботи реактора
Температура Т2 відповідає максимальній температурі в реакторі, при якій можливо стійке протікання хімічної реакції (при заданих значеннях С1, С2, Тс). Можна показати,що величина Т2 визначається формулою
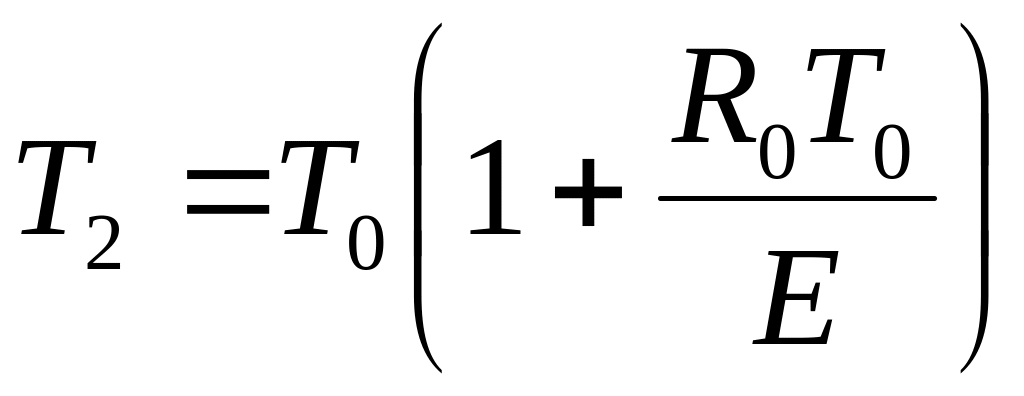
Температура Т2 пов'язана з параметрами реактора наступним співвідношенням:
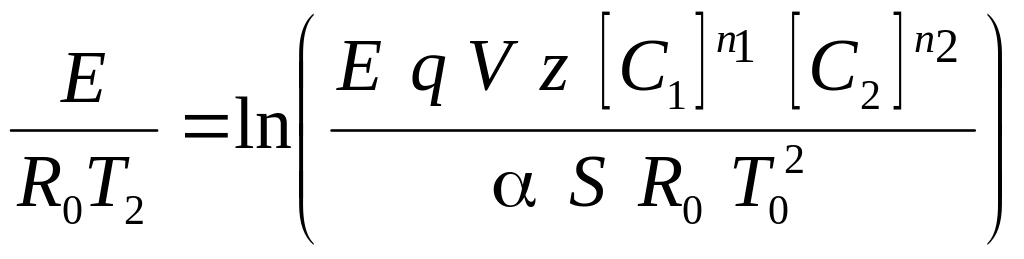
Це рівняння дозволяє визначити вибухобезпечність кожного конкретного реактора. Позначимо
Z1
=
![]() ,
,
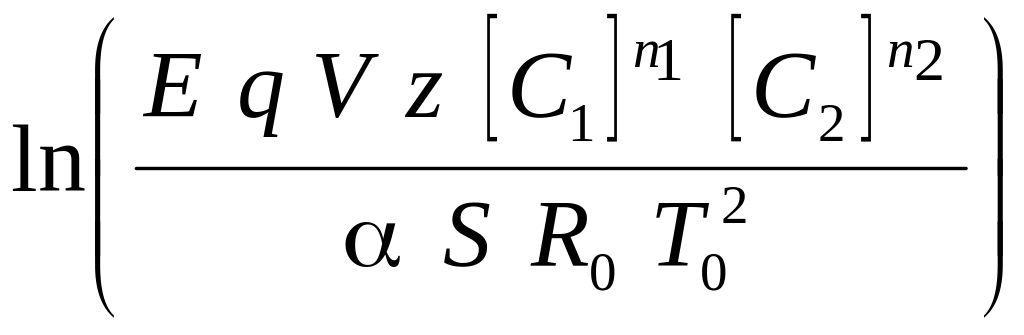
Якщо Z2 Z1, то реактор вибухобезпечний, якщо Z2 Z1, то ситуація є критичною,тобто можна очікувати вибуху; при Z2 Z1 в реакторі обов'язково відбудеться тепловий вибух. Для розрахунку тиску в реакторі по відомій швидкості зростання температури dT/dt використовується рівняння стану (рівняння Менделєєва-Клапейрона)
![]()
де p, , T, R - тиск, щільність, абсолютна температура і газова постійна продуктів згоряння в реакторі. Газова постійна продуктів згоряння R розраховується за формулою
R = cp – cv,
де cp, cv - питомі теплоємності продуктів згоряння при постійному тиску і постійному об’ємі, відповідно.
