
- •2 Загорання
- •2.1. Основні поняття хімічної кінетики
- •2.2. Теплова теорія Самозапалювання
- •2.3. Границя самозаймання
- •2.4. Період індукції
- •2.5. Температура самозаймання газів і рідин
- •2.6. Температура самозаймання твердих тіл
- •2.7. Математична теорія теплового вибуху
- •Тепловий вибух в неадіабатичних умовах
2 Загорання
Горіння всіх речовин починається з їх займання. У більшості горючих речовин момент займання характеризується появою полум'я. У тих речовин, які горять без полум'я, наприклад, у термітних складів, які використовуються для зварювання металів, момент займання характеризується появою свічення. Відомі два види займання речовин – самозаймання і запалювання (вимушене займання). При самозаймання рівномірно нагрівається вся горюча суміш. При запаленні використовується явище розповсюдження фронту полум'я від місцевого відносного невеликого за розмірами джерела запалювання (полум'я, іскра, і т.п.).
Таким чином, запалювання являє собою два послідовних процесу – спочатку початкове осередкове запалення, яке викликає первинне полум'я, і потім поширення полум'я від джерела по всьому об'єму горючої суміші.
2.1. Основні поняття хімічної кінетики
Наведемо короткі відомості з хімічної кінетики - науки про механізм і швидкості хімічних реакцій. Найважливіша величина – швидкість хімічної реакції – визначається зміною в часі кількості будь-якого з вихідних речовин або продуктів реакції в результаті хімічного перетворення. Хімічні реакції можуть протікати гомогенно (в обсязі однієї фази) або гетерогенно (на поверхні розділу фаз). Швидкість гомогенної реакції - це кількість речовини, що вступає в реакцію або утворюється в результаті реакції в одиницю часу в одиниці об'єму. Для реакцій, що протікають в системах постійного об’єму
![]()
де
![]() – концентрація i-го
речовини,
– концентрація i-го
речовини,
![]() або
або
![]() ;
;
![]() – швидкість
реакції по i-му
речовині,
– швидкість
реакції по i-му
речовині,
![]() або
або
![]()
Якщо
i-а
речовина – продукт реакції, то
![]() ,
вихідна речовина, то
,
вихідна речовина, то
![]() .
.
Хімічні реакції діляться на прості і складні. Проста реакція протікає в одному напрямку і в один етап; кінетична схема має такий вигляд
![]()
де
![]() – вихідні речовини;
– вихідні речовини;
![]() – продукти реакції.
– продукти реакції.
До складних належать оборотні реакції (одночасно протікають у двох протилежних напрямках)
![]()
паралельні реакції, що описуються, в окремому випадку кінетичної схемою
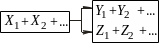
і послідовні реакції, наприклад
![]()
Для простої реакції можна записати стехіометричне рівняння
![]()
де
![]() -
стехіометричні
коефіцієнти,
відповідно
рівні
числам
молекул
вихідних
речовин
і
продуктів
реакції,
що беруть участь
в
елементарному
процесі.
-
стехіометричні
коефіцієнти,
відповідно
рівні
числам
молекул
вихідних
речовин
і
продуктів
реакції,
що беруть участь
в
елементарному
процесі.
Стехіометричне рівняння дозволяє встановити зв’язок між швидкостями простої реакції з різних компонентів:
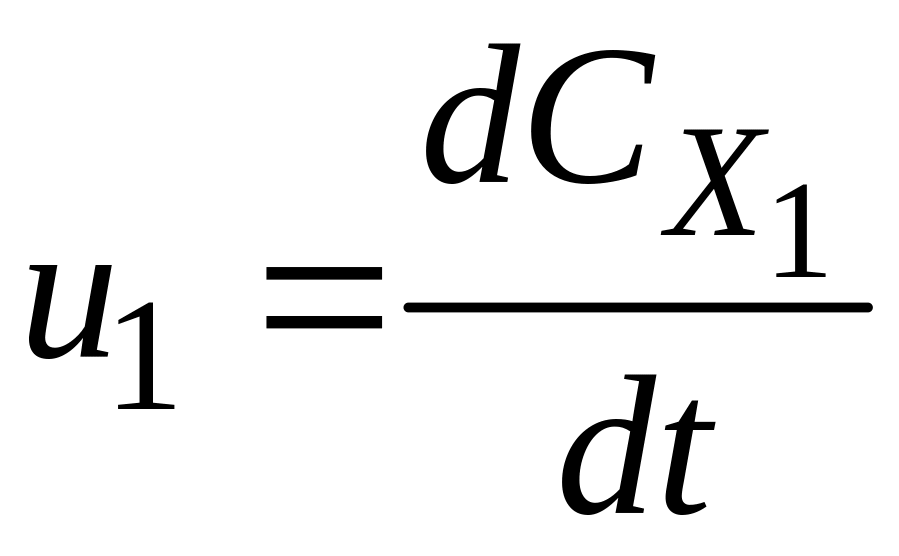 ;
;
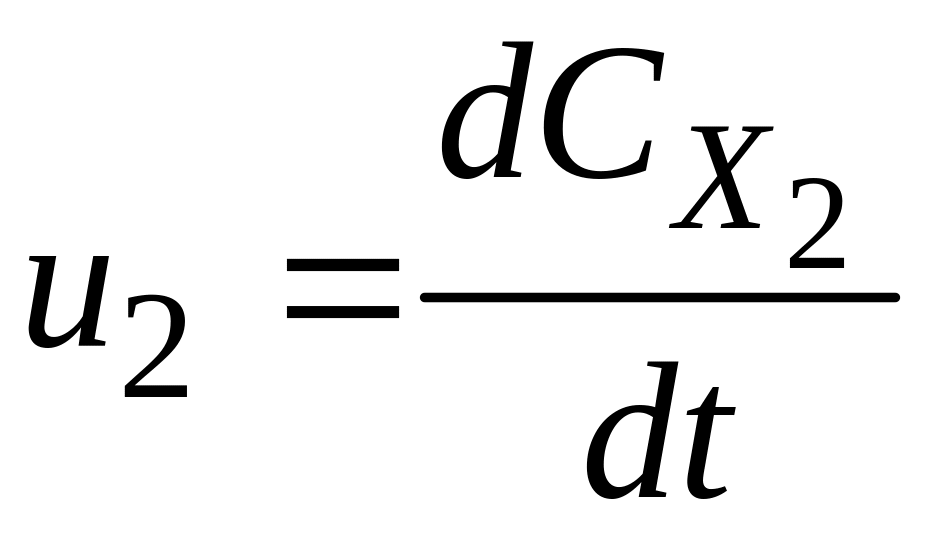 ;
;
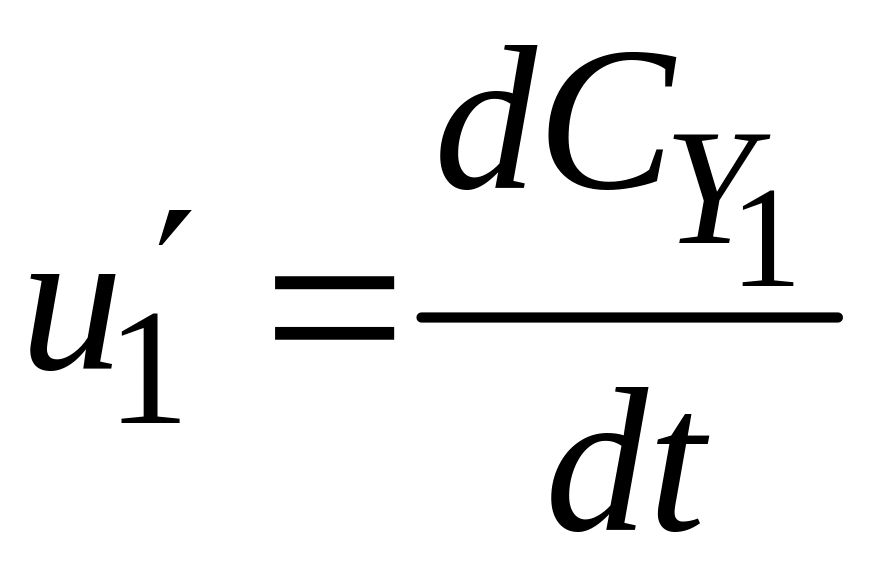 ;
;
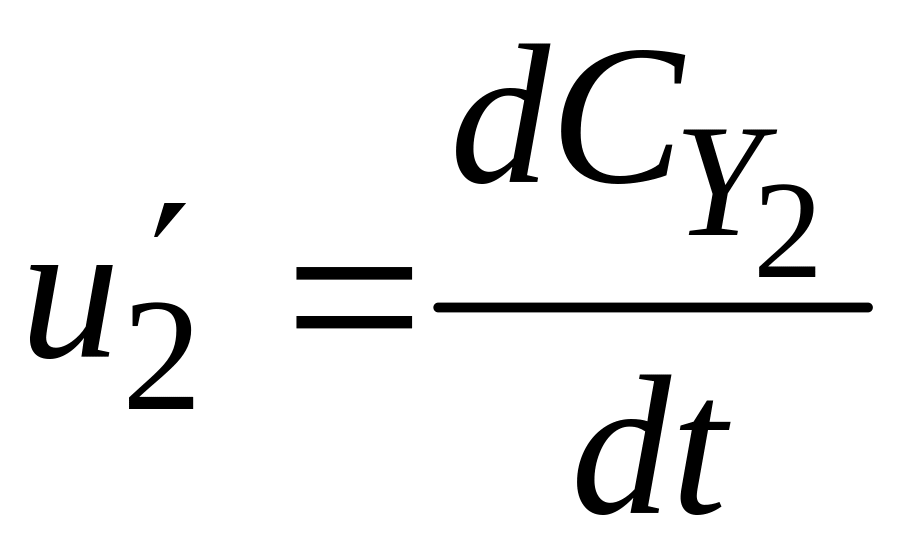
При квазістаціонарному протіканні процесу всі вихідні речовини повинні зникати, а продукти - з’являтися в результаті хімічної реакції в еквівалентних кількостях, тобто повинно задовольнятися умова стехіометрії:

Чим
більша
величина
,
тим
більше
по
модулю
повинна
бути
швидкість
реакції
![]() або
або
![]() (тобто
при
більшому
значенні
стехіометричного
коефіцієнта
більша
кількість відповідної речовини
реагує
в
одиницю
часу).
Звідси
випливає,
що
незалежно
від
вибору
речовини,
швидкість
реакції
можна
охарактеризувати
величиною
(тобто
при
більшому
значенні
стехіометричного
коефіцієнта
більша
кількість відповідної речовини
реагує
в
одиницю
часу).
Звідси
випливає,
що
незалежно
від
вибору
речовини,
швидкість
реакції
можна
охарактеризувати
величиною

Величина
![]() називається
швидкістю
простої
реакції
без
відношення
до
будь-якого
конкретного
компоненту.
Швидкість
простої
реакції
підкоряється
закону
діючих
мас
називається
швидкістю
простої
реакції
без
відношення
до
будь-якого
конкретного
компоненту.
Швидкість
простої
реакції
підкоряється
закону
діючих
мас
![]()
де k - константа швидкості реакції, чисельно рівна її швидкості при поодиноких концентраціях. Підкреслимо, що в це рівняння входять тільки концентрації вихідних речовин в ступені їх стехіометричних коефіцієнтів.
Сума
стехіометричних
коефіцієнтів
![]() ,
що дорівнює
кількості
молекул,
що беруть
участь
в
одиничному
акті,
називається стехіометричним
порядком
(молекулярна)
реакції:
,
що дорівнює
кількості
молекул,
що беруть
участь
в
одиничному
акті,
називається стехіометричним
порядком
(молекулярна)
реакції:
![]() -
Мономолекулярна
реакція;
-
Мономолекулярна
реакція;
![]() -
Бімолекулярний
реакція;
-
Бімолекулярний
реакція;
![]() -
Трімолекулярная
реакція.
-
Трімолекулярная
реакція.
Стехіометричний порядок простої реакції - завжди ціле число (не дрібне) і не перевищує трьох (ймовірність одночасного зіткнення більш ніж трьох молекул близька до нуля). Застосовувати закон діючих мас для розрахунку складних реакцій можна для одностадійної оборотної реакції, швидкість якої
![]()
де
![]() ,
,![]() -
Швидкості
реакції
в
прямому
і
зворотному
напрямках.
-
Швидкості
реакції
в
прямому
і
зворотному
напрямках.
За законом діючих масс
![]()
де,
![]() ,
,
![]() -
константи
швидкості
прямої
і
зворотної
реакцій.
-
константи
швидкості
прямої
і
зворотної
реакцій.
При величині u = 0, що відповідає хімічному рівноваги системи.
У загальному випадку для опису складної реакції потрібно кілька стехіометричних рівнянь. Складаючи їх, отримуємо брутто-рівняння реакції, що описує процес в цілому, але не відображає істинного механізму хімічних перетворень. Для складної реакції можна (на основі експериментів) записати рівняння, що зв'язує швидкість реакції з концентрацією вихідних речовин (кінетичне рівняння)
![]()
де
![]() -
порядок
реакції
по
i
-му
речовині;
-
порядок
реакції
по
i
-му
речовині;
![]() -
порядок
реакції
(кінетичний
порядок
реакції).На
відміну
від
кінетичний
порядок
реакції
n
може
бути
дробовим
числом.
Розмірність
константи
швидкості
реакції
k
залежить
від
її
порядку:
-
порядок
реакції
(кінетичний
порядок
реакції).На
відміну
від
кінетичний
порядок
реакції
n
може
бути
дробовим
числом.
Розмірність
константи
швидкості
реакції
k
залежить
від
її
порядку:
для
![]() ,
,
![]() ;
;
для
![]() ,
,
![]() ;
;
для
![]() ,
,
![]() ,
,
де
![]() -
прийнята
розмірність
концентрації.
Різниця
в
розмірності
константи
швидкості
реакції
-
прийнята
розмірність
концентрації.
Різниця
в
розмірності
константи
швидкості
реакції
![]() пов'язано
з
тим,
що
розмірність
швидкості
реакції
завжди
повинна
бути
пов'язано
з
тим,
що
розмірність
швидкості
реакції
завжди
повинна
бути
![]() або.
або.
![]() .
.
Швидкість переважної більшості реакцій (простих і складних) підвищується з ростом температури Т, а константа швидкості реакції підпорядковується закону Арреніуса
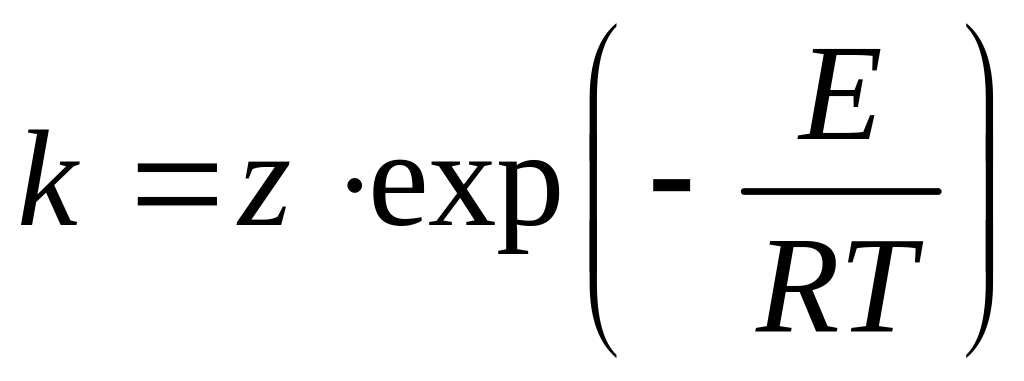
де z - предекспонент (предекспоненціальний множник, частотний фактор), розмірність якого дорівнює розмірності константи швидкості реакції [z] = [k];
Т - абсолютна температура, К;
E - енергія активації реакції, Джмоль-1;
R0 = 8.3134 ДжК-1моль-1- Універсальна газова стала.
Безрозмірний показник експоненти в законі Арреніуса називається критерієм Арреніуса:
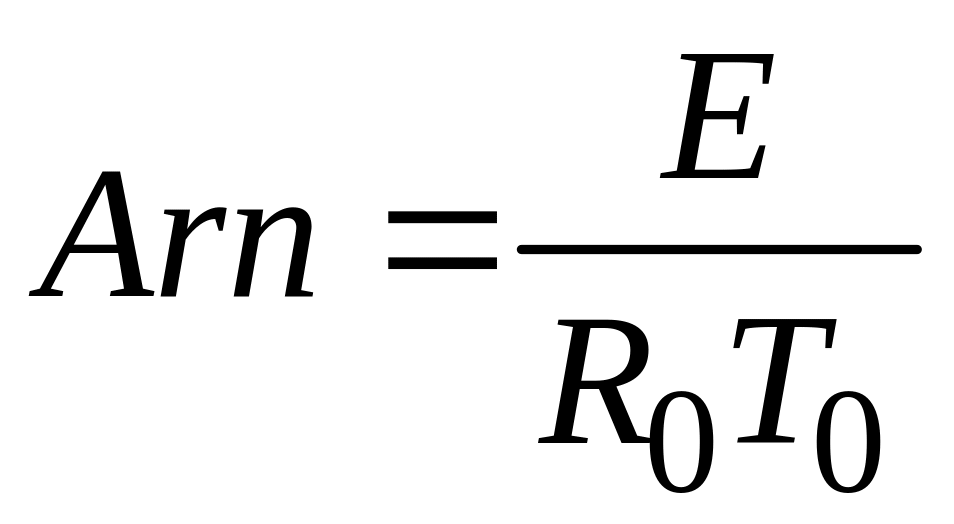
де
![]() -
характерна
температура.
-
характерна
температура.
Цей критерій виражає чутливість швидкості хімічної реакції до зміни температури. Чим вище значення Arn, тим сильніше ця чутливість. Вхідні в закон Арреніуса величини z і E називаються кінетичними константами хімічної реакції. Фізичний сенс енергії активації Е для простої реакції полягає в тому, що це енергія, якою повинна володіти молекула для того, щоб вступити в реакцію. Для складних реакцій Е не має простого фізичного сенсу. Значення z, Е визначаються, як правило, експериментальним шляхом. Кінетичні константи повністю визначають швидкість протікання кожної конкретної реакції, в тому числі і реакції займання або горіння. Завдання експериментального визначення цих констант є найважливішою при дослідженні фізико-хімічних процесів в високоенергетичних установках.
Хімічна
реакція
проходить
з
виділенням
тепла
(екзотермічна
реакція),
або з його поглинанням
(ендотермічна
реакція).
Якщо
пряма
реакція
-
екзотермічна,
то
зворотна
-
ендотермічна.
Кількість
тепла,
що виділяється
при
повному
реагуванні
одиниці
кількості
речовини
(1
моль
або
1
кг),
називається
тепловим
ефектом
реакції.
Розмірність теплового
ефекту
реакції
![]() або
або
![]() .
.
