
Изучение свойств фенола
Цель: изучить экспериментально основные свойства фенолов и отработать методику проведения качественных реакций.
Реактивы и материалы: фенол жидкий и кристаллический СбН5ОН; серная кислота H-SO^; хлорид железа (III) FeCI3; гидроксид натрия NaOH, 2Н; универсальная индикаторная бумага; насыщенный раствор Вг, (бромная вода).
Оборудование: штатив с пробирками, вытяжной шкаф, фильтровальная бумага, пробки с газоотводными трубками, предметные стёкла, стеклянные палочки, .микролопатки, фарфоровые чашки, водяная баня.
Опыт №1 Растворение фенола в воде
В пробирку помещают 2 капли жидкого фенола, 2капли воды и взбалтывают. Образуется мутная жидкость - эмульсия фенола, которая быстро расслаивается: верхний слой - раствор фенола в воде, нижний - раствор воды в феноле. Фенол плохо растворим в холодной воде. Осторожно нагревают содержимое пробирки, получается однородный раствор. При охлаждении жидкость вновь мутнеет. При повышении температуры вырастает растворимость как воды в феноле, так и фенола в воде, и при 68 С" они смешиваются в любых соотношениях.
Опыт №2 Получение фенолята натрия
В пробирку помещают 4 капли эмульсии фенола 8 воде и добавляют 2 капли раствора гидроксида натрия. Сразу же образуется прозрачный раствор фенолята натрия, т. к. он хорошо растворяется в воде. Раствор оставляют для следующего опыта. Химизм процесса:
С6Н5ОН + NaOH -> QH5ONa + Н?0
Фенолы обладают кислотными свойствами, они легко вступают в реакцию с водными растворами шелочей, образуя аналогичные алкоголятам феноляты. Более сильный характер Фенолов объясняется влиянием бензольного ядра
Опыт №3 Разложение фенолята натрия соляной кислотой
К прозрачному раствору фенолята натрия добавляют 1 каплю раствора соляной кислоты. Жидкость вновь мутнеет вследствие образования свободного фенола.
и
C6H5ONa + HCI ChH5OH + NaCI
Феноляты щелочных металлов, как и соли очень слабых кислот при действии воды подвергаются гидролизу с образованием щёлочи и фенола, поэтому их растворы обладают щелочной средой. Фенолы можно выделить из растворов фенолятов даже такой слабой кислоты как угольная.
Опыт №4 Реакция фенола с хлоридом желез-;(111)
В пробирку помещают 2 капли жидкого фенола, 3 капли воды и 1 каплю хлорного железа. Появляется интенсивное красно-фиолетовое окрашивание вследствие образования окрашенного соединения C=H5OFeC!> или, точнее окрашенного иона C6h'5OFe " Эта реакция служит для качественного открытия фенолов.
Опыт №5 Получение трибромфенола
Химизм
процесса:
ОН
Вг ОН Вг
Вг
2,4,6
-
Трибромфенола
+ ЗНВг
В пробирку помещают несколько кристалликов фенола и добавляют три капли серной кислоты. Встряхивают содержимое пробирки: кристаллы фенола растворяются. Каплю получившегося раствора вносят в другую пробирку и добавляют 4-5 капель воды: фенол выделяется в виде мути. Реакционную смесь в первой пробирке нагревают на кипящей водяной бане в течение 2-3 минут, затем охлаждают пробирку и выливают содержимое в пробирку с 10 каплями холодной воды. Получается однородный раствор, почти не имеющий запаха, характерного для фенола.
Фенол сульфинируется; при сульфинировании образуется смесь о- и п-сульфакислот. Продукты сульфинирования растворимы в воде гораздо лучше, чем сами фенол.
Химизм процесса: (^N,— ОН
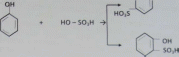
Опыт №7 Окисление фенола кислородом воздуха
В 2 фарфоровые чашки помещают по 1 микролопатке кристаллического фенола, кроме того во вторую чашку добавляют 1 каплю раствора гидроксида натрия.
ЛЦРР
Опыт
СлНгО^
CtHs-OH U^r С*HfiD-уF&-
СьНеОЧ f ЬНгО'
Ф
/л
Лабораторная работа N?3
■■
JT
Цель: экспериментально изучить свойства альдегидов и кетонов и отработать методику проведения качественных реакций.
Реактивы и материолы: метаналь - HCOH, 40% водный раствор (формалин); этаналь (уксусный альдегид) - CH-jCOH, фуксинсернистая кислота: гидроксид натрия (едкий натр) - NaOH, 2Н раствор; универсальная индикаторная бумага; гидроксид аммония - NH.-OH, 2Н раствоо; нитрат серебра AgN03, 0,2Н раствор; натриевая соль этановой кислоты (ацетат натрия) CH;C00Na, обезвоженный; соляная кислота НС1нони; диметилкетон CH,COCHB; нитропентацианоферрат (нитропруссид) натрия Na[Fe(CN)5(NO)], 0. 5Н раствор; раствор йода 12 в водном насыщенном растворе йодида калия К1.
Оборудование: штатив с пробирками, вытяжной шкаф, фильтровальная бумага, пробки с газоотводными трубками, спиртовка или сухое горючее, пробиркодержатели, предметные стёкла, стеклянные палочки.
76; опыты проводят в вытяжном шкафу!
Опыт №1 Цветная реакция на альдегиды с фуксинсернистой кислотой
В две пробирки помешают по две капли раствора фуксинсернистой кислоты, в первую добавляют 2 капли раствора метаналя, а во вторую 2 капли этаналя. Раствор фуксинсернистой кислоты при добавлении метаналя постепенно окрашивается в фиолетовый цвет, при добавлении этаналя - в розово-фиолетовый цвет.
Опыт №2 Альдольная конденсация
В пробирку помещают 2 капли этаналя и 2 капли раствора гидроксида натрия. Осторожно нагревают содержимое пробирки над пламенем спиртовки. Жидкость постепенно темнеет и буреет, появляется резкий запах.
Молекулы альдегидов могут соединяться друг с другом, образуя новые углерод-углеродные связи Происходит взаимодействие карбонильной группы одной молекулы альдегида с а-водородом метиленовой группы другой молекулы, а-нодород под влиянием соседней карбонильной группы способен отщепляться в виде поотона. /

Эта реакция происходит под действием щелочей и образуется карбанион: Н
б- 6-
н - С - СН = О + ОН <-> СН2СН = о + Н20
н
Образующийся карбанион реагирует с карбонильной группой другой молекулы альдегида (по схеме нуклеофильного присоединения):
Н'
сн3- СН + : • СН2СН = О -> сн3- сн - сн2- сн = о -> сн3- сн - сн2- сн = о
I I
О4" о- он
З-оксибуаналв
Эта реакция называется альдольной конденсацией (реакция Бородина).
Опыт №3 Самоокисление водных растворов метаналя
3 пробирку помещают 2-3 капли раствор метаналя и помещают полоску индикаторной бумаги. Полоска окрашивается в розовый цвет, что указывает на кислую реакцию.
Альдегиды очень легко окисляются. В водных растворах они могут окисляться в кислоту за счёт кислорода другой молекулы альдегида, восстанавливая ее в спирт - происходит реакция окислительного восстановления (дисмутации):
НСОН + н - С(ОН)2 - Н НСООН + СНзОН
Гмарэтмзя SODMJ Метэиовя* М--«»ол
мета-оло кис'.отг
Опыт Окисление альдегидов раствором оксида серебра в водном растворе гидроксида аммония (реакция «серебряного зеркала»)
В чистую пробирку вводят 2 капли раствора нитрата серебра и прибавляют 1 каплю раствора гидроксида аммония. Образующийся бурый осадок гидроксида аммония. Затем добавляют 1 каплю раствора метаналя и медленно подогревают содержимое пробирки над пламенем спиртовки, при этом содержимое пробирки буреет, а на стенках пробирки в виде зеркального налёта выделяется металлическое серебро (комплексный ион восстанавливается до свободного металла). Альдегид окисляется до кислоты, которая образует аммониевую соль.
Химизм процесса:
AgN03 + NH4OH AgOH + NHiN03 2AgOH Ag20 + H20 Ag20 + 4NH40H 2[Ag(NH3)2]0H + 3H20 HCOH + 2[Ag(NH3)z]0H HCOONH4+ 2Ag + 3NH3+ H20
Эта реакция является качественной на альдегиды.
Опыт №5 Получение диметилкетона (ацетона) из натриевой соли этановой кислоты (ацетата натрия)
В сухую пробирку помешают около 0, 1 грамма обезвоженной натриевой соли этановой кислоты (высота слоя около 3 мм). Закрывают пробирку пробкой с газоотводной трубкой, нижний конец которой опускают в пробирку с 5-6 каплями воды. Держа пробирку горизонтально, нагревают её в пламени спиртовки. Пары ацетона конденсируются в воде, находящейся зо второй пробирке. Ощушается характерный запах ацетона. После остывания первой пробирки добавляют в неё 1 каплю концентрированной соляной кислоты. Происходит сильное вспенивание вследствие образования диоксида углерода.
Химизм процесса: СН3- СО - ONa + NaO - СО - СН3 СН3-СО - СН3+NaO - СО - ONa Na2C03 + HCI С02 ♦ NaCI + Н20
Опыт №6 Цветная реакция на диметилкетон (ацетон) с нитропентацианофеоратом (нитропруссидом) натрия
На предметное стекло наносят 1 каплю раствора нитропруссида натрия, 2 капли воды и 1 каплю раствора едкого натра, смесь окрашивается в красный цвет, который при добавлении уксусной кислоты приобретает вишнёво-красный оттенок.
Опыт -№7 Получение 3-йодметана (йодоформа) из диметилкетона (ацетона)
В пробирку помещают 3 капли раствора йода в водном растворе йодида калия и добавляют 5 капель раствора гидроксида натрия. Раствор обесцвечивается. К обесцвеченному раствору тиойодата натрия добавляют 1 каплю диметилкетона. Мгновенно без нагревания выпадает
жёлтовато-белый осадок с характерным запахом трийодметана (йодоформа).
Химизм процесса:
l2+ 2NaOH NaOl + Nal + Н20 СН3- СО - СН3+ 3NaOI СН3- СО - Cl3+ 3NaOH СН3- СО - Cl3+ NaOH СН3-СО - ONa + СН13
Эта реакция очень чувствительна, используется для открытия ацетона.
Опыт №3 Бромиоование предельных УВ
В сухую пробирку помещают 4 капли смеси жидких алканов и добавляют 1-2 капли раствора брома. Содержимое пробирки перемешивают на холоду. Окраса брома при этом не исчезает. Нагревают содержимое пробирки до исчезновения окраски. В отверстие пробирки вносят стеклянную палочку, смоченную раствором гидроксида аммония, при этом появляется белый дымок бромида аммония NH.-Br. Пинцетом вносят в пробирку синюю лакмусовую бум эр/, смоченную водой (бумага краснеет).
Химизм процессс:
СН?-СН-СН2-СН3 + Br2 -> СН3-CBr - CH2-СН3+ НВг
СН3 СН3
г-метилбутас 2-бром-2-л«етилбутдм
Реакция бромирования жидких алканов сопровождается выделением бромоводорода и проходит значительно медленнее бромирования газообразных алканов. Бромирование ускоряется при вводе катализаторов (например, железных опилок). Легче всего галогенируются УВ с третичным атомом углерода в молекуле, труднее всего замещается водород при первичном атоме углерода.
Опыт i\|o й Действие концентрированной сеоной кислоты на алканы
В пробирку помещают 2 капли жидкого алкана и 2 капли серной кислоты. Содержимое пробирки энергично перемешивают в течение 1-2 минут, охлаждая пробирку холодной водой. В условиях опыта алканы с серной кислотой не реагируют.
г
Лабораторная работа N88
Изучение свойств кэрбоновых кислот
Цель: экспериментально изучить свойства карбоновых кислот
Реактивы: этановая кислота - СН,ООН, ледяная; метиловый оранжевый, спиртовый раствор; фенолфталеин, спиртовый раствор; магний металлический - Mg, в виде стружек или порошка; карбонат натрия - Na2C03, сухой; калиевая соль метановой кислоты (муравьинокислый калий) - НСООК; серная кислота H2SOj.M.; гидроксид бария Ва(ОН)?, насыщенный водный раствор (баритовая вода); хлорид кальция (II) СаС12, 0,1Н раствор; универсальная индикаторная бумага.
Оборудование: штатив с пробирками, вытяжной шкаф, фильтровальная бумага, пробки с газоотводными трубками, пробиркодержатели.
Опыт №1 Кислотные свойства карбоновых кислот
В три пробирки помещают по 1 капле раствора уксусной кислоты. В первую добавляют 1 каплю метилового оранжевого, во вторую - каплю лакмуса, в третью - каплю фенолфталеина.
В пробирку помещают 2 капли этановой кислоты и добавляют немного магния. К отверстию подносят горящую лучину, при этом наблюдается вспышка, сопровождаемая резким запахом.
Химизм процесса:
2СН$ООН + Mg (CH£)0)2Mg + Н2
В пробирку наливают 2-3 капли этановой кислоты и добавляют несколько крупинок карбоната натрия. К отверстию пробирки подносят горящую лучину. Лучина гаснет.
Химизм процесса:
2СНРОН + Na2C03 -> 2CH£)ONa + С02 + Н20
Опыт №2 Окисление муравьиной кислоты перманганатом калия
В пробирку помещают несколько крупинок муравьиной кислоты, добавляют 2 капли раствора перманганата калия и 3 капли серной кислоты. Отверстие пробирки закрывают пробкой с газоотводной трубкой, конец которой опускают в пробирку с раствором гидроксида бария. Содержимое пробирки нагревают над пламенем горелки. Химизм процесса:
НС00Н+[0] -»со2+н2о
Опыт №3 Разложение муравьиной кислоты при нагревании с концентрированной серной кислотой
В пробирку приливают 3 капли муравьиной кислоты, 3 капли концентрированной серной кислоты и нагревают смесь в пламени горелки.
Химизм процесса: h,so<
НСООН -» С02 + Н20
Опыт №4 Образование и гидролиз ацетата железа
3 пробирку помещают несколько кристаллов ацетата натрия, 3 капли воды, 2 капли раствора хлорида железа. Раствор нагревают до кипения.
Химизм процесса:
3CH£OONa + FeCI3 -> (CHiPO)3Fe + 3NaCI
Опыт №5 Окисление щавелевой кислоты перманганатом калия
В пробирку помещают несколько кристаллов щавелевой кислоты, добавляют 2 капли перманганата калия и 1 каплю серной кислоты. Отверстие пробирки закрывают пробкой с газоотводной трубкой, конец которой опущен в пробирку с баритовой водой. Реакционную смесь нагревают.
Химизм процесса: (о)
НООС - СООН со2 + н2о

//
Лабораторная работа Цд)
Изучение свойств жиров
Цель: отработать методику проведения качественных реакций на жиры и изучить их свойства.
Реактивы и материалы: масла сливочное, растительное; твёрдый жир, карбонат натрия - Na2C03, 2Н; гидроксид натрия, 15% спиртовой раствор; перманганат калия КМп04, О, 1Н; хлорид натрия NaCUr.^; гидросульфат калия KHS04 крисгал./ универсальная индикаторная бумага.
В. Оборудование: штатив с пробирками, вытяжной шкаф, фильтровальная бумага, пинцет, пробки с газоотводными трубками, пробиркодержатели. 4. Опыт №1 Окисление растительных масел перманганатом калия
В пробирку помещают 2 капли растительного масла, добавляют 2 капли раствора карбоната натрия и 2 капли перманганата калия. Встряхивают содержимое пробирки. Малиновая окраска перманганата калия исчезает, что указывает на окисление глицеридов высших непредельных карбоновых кислот, входящих в состав растительного масла.
Химизм процесса:
CHZ- О - СО - (СН2)7 - СН = СН - (СН2)7 - СН3
СН -0-С0-(СН2)7-СН = СН-(СН2)7-СН3 + 3[0] + ЗН-ОН-»
I
СН2- О - СО - (СН2)7 - СН = СН - (СН2)7 - СНз
СН2- О - СО - (СН2)7 - СН(ОН) - СН(ОН) - (СН2)7 - сн3 СН - О - СО - (СН2)7 - СН(ОН) - СН(ОН) - (СН2)7 - сн3 СН2- О - СО - (СН2)7 - СН(ОН) - СН(ОН) - (СН2)7 - СН3
Опыт № 2 Образование пропеналя при разложении жира
В сухую пробирку помещают 2-3 кристалла гидросульфата калия и каплю жидкого жира или кусочек твёрдого. Пробирку нагревают при встряхивании, затем держа пробирку горизонтально, нагревают смесь
на пламени горелки более сильно. Смесь чернеет, выделяются пары воды и другие летучие продукты. Ощущается характерный запах пропеналя:
СН = СН - С = О
I
н
При термическом разложении жиров образуется сложная смесь продуктов, среди которых имеется свободный глицерин, сложными эфирами которого являются жиры. В присутствии водоотнимающих средств, например гидросульфата калия или натрия, глицерин превращается в пропеналь.
Опыт №3 Омыление жиров в водно-спиртовом растворе
В широкую пробирку помещают 2 грамма жира и добавляют 6 мл спиртового раствора щёлочи. Содержимое пробирки перемешивают стеклянной палочкой и нагревают до кипения на водяной бане. Омыление ведут 3-5 минут, пока жидкость не станет однородной.
Для определения конца омыления помещают в сухую пробирку несколько капель полученной смеси, добавляют 4-5 мл воды и нагревают содержимое пробирки при встряхивании на пламени спиртовки. Если смесь растворяется в воде полностью, без выделения капель жира, то омыление можно считать законченным. Если выделяются капли жира, то продолжают нагревать смесь на водяной бане ещё несколько минут, а затем снова проверяют полноту омыления.
К полученной густой жидкости добавляют 6-7 мл NaCL^m Жидкость мутнеет и выделяется слой мыла, всплывающий на поверхность. Дают отстояться, затем охлаждают пробирку. Затвердевшее мыло отделяют.
Химизм процесса:
СН2-0-С0-Са7Н35 сн2он
СН -0-С0-Сг7Н35 + 3NaOH 3 C17H3SCOONa + СНОН

СН2-0-С0-С17Нз5 СН2ОН
Будучи сложными эфирами, жиры подвергаются гидролизу с образованием глицерина и смеси высших жирных кислот. Большое значение имеет гидролиз - образуется глицерин и мыло
Лабораторная работа
Изучение свойств моно- и полисахаридов
Цель: отработать методику проведения качественных реакций на углеводы и изучить их свойства.
Реактивы и материалы: нитрат серебра AgN03, 0,2 Н; гидроксид натрия NaOH, 2Н; соляная кислота HCI, 2Н; серная кислота H;SOj, 10%; глюкоза С6Н1206,0, 5%; сахароза С12Н22О10,1%; сульфат меди (II) CuS0o 0, 2Н; крахмал; йод, насыщенный раствор; гидроксид меди Си(ОН)2; универсальная индикаторная бумага.
Оборудование: штатив с пробирками, вытяжной шкаф, фильтровальная бумага, пинцет, пробки с газоотводными трубками, пробиркодержатели.
Опыт №1 Окисление глюкозы аммиачным раствором оксида серебра
В пробирку помещают 1 каплю раствора серебра и приливают по каплям раствора гидроксида аммония до растворения образовавшегося осадка гидроксида серебра. Затем добавляют 1 каплю раствора глюкозы и слегка подогревают содержимое пробирки до начала почернения раствора. Дальше без нагревания. На стенках пробирки образуется нитрат серебра.
В состав глюкозы входит альдегидная группа, это подтверждается качественной реакцией - реакцией серебряной зеркала.
Опыт №2 Доказательство наличия гидроксильных групп в сахарозе
В пробирку помещают 1 каплю раствора сахарозы, 5 капель раствора щёлочи и 4-5 капель воды. Добавляют 1 каплю раствора сульфата меди. Выпадает ярко-голубой осадок.
Опыт №3 Кислотный гидролиз сахарозы
В пробирку помещают 1 каплю раствора сахарозы. 1 каплю раствора соляной кислоты. Добавляют 3 капли воды и осторожно нагревают на водяной бане 20-30 минут. Половину раствора отливают в другую пробирку и добавляют 4-5 капель щёлочи (до щелочной реакции индикаторной бумаги) и 3-4 капли воды. Затем добавляют 1 каплю раствора сульфата меди и нагревают верхнюю

К оставшейся части гидролизованного раствора сахарозы прибавляют кристаллик резорцина, 2 капли концентрированной соляной кислоты и нагревают до кипения. Появляется красновато- синее окрашивание, указывающее на образование фруктозы.
Химизм процесса: -к,о
ci2h22on ->c6h12o6 + qh12o6
фруктоза саха рога
Опыт №4 Реакция крахмала с йодом
В пробирку помещают 2 капли крахмального клейстера и 1 каплю раствора йода. Раствор приобретает синюю окраску. Полученную жидкость нагревают до кипения. Окраска при этом исчезает, но при охлаждении появляется вновь.
Крахмал является неоднородным соединением. Он представляет собой смесь двух полисахаридов - амилозы (20%) и амилопектина (80%). Амилоза растворима в тёплой воде и даёт с йодом синее окрашивание.
Опыт №5 Кислотный гидролиз крахмала
В пробирку налейте 2 мл крахмального клейстера. Прибавьте б мл воды и осторожно 0, 5-1 мл 10% серной кислоты. Кипятите смесь в течение 5 минут. Затем нейтрализуйте её щелочью. Прибавьте немного свежеприготовленного осадка меди (II). Содержимое пробирки нагрейте. Появляется оранжевое окрашивание, это является доказательством того, что конечным продуктом гидролиза крахмала является глюкоза.
Лабораторная
работа
Белки
Цель: изучить наиболее характерные свойства белков и отработать методику проведения качественных реакций на них.
Реактивы и материалы: белок куриного яйца, водный раствор свежеприготовленный; гидроксид натрия NaOH, 2Н; гидроксид натрия NaOH, насыщенный раствор; сульфат меди (II), О, 2Н раствор; азотная кислота HN03..,; свинцовая соль этановой кислоты (уксуснокислый свинец) (СН300)2РЬ, О, 1Н раствор; сульфат аммония (NH4)2SOi <онц.; соляная кислота НС1«<*«.; серная кислота H2SO*...; универсальная индикаторная бумага.
Оборудование: штатив с пробирками, вытяжной шкаф, фильтровальная бумага, пробки с газоотводными трубками, пробиркодержатели.
Опыт №1 Биуретовая реакция
В пробирку помещают 2 капли раствора белка, 1 каплю насыщенного раствора гидроксида натрия, 1 каплю сульфата меди. Жидкость окрашивается в фиолетовый цвет. Фиолетовая окраска заметна даже в водной вытяжке мяса. Биуретовая реакция связана с наличием в молекулах белков пептидных группировок - СО - NH - , которые и обуславливают появление окраски при взаимодействии с солями меди.
Опыт №2 Ксантопротеиновая реакция
В пробирку вводят 3 капли водного раствора белка и 1 каплю азотной кислоты. Появится белый осадок. При нагревании реакционной смеси и раствор, и осадок окрашиваются в ярко- жёлтый цвет. Смесь охлаждают и добавляют 1-2 капли 2Н раствора гидроксида натрия. При этом жёлтое окрашивание переходит в ярко-оранжевое.
Эта реакция обусловлена наличием в молекулах белков ароматических аминокислот. Жёлтое окрашивание появляется как результат нитрования ароматических ядер. Появление оранжевой окраски обусловлено появлением более интенсивно окрашенных анионов.
Опыт №3 Реакция на серу

пламенем спиртовки. Появляется коричнево-чёрный осадок сульфида свинца.
Эта реакция качественная на белки, содержащие цистин, цистеин, метионин.
Опыт №4 Обратимое осаждение белков из растворов
В пробирку помещают 2 капли раствора белка, 2 капли раствора сульфата аммония и слегка взбалтывают. Осадок растворяется.
При добавлении к водным растворам белков концентрированных растворов минеральных солей белки осаждаются (высаливаются). Белки при осаждении не теряют своих свойств и при разбавлении водой вновь переходят в раствор.
Опыт №5 Свёртывание белков при нагревании
В пробирку наливают 4 капли раствора белка и нагревают до кипения. Белок выпадает при этом в виде хлопьев или мути. Содержимое пробирки охлаждают, добавляют 1 каплю раствора сульфата аммония и нагревают до начала кипения. Количество свернувшегося белка при этом возрастает.
Свёртывание белков при нагревании характерно для большинства из них. Добавление нейтральных солей облегчает и ускоряет этот процесс.
Опыт №6 Осаждение белков концентрированными минеральными кислотами.
В пробирку наливают 2 капли концентрированной азотной кислоты и осторожно, наклонив пробирку, по стенке добавляют 2 капли раствора белка. Через некоторые время на границе раздела раствора белка и кислоты появляется кольцо свернувшегося белка. При встряхивании количество свернувшегося белка увеличивается.
Такой же опыт повторяют с соляной кислотой. Осадок, образованный при действии соляной кислоты при встряхивании растворяется.
Концентрированные минеральные кислоты образуют с белками солеобразные соединения и одновременно вызывают свертывание белков. 8 большинстве случаев выпавший осадок растворим в избытке концентрированной кислоты (кислоты).
Лабораторная работа №2
