
- •Учебно-методический комплекс учебной дисциплины химия окружающей среды
- •Лист согласования учебно-методического комплекса дисциплины
- •Химия окружающей среды
- •Пояснительная записка
- •Цели и задачи освоения дисциплины
- •Место дисциплины в структуре ооп
- •Требования к результатом освоения дисциплины
- •Объем дисциплины и виды учебной работы
- •Содержание и интерактивное сопровождение дисциплины
- •Методические рекомендации по организации изучения дисциплины Методические рекомендации преподавателю
- •Методические рекомендации бакалавру
- •Примерный перечень вопросов к зачету
- •Примерный перечень индивидуальных заданий
- •Примерные вопросы для тестирования
- •Вопрос 1
- •Вопрос 2
- •Критерии оценивания знаний бакалавров по дисциплине
- •Критерии выставления зачёта
- •Дополнительная литература
- •Учебно-методические разработки:
- •Материально-техническое обеспечение дисциплины
- •Обеспеченность учебно-методической документацией по дисциплине «Химия окружающей среды»
- •Возможность доступа бакалавров к электронным фондам учебно-методической документации
- •Лист согласования рабочей программы учебной дисциплины «Химия окружающей среды»
- •4.1 Лекции
- •Химический состав минералогической части почв - это общее содержание всех макроэлементов почв. Он существенно отличается от валового содержания элементов в литосфере (табл. 1).
- •Формы углерода
- •Углерод в атмосфере
- •Углерод в океане
- •Углерод в земной коре
- •Резервуары углерода
- •Потоки углерода между резервуарами
- •Изменения углеродного цикла Докембрийская история
- •Фанерозой
- •Четвертичный период
- •Антропогенное влияние на углеродный цикл
- •Лекция № 2. Составляющие гидросферы
- •Способность организовывать сотрудничество обучающихся, поддерживать активность и инициативность, самостоятельность обучающихся, их творческие способности» (пк-7
- •Теплоемкость воды.
- •Удельная энтальпия испарения.
- •Поверхностное натяжение и вязкость.
- •Диэлектрическая проницаемость.
- •Состав природных вод
- •Способы классификации природных вод
- •Показатели качества воды и способы их определения
- •Химические показатели качества воды
- •Окисляемость. Хпк бпк
- •Токсические вещества поступают в водную среду из естественных и антропогенных источников. К естественным источникам следует отнести вулканическую активность,
- •Загрязнение водных объектов пестицидами
- •Возникновение основных компонентов атмосферы
- •Состав атмосферы
- •Озоновый слой
- •Механизм образования озона
- •Роль озона в различных природных явлениях
- •Классификация атмосферных загрязнений
- •Загрязнение атмосферы автотранспортом
- •Лекция № 4. Ионизирующее излучение (2 часа).
- •Физические свойства
- •Бэр (единица измерения)
- •Грей (единица измерения)
- •Кратные и дольные единицы
- •Зиверт (единица измерения)
- •Допустимые и смертельные дозы для человека
- •Рентген (единица измерения)
- •Численное значение
- •Природная радиоактивность еды
- •Экспозиционная доза
- •Поглощенная доза
- •Эквивалентная доза
- •Эффективная доза
- •Групповые дозы
- •Мощность дозы
- •Сводная таблица доз
- •Гигиеническое нормирование ионизирующих излучений
- •Основные свойства радиопротекторов
- •Основные группы радиопротекторов
- •Механизмы действия некоторых радиопротекторов
- •Лекция № 5. Загрязнение окружающей среды (атмосфера, литосфера). Виды. Источники. Способы утилизации отходов.
- •Лекция № 6. Загрязнение окружающей среды (гидросфера) (2 часа).
- •4.2 Практические занятия
- •2. Подготовка к анализу
- •3. Проведение анализа
- •4. Обработка результатов
- •Определение карбонатной жесткости
- •Определение рН в природной воде потенциометрическим методом
- •2. Проведение анализа
- •Содержание в воде общего железа
- •2. Подготовка к анализу
- •3. Проведение анализа
- •4. Обработка результатов
- •Метод определения свободного остаточного хлора титрованием метиловым оранжевым
- •1. Растворённый в воде кислород.
- •1. Приборы и реактивы
- •2. Подготовка к анализу
- •3. Проведение анализа
- •2. Свободная угольная кислота.
- •2. Проведение анализа
- •Содержание
- •Требования к умениям бакалавров Знать
- •Определение нитритов
- •Определение содержания полифосфатов
- •Содержание
- •Требования к умениям бакалавров Знать
- •1. Методы отбора проб
- •2. Приборы и реактивы
- •3. Подготовка к анализу
- •4. Проведение анализа
- •5. Обработка результатов
- •6. Контрольные вопросы
- •Содержание
- •Требования к умениям бакалавров Знать
- •4.3 Глоссарий
- •5. Фонд оценочных средств (примеры решения задач по химии окружающей среды, задачи, тесты и вопросы)
- •Тема 1. Физико-химические процессы в литосфере
- •Тема 1. Физико-химические процессы в атмосфере
- •Тема 3. Физико-химические процессы в гидросфере
- •Тема 3. Физико-химические процессы в атмосфере
- •6. Методические указания по самостоятельной работе студентов
- •7. Материально-техническое оснащение дисциплины
- •8. Перечень учебно-методических публикаций по дисциплине, изданных сотрудниками кафедры
Химический состав минералогической части почв - это общее содержание всех макроэлементов почв. Он существенно отличается от валового содержания элементов в литосфере (табл. 1).
Таблица 1.
Среднее содержание химических элементов в литосфере и в почвах (в % по массе)
Элементы |
Литосфера |
Почва |
Элементы |
Литосфера |
Почва |
O |
47,20 |
49,0 |
N |
0,01 |
0,10 |
Si |
27,60 |
33,0 |
Ti |
0,60 |
0,46 |
Al |
8,80 |
7,1 |
H |
0,15 |
|
Fe |
5,10 |
3,8 |
C |
0,10 |
2,00 |
Ca |
3,60 |
1,4 |
S |
0,09 |
0,085 |
Na |
2,6 |
0,6 |
Mn |
0,09 |
0,085 |
K |
2,6 |
1,4 |
P |
0,08 |
0,08 |
Mg |
2,10 |
0,60 |
Cu |
0,01 |
0,002 |
Из таблицы следует, что литосфера в основном состоит из 8 элементов, в почве значимы также С, Р и N, что обусловлено влиянием биогенных факторов.
Поскольку основная часть почвенной массы представлена минеральными частицами, валовой химический состав почвы в преобладающей мере определяется составом количественным соотношением формирующих ее минералов. Поэтому в валовом химическом составе почв преобладают О и Si, в меньшей мере Al и далее по убывающей Fe, Са, Na, К, Mg. Другие элементы присутствуют в микроколичествах.
Плодородие определяется химическим поглощением почвы. Химическая поглотительная способность — это способность почвы удерживать некоторые ионы путем образования в результате химических реакций нерастворимых или труднорастворимых в воде соединений.
Анионы азотной и соляной кислот (NO3- и С1-) ни с одним из катионов (Са2-+, Mg2+, K+, А13+, NH4+) не образуют в воде труднорастворимых соединений, т.е. химически почвой не поглощаются. Анионы угольной и серной кислот (СО32-, SO42-) в почвах с большим количеством Са2+, Mg2+ химически поглощаются, так как образуют с ними труднорастворимые в воде соединения. Химическое поглощение фосфорной кислоты в почве происходит при образовании труднорастворимых или нерастворимых солей с двухвалентными и трехвалентными катионами (Са2+, Mg2+, Fe3+, Al3+).
В почвах с нейтральной или слабощелочной реакцией, содержащих обменно поглощенный кальций, бикарбонаты кальция или магния в почвенном растворе, химическое закрепление фосфорной кислоты происходит в результате образования слаборастворимых фосфатов кальция и магния, малорастворимые соли осаждаются и переходят из почвенного раствора в твердую фазу почвы. Поэтому такого типа процессы называют химическим поглощением. Если почвенный раствор имеет кислую реакцию, то образование нерастворимого в воде фосфата кальция затрудняется. Наоборот, при взаимодействии кислого раствора с твердой фазой, содержащей СаНРО4 или Са3(РО4)2, возникают процессы, прямо противоположные химическому поглощению, а именно процессы растворения. Подкисление может происходить в результате выделения углекислоты корнями растений и микроорганизмами, или в результате образования азотной кислоты в процессе нитрификации. Но в кислой среде могут образовываться и малорастворимые соли фосфорной кислоты при ее взаимодействии с гидратом окиси железа или гидратом окиси алюминия:

Образовавшиеся соли в отличие от фосфатов кальция мало растворимы в почвенном растворе с кислой реакцией среды. Поэтому в зависимости от реакции среды химическое поглощение фосфорной кислоты, в почвах происходит по-разному. В почвах с кислой реакцией преимущественно образуются малорастворимые фосфаты полуторных окислов, а в почвах с нейтральной и щелочной реакцией химическое поглощение фосфорной кислоты может быть связано с образованием малорастворимых фосфатов кальция.
В результате химического поглощения фосфор фосфорных удобрений переходит в менее доступную для растений форму. По возрастающей интенсивности химического поглощения фосфорной кислоты почвы располагаются в такой последовательности: чернозем<серозем<дерново-подзолистые почвы<красноземы.
Физико-химическое, или обменное, поглощение катионов — это способность мелкодисперсных коллоидов частиц почвы, как минеральных, так и органических, несущих отрицательный заряд, поглощать различные катионы из раствора.
Обменное поглощение состоит в том, что из раствора в твердую фазу переходят одни катионы, а одновременно из твердой фазы в раствор вытесняется соответствующее количество другого катиона, который до этого находился в почве в поглощенном состоянии.
К. К. Гедройц сформулировал Основной закон, управляющий обменной адсорбцией почв: все почвы обладают способностью обменивать содержащиеся в их поглощающем комплексе поглощенные катионы (как металлические, так и водородные) на любые катионы электролитов (как металлические, так и водородные), причем количество катионов, поглощенное почвой, эквивалентно количеству катионов, вытесненных из почвы в раствор.
В обменном поглощении катионов, как и при физической поглотительной способности почв, существенную роль играет поверхностная энергия. Однако если при физическом поглощении процесс ограничивается положительной или отрицательной концентрацией растворенного в слое жидкости у поверхности почвенных частиц, то при обменном поглощении электролиты почвенного раствора вступают в химическую реакцию с молекулами, расположенными на поверхности почвенных частиц; такая химическая реакция возможна, с одной стороны, при наличии поверхностной энергии, а с другой стороны, заряженные отрицательно почвенные коллоидальные частицы притягивают к своей поверхности катионы электролитов почвенного раствора, где эти катионы и вступают в реакцию обмена с катионами молекул, расположенных на поверхности частичек. Эти обменные реакции имеют двойственную природу — физическую и химическую. Поэтому и поглотительная способность почв названа физико-химической.
Важно отметить, что в отличие от химического поглощения (когда вследствие образования нерастворимых соединений изменяется состав и общая концентрация раствора) при обменном поглощении концентрация раствора не изменяется, но изменяется вследствие обмена состав катионов в растворе, а концентрация анионов почти не изменяется. При поглощении какого-либо катиона из раствора почва одновременно отдает в раствор эквивалентное количество, другого катиона, который раньше находился в твердой фазе:
(почва) Са + 2NH4NO3 = >(почва)2 NH4 + Са (NO3)2
Реакция обмена катионов обратима. Поэтому реакцию обменного поглощения катионов правильнее изображать
![]()
В зависимости от концентрации раствора, его объема, природы обменивающихся катионов и свойств адсорбирующих частиц почвы между катионами раствора и поглощенными катионами раствора почвы устанавливается некоторое подвижное равновесие. Изменение состава почвенного раствора при внесении удобрения, образование растворимых соединений в результате деятельности микроорганизмов в почве, выделение СО2 и других веществ корнями высших растений — все эти факторы смещают подвижное равновесие между твердой фазой почвы и почвенным раствором и вызывают переход одних катионов из раствора в поглощенное состояние и других из поглощенного состояния в почвенный раствор. Обменное поглощение в почвах впервые было глубоко и всесторонне исследовано советским ученым К. К. Гедройцем. Всю совокупность мелко дисперсных почвенных частиц (минеральных и органических) Гедройц предложил называть почвенным поглощающим комплексом.
В состав его входят почвенные коллоиды, частицы меньше 0,00025 и до 0,001 мм. Последние обладают значительно меньшей способностью к обменному поглощению. Почвенные коллоиды подразделяются на органические, минеральные и органо-минеральные (последние слабо изучены).
Органические коллоиды представлены в основном гумусовыми веществами (гуминовые кислоты, фульвокислоты и их соли). В состав минеральных коллоидов входят кристаллические глинистые минералы каолинитовой и монтмориллонитовой групп, гидрослюды, а также аморфные соединения — гидраты полуторных окислов, кремниевая кислота и др. Все органические и минеральные коллоиды имеют отрицательный заряд, за исключением коллоидов гидроокисей алюминия и железа, заряженных положительно. Этим объясняется ярко выраженная способность большинства почв к поглощению катионов, а не анионов. Глинистые минералы каолинитовой группы при кислой реакции также могут приобретать положительные заряды.
Гидроксильные ионы, связанные с алюминием в октаэдрическом слое, расположенном на внешней поверхности микрокристаллических частиц каолинита, при кислой реакции, т. е. при избытке в растворе ионов водорода, могут отщепляться, в результате чего на отдельных участках коллоидной частицы возникают положительные заряды. Основные свойства таких коллоидов могут проявляться на сильнокислых дерново-подзолистых почвах и красноземах.
Следовательно, у минералов каолинитовой группы при кислой реакции могут быть на разных участках одновременно положительный и отрицательный заряды. В этом случае они способны к поглощению из почвенного раствора анионов в обмен на ОН-. Поэтому чем больше в поглощающем комплексе почвы минералов этой группы, а также гидроокисей алюминия и железа, тем ниже способность к обменному поглощению катионов, а способность к обменному поглощению анионов возрастает.
Обменное поглощение катионов имеет свои закономерности.
Реакция обмена протекает в эквивалентных соотношениях и обратима. При этом устанавливается подвижное равновесие между почвой и раствором.
При постоянной концентрации раствора количество катионов, вытесняемых из почвы в раствор, возрастает с увеличением объема раствора, а при постоянном объеме раствора количество катионов, вытесняемых из почвы в раствор, повышается с увеличением концентрации раствора вытесняющей соли.
Реакция обмена катионов протекает с большой скоростью, равновесие устанавливается в течение нескольких минут.
Разные катионы с неодинаковой энергией поглощаются почвой и удерживаются в поглощенном состоянии.
В общем, чем выше относительная атомная масса и чем больше заряд катиона, тем сильнее он поглощается и труднее вытесняется из поглощенного состояния другим катионом. Например, в ряду одновалентных катионов поглощение возрастает в следующем порядке: Li<Na<NH4<K<Rb с относительной атомной массой соответственно 6, 9, 23, 18, 39, 85. Двухвалентные катионы располагаются в ряд Mg<Ca<Co (относительная атомная масса соответственно 24, 40, 59), а трехвалентные — Al<Fe (относительная атомная масса 27 и 56).
Вместе с тем двухзарядные катионы магния поглощаются сильнее однозарядных катионов натрия, кальций поглощается сильнее калия и т. д. (при одинаковых, примерно относительных атомных массах). Для характеристики неодинаковой сорбируемости различных катионов К. К. Гедройц ввел понятие «энергия поглощения катионов».
Ионы водорода, несмотря на наименьшую относительную атомную массу, обладают высокой способностью вытеснять другие катионы из поглощенного состояния. Энергия поглощения его в 4 раза больше, чем у кальция, ив 17 раз больше, чем у натрия.
Возрастание энергии поглощения катионов с увеличением их атомной массы объясняется тем, что с ростом атомной массы и размера катиона уменьшается их степень гидратации. Слабо гидратированные катионы сильнее притягиваются поверхностью коллоида. Необходимо также отметить, что минералы группы каолинита поглощают катионы только наружной поверхностью кристалла, так как они имеют незначительное свободное пространство между пакетами кристаллической решетки (2,8 А). У минералов же группы монтмориллонита свободное пространство между пакетами значительно больше (в сухом состоянии 9,4 А, при набухании возрастает до 21 А), что делает возможным проникновение в это пространство даже сравнительно крупных ионов.
В почве происходит и необменное поглощение катионов,, в результате чего глинистыми минералами (мусковитом, вермикулитом, иллитом, монтмориллонитом), имеющими трехслойную кристаллическую решетку, которая может расширяться, закрепляются катионы (калия, аммония, цезия, рубидия). Предполагается, что катионы попадают в межпакетные пространства кристаллической решетки этих минералов.
Необменное поглощение аммония и калия изменяется в очень широких пределах, в зависимости от генетических особенностей почв, их механического и минералогического состава. У черноземов оно выражено значительно сильнее, чем у дерново-подзолистых почв. Возрастает оно также при попеременном увлажнении и высушивании почв. Поэтому неглубокая заделка аммиачных и калийных солей в слои почвы, подверженной попеременному увлажнению и высушиванию, усиливает необменное поглощение аммония и калия, внесенных с удобрениями. Необменно поглощенные почвой аммоний и калий медленнее освобождаются в доступные растениям формы, чем обменно поглощенные.
Емкость поглощения. Общее количество катионов, которое почва способна удерживать в обменном состоянии, содержащееся в 100 г почвы, называется емкостью поглощения. Емкость поглощения удобнее всего выражать в миллиэквивалентах на 100 г почвы. Если, например, 100 г почвы содержат 500 мг поглощенного кальция (и больше никаких других катионов), то емкость поглощения такой почвы равна 500:20 = 25 мэкв/100 г почвы (эквивалентная масса кальция 40:2 = 20, поэтому 1 мэкв кальция равен 20 мг Са). Если весь кальций (500 мг) вытеснить NH4C1, то вместо кальция поглотится 450 мг NH4, и почва будет содержать 450 мг поглощенного аммония (эквивалент NH4=18). Поэтому при обмене Са на NH4 на место 20 мг Са будет поглощено 18 мг аммония. Емкость же поглощения остается одинаковой; если выразить ее в миллиэквивалентах, то она опять будет равна 25 мэкв/100 г почвы, так как 450:18 = 25, т. е. емкость поглощения для конкретной почвы — величина постоянная.
Величина емкости поглощения определяется рядом факторов: 1) содержанием высокодисперсных частиц в почве; 2) химическим и минералогическим составом почвенных коллоидов; 3) реакцией почвы (величиной рН). Почвы, содержащие в большом количестве высокодисперсные частицы, отличаются высокой емкостью поглощения; емкость поглощения катионов у глинистых почв выше, чем у песчаных.
Разные группы почвенных коллоидов резко отличаются по емкости поглощения. Из глинистых минералов наибольшей емкостью поглощения обладают минералы группы монтмориллонита. Эти минералы характеризуются высокой степенью дисперсности, соответственно этому емкость поглощения катионов у монтмориллонита сравнительно велика— 60—150 мэкв/100 г минерала. Каолинит отличается малой дисперсностью и небольшой активной поверхностью. Соответственно невысока и его емкость поглощения катионов — всего 3—15 мэкв/100 г минерала.
Органические почвенные коллоиды — гумусовые вещества—обладают значительно большей поглотительной способностью по сравнению с минеральными. Отличия в емкости обмена катионов гуминовыми кислотами различного происхождения определяются разным содержанием функциональных групп: гуминовые кислоты подзолистых почв имеют емкость обмена около 350 мэкв/100 г вещества (при рН 7,0), а у гуминовых кислот чернозема и каштановых почв при тех же условиях — 400— 500 мэкв/100 г. Поэтому черноземы имеют более высокую величину ем кости поглощения (40—60 мэкв/100 г почвы) по сравнению с дерново- подзолистыми почвами (10—15 мэкв/100 г). Емкость поглощения третьей группы высокодисперсных почвенных частиц—аморфных минеральных коллоидов — зависит от соотношения в их составе SiO2 : R2O3. Чем шире это отношение, чем больше ацидоидная часть, тем выше и величина емкости поглощения ими катионов. С повышением рН увеличивается и емкость поглощения, так как возрастает отрицательный заряд коллоидов и, следовательно, поглотительная способность по отношению к катионам.
Обменная поглотительная способность зависит от состава почвенных коллоидов. Чем больше в составе мелкодисперсной, фракции почвы неорганического вещества и минералов глин монтмориллонитовой группы, тем выше бывает емкость поглощения. Способность органического вещества почвы к адсорбции катионов обусловлена кислотной (ацидоидной) природой перегнойных веществ, благодаря которой органические .почвенные коллоиды имеют отрицательный заряд. Отрицательный заряд органическим коллоидам сообщают карбоксильные группы по такой схеме: R COOH =R COO-+H+. Реакцию обмена катионов, поглощенных органическими почвенными коллоидами, можно представить следующим образом:

Способность к обмену катионов у минеральных частиц мелкодисперсной фракции почв также связана с отрицательным зарядом.
Возникновение отрицательного заряда у почвенных минералов связано главным образом с наличием изоморфных замещений в силикатных и алюмосиликатных структурах (например, кремния на алюминий и др.), что можно объяснить следующим образом. Соединение состава (SiO2)n нейтрально, но если в кремнекислородной структуре некоторая часть атомов кремния в тетраэдрической координации замещена на атомы алюминия, то такое замещение нарушает нейтральность и сообщает алюмосиликатному образованию отрицательный заряд. Схематически это можно представить так:
Отрицательный![]() заряд
в алюмосиликатах уравновешивается
соответственным
количеством таких катионов, как К+,
Na+,
Ca2+
и др. У
минералов глин, входящих в состав
мелкодисперсной фракции почвы,
эти катионы оказываются способными к
диссоциации и обмену на другие
катионы по схеме
заряд
в алюмосиликатах уравновешивается
соответственным
количеством таких катионов, как К+,
Na+,
Ca2+
и др. У
минералов глин, входящих в состав
мелкодисперсной фракции почвы,
эти катионы оказываются способными к
диссоциации и обмену на другие
катионы по схеме
Приведенная![]() схема
показывает, почему именно алюмосиликаты,
а не свободная SiO2
оказываются носителями обменной
поглотительной способности
минеральной части почвы. Алюминий,
входящий в состав кремнекислородной
(тетраэдрической) структуры, замещающий
в ней частично
кремний, сообщает этой структуре
кислотные свойства, которыми чистая
SiO2
не обладает.
схема
показывает, почему именно алюмосиликаты,
а не свободная SiO2
оказываются носителями обменной
поглотительной способности
минеральной части почвы. Алюминий,
входящий в состав кремнекислородной
(тетраэдрической) структуры, замещающий
в ней частично
кремний, сообщает этой структуре
кислотные свойства, которыми чистая
SiO2
не обладает.
Среди почвенных минералов наиболее высокой обменной способностью, обусловленной указанными причинами, обладает монтмориллонит. Решетка монтмориллонита состоит из множества плоских пакетов, состав и строение которых схематически можно представить так
Такая
структура![]() нейтральна,
алюминий (в центральной части пакета)
образует в ней слой с октаэдрической
координацией, и в этом положении
отрицательного заряда алюмосиликатной
структуре он не сообщает.
Однако заряд появляется, если алюминий
частично заместит кремний
в кремнекислородном слое, например:
нейтральна,
алюминий (в центральной части пакета)
образует в ней слой с октаэдрической
координацией, и в этом положении
отрицательного заряда алюмосиликатной
структуре он не сообщает.
Однако заряд появляется, если алюминий
частично заместит кремний
в кремнекислородном слое, например:
![]()
Таким образом, влияние алюминия на заряд алюмосиликатной структуры связано с его положением в ней. Алюминий, образующий самостоятельный алюмокислородный или алюмогидроксильный слой с октаэдрической координацией, ацидоидными свойствами не обладает. Кроме частичного замещения кремния на алюминий у монтмориллонита причиной появления отрицательного заряда бывают и другие изоморфные замещения, например частичная замена алюминия в октаэдрической координации на магний:
![]()
Высокообменная способность минералов данного типа обусловлена также тем, что обмен катионов у них не ограничивается внешней поверхностью микрокристаллических частиц, но распространяется внутрь их вследствие того, что при набухании раствор проникает в межпакетные промежутки кристаллической решетки микрокристаллов.
Другие минералы мелкодисперсной фракции почвы имеют более плотную упаковку, и поэтому обмен катионов происходит у них только на внешней поверхности микрокристаллов. К таким относятся, в частности, минералы группы каолинита, состав и строение пакетов которого можно представить так:
![]()
По сравнению с минералами монтмориллонитовой группы каолинит отличается более высоким содержанием алюминия и меньшим — кремнекислоты. Алюминий в такой структуре не только не сообщает ацидоидных свойств минералу, а, наоборот, может проявить свои основные свойства за счет связанных с алюминием гидроксильных ионов выходящих на внешнюю поверхность микрокристаллических частиц:
![]()
Еще в большей степени проявляются основные (базоидные) свойства у свободных, не связанных с кремнекислотой полуторных окислов (алюминия и железа), которые в кислой среде реагируют преимущественно как основания:
![]()
По мере общего увеличения в составе мелкодисперсной фракции почв содержания алюминия и железа и уменьшения количества кремне-кислоты наблюдаются, как правило, снижение способности к обмену катионов, уменьшение емкости поглощения.
Таким образом, емкость поглощения почвы зависит__не только от общего содержания мелкодисперсной, коллоидной фракции, но и от химического состава и связанного с ним строения адсорбирующих частиц. Малая, емкость поглощения у_легких песчаных_и бедных органическим веществом почв, объясняется малым содержанием мелкодисперсной коллоидной фракции. Невысокая емкость поглощения дерново-подзолистых почв может быть обусловлена повышенным содержанием в мелкодисперсной фракции свободных полуторных окислов, - среди алюмосиликатных минералов — глин с преобладанием структур типа каолина. Высокая емкость поглощения у почв черноземного типа обусловлена как повышенным содержанием у них тонкодисперсной фракции с большой долей органических веществ в ее составе, так и преобладанием среди минералов глин минтмориллонита отношением S1O2:(Аl2Оз+Fе2Оз). На емкость поглощения влияет также реакция среды. Как органические, так и большинство минеральных почвенных коллоидов, обладающих ацидоидными свойствами, проявляют их в большей степени в условиях нейтральной и слабощелочной среды. При кислой реакции, наоборот, заряд почвенных коллоидов уменьшается, в результате чего емкость поглощения катионов несколько снижается.
Состав поглощенных катионов. Большая часть емкости поглощения черноземных почв, как правило, занята кальцием (30—40 мэкв) и магнием (5—10 мэкв). В поглощающем комплексе солонцовых и засоленных почв (солонцах, солончаках) кроме кальция и магния содержатся катионы натрия, а подзолистых и латеритных — ионы алюминия и водорода.
Состав поглощенных катионов оказывает на свойства почвы определенное влияние.
Вследствие обратимости реакции обмена катионов почва обладает способностью регулировать состав почвенного раствора (КС1 на черноземе вытесняет Са, а на кислых почвах — А1 и Н). Состав поглощенных катионов, может оказать существенное влияние на действие удобрений.
Состав поглощенных катионов влияет на состояние самого поглощающего комплекса, (кальций и магний увеличивают емкость поглощения, улучшают физические свойства почвы, натрий ухудшает их).
Ионы водорода создают кислотность почвы и вызывают постепенное разрушение минералов, входящих в состав поглощающего комплекса почвы. Поэтому вытеснение поглощенного кальция водородом приводит к уменьшению емкости поглощения, что также ухудшает структур почвы. Внесением удобрений можно регулировать соотношение поглощенных катионов в почве. Известкование дерново-подзолистых почв и гипсование солонцовых увеличивают содержание кальция в поглощающем комплексе.
Реакция почвы — существенный фактор, влияющий на высшие растения и микроорганизмы. Удобрения часто изменяют реакцию почвенного раствора (например, при известковании или внесении физиологи чески кислых солей).
Реакция почвенного раствора (как и всякого другого раствора определяется концентрацией находящихся в нем ионов водорода (Н+) : гидроксила (ОН-). В чистой воде, имеющей нейтральную реакцию, концентрация ионов водорода равна концентрации ионов гидроксила. При электролитической диссоциации воды получается равное количеств ионов Н+ и ОН-. Степень диссоциации воды очень мала. Концентрация ионов водорода в чистой воде равна 1/107 г/л. Соляная и азотная ки< лоты в разведенном растворе диссоциируют полностью, поэтому есл к 1 л воды добавить 1 мэкв НС1, то в растворе будет около 1 мэкв Н+ т. е. 0,001 г= 1/103 Н+. Упрощенно концентрацию ионов водорода выр; жают через рН (отрицательный логарифм концентрации ионов водор< да). Так как в нейтральном растворе концентрация ионов водород равна 0,0000001 = 1-10-7, то рН 7.
Реакция почвенных растворов может колебаться в довольно значительных пределах, начиная от рН 3—3,5 (это самая кислая реакция которая характерна для сфагновых торфов и лесных подстилок сфагновых лесов) и кончая рН 10—11 (такая щелочная реакция может бы у солонцов).
Раствор будет щелочным, если концентрация ионов ОН- больше концентрации Н+, чем в чистой нейтральной воде. Следовательно, если рН меньше 7, то это означает кислую реакцию, рН равен 7 — нейтральную, рН больше 7 — щелочною.
Концентрации ионов водорода и гидроксила находятся в такой зависимости: Н+ + ОН- = 10 -14, т. е. чем больше концентрация ионов гидроксила, тем меньше концентрация ионов водорода и наоборот.
В почвенном растворе всегда содержится углекислота, которая образуется в результате биологической деятельности. Она оказывает подкисляющее действие на почвенный раствор:
![]()
Однако эта кислотность подвергается нейтрализации поглощенными основаниями (кальция и магния) и карбонатами тех же металлов:

Если в поглощающем комплексе почвы содержится поглощенный натрий, то в растворе возможно образование бикарбоната или карбоната натрия:

Углекислые соли в растворе подвергаются гидролитической диссоциации:
![]()
Так как Са(ОН)2 и NaOH — сильные основания, а Н2СОз— очень слабая кислота, то при растворении углекислых солей в воде вследствие преобладания ОН- реакция смещается в щелочную сторону. Особенно резко подщелачивает раствор карбонат натрия, слабее — бикарбонат натрия и еще слабее — бикарбонаты магния и кальция.
Таким образом, реакция почвенного раствора разных почв зависит от состава поглощенных катионов и наличия в почве карбонатов. Если в поглощающем комплексе много натрия (солонцы, солончаки), то реакция почвенного раствора определяется наличием углекислых солей. У этих почв она бывает равной 8—8,5. При преобладании в поглощающем комплексе катионов кальция или присутствии карбонатов кальция и магния (карбонатные почвы, многие черноземы) реакция регулируется главным образом присутствием в почвенном растворе бикарбоната кальция; рН таких почв колеблется в пределах 7—8. Если же в почве кроме кальция и магния присутствуют алюминий и водород (выщелоченные и деградированные черноземы, дерново-подзолистые почвы), реакция почвенного раствора определяется одновременно присутствием свободной углекислоты и бикарбоната кальция (Н2СО3 + Са(НСОз)2, а также растворимых органических кислот и их солей. Чем меньше кальция и больше водорода, тем меньше будет Са(НСОз)2 и больше свободной Н2СОз, рН колеблется от 5 до 7.
Кроме СО2 и органических кислот почвенный раствор могут подкислять и соли алюминия:
![]()
Реакция почвенного раствора сильнокислых почв может опуститься до 3,5—4.
Различают активную кислотность и потенциальную, которая подразделяется на обменную и гидролитическую. Активная кислотность почвенного раствора создается углекислотой (Н2СОз) и частично растворимыми органическими кислотами и гидролитически кислыми солями. Обнаруживается она определением рН почвенного раствора или водной вытяжки из почвы. Обменная кислотность создается наличием ионов водорода и алюминия в обменном состоянии почвы, которые вытесняются при взаимодействии нейтральной соли с почвенным поглощающим комплексом:

Внесение
удобрений![]() на
почвах с обменной кислотностью может
вызвать еще большее подкисление, поэтому
при применении удобрений с этим нужно
считаться.
на
почвах с обменной кислотностью может
вызвать еще большее подкисление, поэтому
при применении удобрений с этим нужно
считаться.
Гидролитическая кислотность почвы образуется при действии гидролитически щелочной соли (CH3COONa) на почвенный поглощающий комплекс. Уксуснокислый натрий сообщает раствору щелочную реакцию:
![]()
Выщелоченные и оподзоленные черноземы имеют гидролитическую-кислотность. Определение гидролитической кислотности имеет большое практическое значение в связи с применением удобрений (известкованием, применением фосфоритной муки).
Степень насыщенности почв основаниями показывает, какая доля: от общей емкости поглощения приходится на поглощенные основания:
![]()
где V — степень насыщенности основаниями (%); 5 — сумма поглощенных оснований (мэкв); Н — гидролитическая кислотность (мэкв); Т — емкость поглощения.
Буферность почвы — это способность почвы противостоять изменению реакции почвенного раствора в кислую или щелочную сторону, например: СН3СООН= СН3СОО-+Н+. Если к такому раствору прибавить щелочь, то равновесие сместится, и часть молекул СНзСООН перейдет в диссоциированное состояние. Поэтому рН раствора изменится мало; раствор будет оказывать буферное действие против подщелачивания. Раствор смеси слабой кислоты и ее соли, например СНзСООН и СНзСОСNа, будет буферным также и по отношению к подкислению. Под влиянием электролитической диссоциации соли подавляется диссоциация и без того слабой кислоты:
![]()
Если к такой смеси прибавить сильную кислоту, то ионы водорода будут соединяться с анионами СН3СОО- и переходить в недиссоциированное состояние, поэтому рН будет изменяться мало — раствор будет буферить против подкисления. Подобного рода буферностью обладает почвенный раствор, так как в нем присутствуют слабые кислоты и их соли (например, углекислота, органические кислоты, фосфаты).
Буферность проявляется в том случае, если в почвенно-поглощающем комплексе присутствуют кальций, магний и другие элементы.
![]()
Чем больше емкость поглощения почвы и степень насыщенности почвы основаниями, тем более сильными буферными свойствами она обладает. Буферное действие против смещения реакции в щелочную сторону также связано с поглощающим комплексом, с обменной и гидролитической кислотностью:
![]()
Чем больше гидролитическая кислотность почвы, тем активнее почва будет противодействовать изменению реакции а сторону подщелачивания.
Таким образом, буферное действие почвы в основном определяется степенью насыщенности почвы основаниями и величиной емкости поглощения. Чем больше степень насыщенности почвы основаниями и меньше гидролитическая кислотность, тем устойчивее почва против изменения реакции в кислую сторону. В случае низкой степени насыщенности, наоборот, особенно сильно проявляется сопротивляемость почвы против подщелачивания.
Применение возрастающих количеств агрохимических средств в интенсивном земледелии существенно влияет на плодородие и свойства почвы, что в свою очередь определяет величину урожая сельскохозяйственных культур и качество продукции. Необходимы глубокие знания комплекса факторов и процессов, протекающих в системе «почва — удобрение — растение», важнейшие из которых следующие: 1) изменение свойств и плодородия почвы при систематическом применении удобрений в сочетании с другими приемами агротехники; 2) круговорот и баланс питательных веществ и гумуса в почве и их регулирование; 3) исследование и создание комплекса оптимальных параметров основных показателей плодородия почв.
Скорость и степень разложения органических удобрений зависят также от обогащенности почв микроорганизмами, их состава и биологической активности, а также от условий, определяющих жизнедеятельность микроорганизмов (сложения почвы, ее структуры и аэрации, гидротермического режима и физико-химических свойств, от наличия в ней питательных веществ и т.д.). Интенсивность минерализации органических удобрений в значительной степени определяется их биогенностью.
Химический состав гранулометрических фракций
Распределение химических элементов по отдельным гранулометрическим фракциям сильно различается (табл. 2.).
Таблица 2.
Валовой состав гранулометрических фракций песчаного подзола
на глубине (2-10 см) в % на прокаленную почву
Размер фракций (мм) |
SiO2:Al2O3 |
SiO2 |
Al2O3 |
Fe2O3 |
MgO |
K2O |
1-0,25 |
58,3 |
96,87 |
1,66 |
0,25 |
0,00 |
0,48 |
0,25-0,1 |
19,9 |
92,95 |
4,68 |
0,39 |
0,00 |
1,25 |
0,1-0,01 |
11,1 |
87,66 |
7,90 |
1,18 |
0,00 |
1,54 |
0,01-0,001 |
4,2 |
74,13 |
17,58 |
1,43 |
0,10 |
3,41 |
< 0,001 |
2,2 |
61,33 |
27,42 |
3,46 |
0,52 |
3,56 |
Наиболее высокое содержание Si отмечается в крупных фракциях, обогащенных кварцем. В более тонких фракциях увеличивается участие полевых шпатов и других первичных минералов. В связи с этим растет содержание алюминия, железа и других элементов.
Различие в валовом химическом составе отдельных горизонтов профиля при однородной почвообразующей породе, используется для суждений о химических преобразованиях породы и дифференциации профиля в процессе почвообразования. Существенные различия в составе горизонтов характерны для почв с элювиально-иллювиально дифференцированным профилем.
Для понимания причин формирования валового химического состава почвы и его изменений по профилю, необходимо учитывать, что содержание отдельных элементов определяется присутствием их в почве в составе разнообразных конкретных минеральных и органических соединений.
Si
Присутствует в породе в виде кварца и в меньшей мере первичных и вторичных силикатов и алюмосиликатов. В ряде случаев может присутствовать аморфный кремнезем (опал, халцедон), генезис которых в почве связан с биогенными или гидрогенными процессами. Валовое содержание колеблется от 40-70% в глинистой почве до 90-98% в песчаных. В ферралитных почвах его содержание может быть много ниже.
Al
Содержание его обусловлено в основном присутствием полевых шпатов и глинистых минералов, а также слюд, эпидотов и других богатых алюминием минералов. Может присутствовать и свободный глинозем в виде бемита, гидраргиллита в аморфной или кристаллической форме. Валовое содержание колеблется от 1-2 до 15-20 %, а в ферраллитных почвах может превысить 40 %.
Fe
Присутствует в почвах в составе как первичных, так и вторичных минералов, таких как магнетит, гематит, глауконит, роговая обманка, пироксены, биотит, хлорит, глинистые минералы, минералы группы оксидов железа. Много в почве содержится и аморфных соединений железа. Общее содержание в почве Fe2O3 колеблется в очень широких пределах (в %):
0,5-1,0 в кварцево-песчаных почвах
3-5 в почвах на лессах
8-10 в почвах на элювии плотных ферромагнезиальных пород
20-50 в ферраллитных почвах и латеритах тропиков
В почве также наблюдаются часто железистые прослои – ортзанды, образующиеся на капиллярной кайме или на контакте между слоями различного гранулометрического состава.
Согласно С.В. Зонну соединения железа в почве представлены следующими формами:
Силикатное железо, входящее в состав кристаллической решетки силикатов
Несиликатное (свободное): окристаллизованное (оксиды, гилрооксиды); аморфные соединения (гидрооксиды железа, гумусово-железистые комплексы); подвижные (обменные и водорастворимые).
Са
В бескарбонатных суглинистых почвах составляет 1-3 %. Определяется присутствием глинистых минералов тонкодисперсных фракций, а также гумусом и органическими остатками в связи с чем наблюдается тенденция к биогенному обогащению кальцием верхней органо-аккумулятивной части профиля. В ряде случаев содержание Са повышается в связи с присутствием в крупных фракциях обломков карбонатных пород и первичных кальцийсодержащих минералов (кальцита, гипса, основных плагиоклазов).
В почвах сухостепной и аридной зон повышенное валовое содержание кальция может быть определено образованием и накоплением вторичного кальцита или гипса в процессе почвообразования. Много Са может накопиться в почве гидрогенным путем.
Мg
Валовое содержание обычно близко содержанию Са и обусловлено присутствием глинистых минералов, особенно монтмориллонита, вермикулита, хлорита.
В крупных фракциях магний содержится в обломках доломитов, оливине, роговых обманках, пироксенах. В почвах аридной зоны много магния аккумулируется при засолении почвы в виде хлоридов и сульфатов.
К
Содержание К2О составляет в почвах 2-3 %. Присутствует К чаще в глинистых минералах тонкодисперсных фракций, особенно в гидрослюдах, а также в слюдах, калиевых полевых шпатах.
Na
Валовое содержание обычно 1-3 %. Присутствует в составе первичных минералов – натрийсодержащих полевых шпатах. В илистой фракции его содержание не превышает 0,5-1 %. В засоленных почвах сухостепных и аридных зон в значительных количествах может присутствовать в виде хлоридов или входит в почвенно-поглощающий комплекс. Дефицита натрия в почве на наблюдается. Присутствие натрия в повышенных количествах в составе подвижных соединений обуславливает наличие у почв неблагоприятных физических и химических свойств. Почвы теряют структуру, становятся водонепроницаемыми.
С, N, Р принадлежат к числу важнейших органогенов. Присутствие их в почве обязано воздействию живого вещества и процессам почвообразования.
С
В почве содержится главным образом в составе гумуса и органических остатков. Много С может находиться в составе карбонатов. Содержание С в почве колеблется от долей % до 3-5 и 10%.
N
Целиком связан в почве с гумусом, составляет 1/10-1/20 часть от содержания С. Содержание его в почве 0,3-0,4, часто 0,1 и меньше. Азот играет чрезвычайно важную роль в плодородии почвы, т.к. жизненно необходим растениям. Для растений он доступен только в форме нитратного и аммонийного ионов. Большинство культурных почв нуждается в систематическом внесении азота.
Р
Присутствует в почвах в очень незначительных количествах. Валовое содержание составляет 0,1-0,2 %. Р жизненно важен для растений. Но в большинстве почвах, особенно песчаных, находится в резком дефиците. В связи с этим необходимо внесение Р в почву. В почве Р присутствует в составе гумуса, органических остатков, в минералах в составе апатита, вивианита.
Биогеохимический цикл кислорода
Он определяет окислительно-восстановительные и щелочно-кислотные условия растворов. Для него характерна как ионная, так и неионная форма миграции в растворах.
Эволюция геохимических процессов на Земле сопровождается неуклонным увеличением содержания кислорода. В настоящее время количество кислорода в атмосфере составляет 1,2х1015 тонн. Масштабы продуцирования кислорода зелеными растениями таковы, что это количество могло быть удвоено за 4000 лет. Но этого не происходит, так как в течение года разлагается примерно такое же количество органического вещества, которое образуется в результате фотосинтеза. При этом поглощается почти весь выделившийся кислород. Но благодаря незамкнутости биогеохимического круговорота в связи с тем, что часть органического вещества сохраняется и свободный кислород постепенно накапливается в атмосфере.
Еще один миграционный цикл свободного кислорода связан с массобменом в системе природные воды – тропосфера. В воде океана находится от 3х109 до 10х109 м3 растворенного кислорода. Холодная вода высоких широт поглощает кислород, а, поступая с океаническими течениями в тропики – выделяет его в атмосферу. Поглощение и выделение кислорода происходит и при смене сезонов года, сопровождающихся изменением температуры воды.
Кислород расходуется в громадном количестве окислительных реакций, большинство из которых имеет биохимическую природу. В этих реакциях высвобождается энергия, поглощенная в ходе фотосинтеза. В почвах, илах, водоносных горизонтах развиваются микроорганизмы, использующие кислород для окисления органических соединений. Запасы кислорода на нашей планете огромны. Он входит в состав кристаллических решеток минералов и высвобождается из них живым веществом.
Таким образом, общая схема круговорота кислорода в биосфере складывается из двух ветвей:
образование свободного кислорода при фотосинтезе;
поглощение кислорода в окислительных реакциях
Согласно расчетам Дж. Уолкера (1980) выделение кислорода растительностью мировой суши составляет 150х1015 тонн в год; выделение фотосинтезирующими организмами океана – 120х1015 тонн в год; поглощение в процессах аэробного дыхания – 210х1015 тонн в год; биологическая нитрификация и другие процессы разложения органического вещества – 70х1015 тонн в год.
В биогеохимическом круговороте можно выделить потоки кислорода между отдельными компонентами биосферы (рис. 2).

Рис. 2. Схема биогеохимического цикла кислорода
В современных условиях установившиеся в биосфере потоки кислорода нарушаются техногенными миграциями. Многие химические соединения, сбрасываемые промышленными предприятиями в природные воды, связывают растворенный в воде кислород. В атмосферу выбрасывается все большее количество углекислого газа и различных аэрозолей. Загрязнение почв и, особенно, вырубка лесов, а также опустынивание земель на огромных территориях уменьшают производство кислорода растениями суши. Огромное количество атмосферного кислорода расходуется при сжигании топлива. В некоторых промышленно развитых странах кислорода сжигают больше, чем образуется его за счет фотосинтеза.
Биогеохимический цикл водорода
Содержание водорода в земной коре, в отличие от кислорода сравнительно невелико. Большая часть атомов водорода здесь входит в состав воды, нефти, горючих газов, некоторых минералов. Геохимия водорода тесно связана с историей воды и живого вещества. Кларк водорода гидросферы – 2,72, а живого вещества – 10,5.
В земной коре свободный водород неустойчив. Он быстро соединяется с кислородом, образуя воду, а также участвует в других реакциях. Способен улетучиваться в космос (диссипировать). Значительное количество водорода поступает на поверхность Земли при вулканических извержениях.
Организмы закрепляют водород в биосфере планеты, связывая его не только в органическом веществе, но и участвуя в фиксации водорода минеральным веществом почвы. Это становится возможным в результате диссоциации кислотных продуктов метаболизма с высвобождением иона Н+. Последний, как правило, образует с молекулой воды посредством водородной связи ион гидроксония (Н3О+). При поглощении иона гидроксония некоторыми силикатами происходит их трансформация в глинистые минералы. Из циклических процессов на поверхности Земли, в которых участвует водород, один из наиболее мощных – круговорот воды: ежегодно через атмосферу проходит более 520 тысяч кубометров влаги. Для создания фитомассы Мировой суши, существовавшей до вмешательства человека, по данным В.В. Добровольского (1998) было расщеплено примерно 1,8х1012 тонн воды и, соответственно, связано 0,3х1012 тонн водорода.
В процессе круговорота воды в биосфере происходит разделение изотопов водорода и кислорода. Пары воды при испарении обогащаются легкими изотопами, поэтому атмосферные осадки, поверхностные и грунтовые воды также обогащены легкими изотопами по сравнению с океаническими водами, имеющими устойчивый изотопный состав.
Биогеохимический цикл азота
Азот и его соединения играют в жизни биосферы такую же важную и незаменимую роль, как и углерод. Биофильность азота сравнима с биофильностью углерода. Индекс биогенного обогащения почв по отношению к земной коре, а растений по отношению к почвам составляет для азота 1000 и 10000 соответственно (Ковда, 1985).
Основным резервуаром азота в биосфере также является воздушная оболочка. Около 80% всех запасов азота сосредоточено в атмосфере планеты, что связано с направлением биогеохимических потоков соединений азота, образующихся при денитрификации. Основной формой, в которой содержится азот в атмосфере, является молекулярная – N2. В качестве несущественной примеси в атмосфере содержатся различные оксидные соединения азота NOx, а также аммиак NH3. Последний в условиях земной атмосферы наиболее неустойчив и легко окисляется. В то же время, величина окислительно-восстановительного потенциала в атмосфере недостаточна и для устойчивого существования оксидных форм азота, потому его свободная молекулярная форма и является основной.
Первичный азот в атмосфере, вероятно, появился в результате процессов дегазации верхней мантии и из вулканических выделений. Фотохимические реакции в высоких слоях атмосферы приводят к образованию соединений азота и заметному поступлению их на сушу и в океан с атмосферными осадками (3-8 кг/га аммонийного азота в год и 1,5-6 кг/га нитратного). Этот азот также включается в общий биогеохимический поток растворенных соединений, мигрирующих с водными массами, участвует в почвообразовательных процессах и в формировании биомассы растений.
В отличие от углерода, атмосферный азот не может напрямую использоваться высшими растениями. Поэтому ключевую роль в биологическом круговороте азота играют организмы-фиксаторы. Это микроорганизмы нескольких различных групп, обладающие способностью путём прямой фиксации непосредственно извлекать азот из атмосферы и, в конечном счёте, связывать его в почве.
В результате деятельности организмов – фиксаторов азота он связывается в почвах в нитритной форме (соединения на основе NH3).
Нитритные соединения азота способны мигрировать в водных растворах. При этом они окисляются и преобразуются в нитратные – соли азотной кислоты HNO3. В этой форме азотные соединения способны эффективно усваиваться высшими растениями и использоваться для синтеза белковых молекул на основе пептидных связей C-N. Далее, по трофическим цепям, азот попадает в организмы животных. В окружающую среду (в водные растворы и в почву) он возвращается в процессах выделительной деятельности животных или разложения органического вещества.
Возврат свободного азота в атмосферу, как и его извлечение, осуществляется в результате микробиологических процессов. Это звено круговорота функционирует благодаря деятельности почвенных бактерий-денитрификаторов, вновь переводящих азот в молекулярную форму.
В литосфере, в составе осадочных отложений, связывается весьма небольшая часть азота по причине, очень хорошей растворимости. Выпадение некоторой доли азота из биологического круговорота также компенсируется вулканическими процессами. Благодаря вулканической деятельности в атмосферу поступают различные газообразные соединения азота, который в условиях географической оболочки Земли неизбежно переходит в свободную молекулярную форму.
Таким образом, основными специфическими чертами круговорота азота в биосфере можно считать следующие:
преимущественную концентрацию в атмосфере, играющей исключительную роль резервуара, из которой живые организмы черпают запасы необходимого им азота;
ведущую роль в круговороте азота почв и, в особенности, почвенных микроорганизмов, деятельность которых обеспечивает переход азота в биосфере из одних форм в другие (рис. 3).
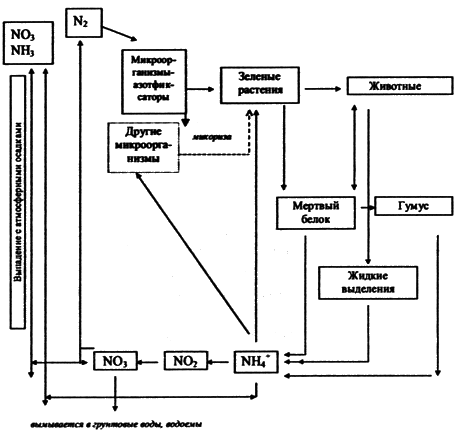
Рис.3. Схема биогеохимического цикла азота
Поэтому огромное количество азота в связанном виде содержит биосфера: в органическом веществе почвенного покрова (1,5х1011 т), в биомассе растений (1,1х109 т), в биомассе животных (6,1х107 т). В больших количествах азот содержится и в некоторых биогенных ископаемых (селитры).
Поступление за счет азотных удобрений составляет 30% от общих поступлений азота на сушу и в океан. Особенно велики потери нитратных форм азота, так как он не сорбируется почвой, легко вымывается природными водами, восстанавливается в газообразные формы и до 20-40% его теряется для питания растений. Существенным нарушением цикла азота является и все возрастающее количество отходов животноводства, промышленных отходов и стоков больших городов, поступление в атмосферу аммония и оксидов азота при сжигании топлива.
Геохимический цикл углерода — это комплекс процессов, в ходе которых происходит перенос углерода между различными геохимическими резервуарами. Важнейшую роль в круговороте углерода играли и играют живые организмы. В различных формах углерод присутствует во всех оболочках Земли.
Геохимический цикл углерода имеет несколько особенностей:
Разные процессы контролировали углеродный цикл на разных промежутках времени.
Резкие, катастрофические изменения цикла углерода играли ключевую роль в эволюции углеродного цикла в истории Земли.
Геохимический цикл углерода всегда происходит через атмосферу и гидросферу.
Геохимическая запись углеродного цикла изучена наиболее полно в отношении четвертичного периода, самый недавний и кратчайший геологический период, так как, с одной стороны, история углеродного цикла в нём наиболее полно зафиксирована ледниками Арктики и Антарктики, с другой стороны, в это время происходили значительные изменения углеродного цикла, и они неразрывно связаны с климатическими изменениями.
