
- •Учебно-методический комплекс учебной дисциплины химия окружающей среды
- •Лист согласования учебно-методического комплекса дисциплины
- •Химия окружающей среды
- •Пояснительная записка
- •Цели и задачи освоения дисциплины
- •Место дисциплины в структуре ооп
- •Требования к результатом освоения дисциплины
- •Объем дисциплины и виды учебной работы
- •Содержание и интерактивное сопровождение дисциплины
- •Методические рекомендации по организации изучения дисциплины Методические рекомендации преподавателю
- •Методические рекомендации бакалавру
- •Примерный перечень вопросов к зачету
- •Примерный перечень индивидуальных заданий
- •Примерные вопросы для тестирования
- •Вопрос 1
- •Вопрос 2
- •Критерии оценивания знаний бакалавров по дисциплине
- •Критерии выставления зачёта
- •Дополнительная литература
- •Учебно-методические разработки:
- •Материально-техническое обеспечение дисциплины
- •Обеспеченность учебно-методической документацией по дисциплине «Химия окружающей среды»
- •Возможность доступа бакалавров к электронным фондам учебно-методической документации
- •Лист согласования рабочей программы учебной дисциплины «Химия окружающей среды»
- •4.1 Лекции
- •Химический состав минералогической части почв - это общее содержание всех макроэлементов почв. Он существенно отличается от валового содержания элементов в литосфере (табл. 1).
- •Формы углерода
- •Углерод в атмосфере
- •Углерод в океане
- •Углерод в земной коре
- •Резервуары углерода
- •Потоки углерода между резервуарами
- •Изменения углеродного цикла Докембрийская история
- •Фанерозой
- •Четвертичный период
- •Антропогенное влияние на углеродный цикл
- •Лекция № 2. Составляющие гидросферы
- •Способность организовывать сотрудничество обучающихся, поддерживать активность и инициативность, самостоятельность обучающихся, их творческие способности» (пк-7
- •Теплоемкость воды.
- •Удельная энтальпия испарения.
- •Поверхностное натяжение и вязкость.
- •Диэлектрическая проницаемость.
- •Состав природных вод
- •Способы классификации природных вод
- •Показатели качества воды и способы их определения
- •Химические показатели качества воды
- •Окисляемость. Хпк бпк
- •Токсические вещества поступают в водную среду из естественных и антропогенных источников. К естественным источникам следует отнести вулканическую активность,
- •Загрязнение водных объектов пестицидами
- •Возникновение основных компонентов атмосферы
- •Состав атмосферы
- •Озоновый слой
- •Механизм образования озона
- •Роль озона в различных природных явлениях
- •Классификация атмосферных загрязнений
- •Загрязнение атмосферы автотранспортом
- •Лекция № 4. Ионизирующее излучение (2 часа).
- •Физические свойства
- •Бэр (единица измерения)
- •Грей (единица измерения)
- •Кратные и дольные единицы
- •Зиверт (единица измерения)
- •Допустимые и смертельные дозы для человека
- •Рентген (единица измерения)
- •Численное значение
- •Природная радиоактивность еды
- •Экспозиционная доза
- •Поглощенная доза
- •Эквивалентная доза
- •Эффективная доза
- •Групповые дозы
- •Мощность дозы
- •Сводная таблица доз
- •Гигиеническое нормирование ионизирующих излучений
- •Основные свойства радиопротекторов
- •Основные группы радиопротекторов
- •Механизмы действия некоторых радиопротекторов
- •Лекция № 5. Загрязнение окружающей среды (атмосфера, литосфера). Виды. Источники. Способы утилизации отходов.
- •Лекция № 6. Загрязнение окружающей среды (гидросфера) (2 часа).
- •4.2 Практические занятия
- •2. Подготовка к анализу
- •3. Проведение анализа
- •4. Обработка результатов
- •Определение карбонатной жесткости
- •Определение рН в природной воде потенциометрическим методом
- •2. Проведение анализа
- •Содержание в воде общего железа
- •2. Подготовка к анализу
- •3. Проведение анализа
- •4. Обработка результатов
- •Метод определения свободного остаточного хлора титрованием метиловым оранжевым
- •1. Растворённый в воде кислород.
- •1. Приборы и реактивы
- •2. Подготовка к анализу
- •3. Проведение анализа
- •2. Свободная угольная кислота.
- •2. Проведение анализа
- •Содержание
- •Требования к умениям бакалавров Знать
- •Определение нитритов
- •Определение содержания полифосфатов
- •Содержание
- •Требования к умениям бакалавров Знать
- •1. Методы отбора проб
- •2. Приборы и реактивы
- •3. Подготовка к анализу
- •4. Проведение анализа
- •5. Обработка результатов
- •6. Контрольные вопросы
- •Содержание
- •Требования к умениям бакалавров Знать
- •4.3 Глоссарий
- •5. Фонд оценочных средств (примеры решения задач по химии окружающей среды, задачи, тесты и вопросы)
- •Тема 1. Физико-химические процессы в литосфере
- •Тема 1. Физико-химические процессы в атмосфере
- •Тема 3. Физико-химические процессы в гидросфере
- •Тема 3. Физико-химические процессы в атмосфере
- •6. Методические указания по самостоятельной работе студентов
- •7. Материально-техническое оснащение дисциплины
- •8. Перечень учебно-методических публикаций по дисциплине, изданных сотрудниками кафедры
Способы классификации природных вод
Один из самых распространенных способов классификации основан на различиях в общем количестве растворенных неорганических и частично растворенных органических веществ, содержащихся в природных водах. Общее количество растворенных веществ — минерализацию воды — принято определять по массе сухого остатка предварительно отфильтрованной и выпаренной пробы после высушивания до постоянной массы при температуре 105ºС. В настоящее время по величине минерализации природные воды принято делить на восемь видов, или классов (табл. 1.2).
Хорошая питьевая вода содержит не более 0,5 г/л солей. Но в некоторых районах для питья используют и воды, содержащие 1.. .3 г/л растворенных солей. Соленые воды с общей минерализацией 3...10 г/л пригодны только для некоторых видов домашних животных (овец, верблюдов). Ультрапресные воды обладают способностью выводить соединения кальция из организма человека, поэтому к их использованию для питья следует подходить с осторожностью.
Таблица 2
Классификация природных вод по значению минерализации
Содержание солей, г/л |
Наименование вод |
Менее 0,2 |
Ультрапресные |
0,2...0,5 |
Пресные |
0,5...1,0 |
С относительно повышенной минерализацией |
1...3 |
Солоноватые |
3...10 |
Соленые |
10...35 |
С повышенной соленостью |
35...50 |
Переходные к рассолам |
50...400 |
Рассолы |
О.
А. Алекин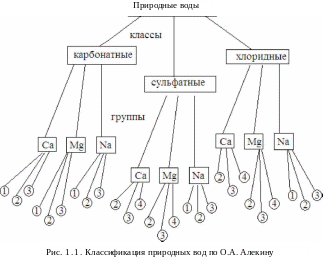 предложил классификация природных вод
основанную на различии преобладающего
аниона на три класса, а последние по
соотношению катионов на группы и типы.
В соответствии с ней все воды делятся
на: карбонатные; сульфатные; хлоридные
(рис. 1.).
предложил классификация природных вод
основанную на различии преобладающего
аниона на три класса, а последние по
соотношению катионов на группы и типы.
В соответствии с ней все воды делятся
на: карбонатные; сульфатные; хлоридные
(рис. 1.).
Класс гидрокарбонатных вод объединяет пресные и ультрапресные воды рек, озер и включает значительное количество подземных вод. Класс хлоридных вод объединяет воды морей, лиманов и подземные воды солончаковых районов. Сульфатные воды по распространению и минерализации занимают промежуточное положение между хлоридными и карбонатными водами.
Каждый класс подразделяют на три группы по преобладающему катиону (кальциевая, магниевая и натриевая группы).
Группы в свою очередь делятся на типы в соответствии с количественными характеристиками ионов и катионов. Так, к первому типу относятся воды, в которых концентрация гидрокарбонат-ионов, выраженная в ммоль/л, больше, чем суммарная концентрация катионов кальция и магния:
[НСО3-] > [Ca2+] + [Mg2+]
Воды этого типа слабо минерализованы, для них характерен избыток гидрокарбонат-ионов.
Воды второго типа характеризуются более высокой суммарной концентрацией гидрокарбонат- и сульфат-ионов, превышающей суммарную концентрацию катионов кальция и магния, которая в то же время является более высокой, чем концентрация одного гидрокарбонат-иона:
[НСО3-] + [SO42—] > [Ca2+] + [Mg2+] > [НСО3-].
К этому типу вод относятся подземные воды, а также воды рек и озер малой и средней минерализации.
Для воды третьего типа характерна более высокая концентрация ионов хлора по сравнению с ионами натрия и, следовательно, суммарная концентрация катионов кальция и магния, превышающая суммарную концентрацию гидрокарбонат- и сульфат-ионов:
[С1-] > [Nа+] или [Ca2+] + [Mg2+] > [НСО3-] + [SO42-].
Воды этого типа обычно сильно минерализованы.
Четвертый тип вод характеризуется отсутствием гидрокарбонат-ионов. Воды этого типа являются кислыми и имеются только в классах хлоридных и сульфатных вод.
Классификация О.А. Алекина, хотя и получила распространение, является далеко не единственной системой, учитывающей химический состав природных растворов.
Так, классификация природных вод, разработанная В.И. Вернадским, является, пожалуй, одной из самых подробных. Все природные воды, по В.И. Вернадскому, следует разделить на три группы: воды в твердом состоянии, воды в газообразном состоянии, жидкая природная вода.
В пределах групп он наметил деление на классы, «царства», «подцарства», семейства и виды. В.И. Вернадский выделял 480 видов вод, но писал, что их может быть и значительно больше (до 1 500 видов).
А.И. Перельман предложил обобщенную систему геохимической классификации природных вод, которая состоит из шести главных таксонов, каждый из которых определяется на основании особого критерия:
группа - температура;
тип - окислительно-восстановительные условия, основные растворенные газы;
класс - щелочно-кислотные условия;
семейство - общая минерализация;
род - растворенное органическое вещество;
вид - основные катионы и анионы (кроме Н+ и ОН-).
Средний ионный состав (в %) морской и пресной воды
Растворенные вещества |
Океан |
Пресные воды |
CO32+ |
0,41 |
35,15 |
SO42– |
7,68 |
12,14 |
Cl- |
55,04 |
5,68 |
NO3+ |
– |
0,90 |
Ca2+ |
1,15 |
20,39 |
Mg2+ |
3,69 |
3,41 |
Na2+ |
30,62 |
5,79 |
K2+ |
1,10 |
2,12 |
(Fe, Al)2O3 |
– |
2,75 |
SiO2 |
– |
11,67 |
Sr2+,H3BO3,Br– |
0,31 |
– |
Средний состав (в %) озерных вод
Главные компоненты (концентрации > 1 мг л–1) |
Микрокомпоненты (концентрации < 1 мг л–1) |
Следовые вещества (мкг л–1) |
||
Ca2++HCO3– |
64 |
NO3– |
73 |
Cu |
Mg2++SO42– |
17 |
HPO42– |
16 |
Co |
Na++Cl– |
16 |
HsiO3– |
10 |
Mo |
K+ |
3 |
|
|
Mn |
H++F– |
|
|
|
Zn |
Fe2+ |
|
|
|
B |
NH42+ |
|
|
|
V |
Средний состав речных вод (мг л-1) (Wetzel, 2001)
|
Ca2+ |
Mg2+ |
Na+ |
K+ |
CO32– |
SO42– |
Cl– |
NO3– |
Fe2O3 |
SiO2 |
Сумма |
Северная Америка |
21,0 |
5,0 |
9,0 |
1,4 |
68,0 |
20,0 |
8,0 |
1,0 |
0,16 |
9,0 |
142 |
Южная Америка |
7,2 |
1,5 |
4,0 |
2,0 |
31,0 |
4,8 |
4,9 |
0,7 |
1,4 |
11,9 |
69 |
Европа |
31,1 |
5,6 |
5,4 |
1,7 |
95,0 |
24,0 |
6,9 |
3,7 |
0,8 |
7,5 |
182 |
Азия |
18,4 |
5,6 |
5,5 |
3,8 |
79,0 |
8,4 |
8,7 |
0,7 |
0,01 |
11,7 |
142 |
Африка |
12,5 |
3,8 |
11,0 |
0,0 |
43,0 |
13,5 |
12,1 |
0,8 |
1,3 |
23,2 |
121 |
Австралия |
3,9 |
2,7 |
2,9 |
1,4 |
31,6 |
2,6 |
10,0 |
0,05 |
0,3 |
3,9 |
59 |
Весь мир |
15,0 |
4,1 |
6,3 |
2,3 |
58,4 |
11,2 |
7,8 |
1,0 |
0,67 |
13,1 |
120 |
В реках России выявляется тенденция увеличения минерализации вод с севера и востока к районам Южного Приуралья, Северного Кавказа, и южной части Сибири.
