
- •Лабораторна робота №1
- •Теоретичні відомості.
- •Порядок роботи на приладі.
- •Порядок виконання роботи.
- •Питання до захисту лабораторної роботи.
- •Література.
- •Лабораторна робота №2
- •Порядок виконання роботи.
- •Питання до захисту лабораторної роботи.
- •Література.
- •Лабораторна робота №3
- •Теоретичні відомості.
- •Порядок виконання роботи.
- •Література.
- •Лабораторна робота №4
- •Питання до захисту лабораторної роботи.
- •Література.
- •Лабораторная робота № 5
- •Теоретичні відомості.
- •Порядок виконання роботи:
- •Питання до захисту лабораторної роботи.
- •Література.
- •Лабораторна робота №6
- •Теоретичні відомості.
- •Питання до захисту лабораторної роботи.
- •Література.
- •Лабораторна робота № 7
- •Теоретичні відомості.
- •Градуювання осей осцилографа.
- •Порядок виконання роботи.
- •Горизонтальна вісь
- •Вертикальна вісь
- •Питання до захисту лабораторної роботи.
- •Література.
- •Лабораторна робота № 8
- •Теоретичні відомості.
- •Порядок роботи.
- •Література.
- •Лабораторна робота №9
- •Порядок виконання роботи.
- •Питання до захисту лабораторної роботи.
- •Література.
- •Лабораторна робота №10
- •Теоретичні відомості.
- •Метод термічного аналізу.
- •Визначення температур кристалізації.
- •Порядок виконання роботи.
- •Питання до захисту лабораторної роботи.
- •Література.
- •Лабораторна робота №11
- •Теоретичні відомості.
- •Вимірювання питомого поверхневого опору.
- •Порядок виконання роботи.
- •Література.
- •Лабораторна робота № 12
- •Теоретичні відомості
- •Порядок виконання роботи
- •Питання до захисту лабораторної роботи.
- •Література.
- •Лабораторна робота № 13
- •Теоретичні відомості
- •Порядок виконання роботи
- •Питання до захисту лабораторної роботи
- •Література.
- •Лабораторна робота № 14
- •Теоретичні відомості
- •Методика проведення експериментів
- •Порядок виконання роботи
- •Питання до захисту лабораторної роботи.
- •Література.
- •Лабораторна робота № 15
- •Теоретичні відомості.
- •Порядок виконання роботи.
- •Література.
- •Термопара Хромель-Алюмель
Питання до захисту лабораторної роботи.
1. Від чого залежить ємність відокремленого провідника, ємність конденсатора?
2. Чим визначається час розрядки конденсатора?
3. Чому використаний в роботі метод придатний для виміру тільки досить великих ємностей?
Рекомендований вибір резисторів
СХ, мкФ |
Група R |
R, кОм |
R0, кОм |
UСдопуст., В |
5 - 70 |
R1 |
3375 |
10,19 |
16 |
80 – 220 |
R2 |
1030 |
2,9 |
16 |
220-470 |
R3 |
337 |
0,844 |
18 |
>680 |
R4 |
57,7 |
0,222 |
12 |
Література.
1. www.opprib.ru e-mail:info@opprib.ru
2. Определение емкости конденсатора и батареи конденсаторов, Лабораторная работа №2. Составители:Санеев Э.Л., Шагдаров В.Б., Изд.ВСГТУ, Улан-Уде, 2007
3. Изучение процессов зарядки и разрядки конденсатора: Методические указания к лабораторной работе по физике /Составитель: Х.К.Тазмеев; Изд.2-е, доп. и перераб.- Набережные Челны: КамПИ, 2003,14 с.
4. rl.odessa.ua._For_Lyceistu/Physics/Lab_11F/…
Ришельевский лицей, Определение емкости конденсатора по кривой разрядки. Лабораторный практикум
5. http://konspektiruem.ru/articles/electrical_eng…
Лабораторна робота № 15
Тема: Діаграми стану подвійних сплавів.
Мета роботи: Визначення складу припою за кривою охолодження.
Прилади і матеріали: піч СУОЛ, термопара хромель-алюмель, зразки матеріалів.
Теоретичні відомості.
Перехід металу з рідкого стану в тверде з утворенням кристалів називається кристалізацією. Особливістю переходу з рідкого стану в твердий являється те, що в чистих металах він протікає при постійних температурах, які залежать від природи металу і тиску.
Розташування атомів в рідині характеризується відсутністю далекого порядку, тобто відсутністю правильного розташування атомів, що періодично повторюється в трьох вимірах.
Внутрішня енергія неврегульованої рідини більше впорядкованої будови твердого тіла, тому при переході з одного стану в інше спостерігається виділення (чи поглинання) тепла.
Теплота, що виділяється під час переходу металу з рідкого стану в твердий, називається прихованою теплотою плавлення. Температура кристалізації визначається як температура, при якій вільні енергії рідкої і твердої фаз рівні. Зміна вільної енергії рідкого і твердого станів залежить від температури (рис.1).
Температура Тs називається рівноважною температурою кристалізації (плавлення). Процес кристалізації при цій температурі не відбувається, оскільки в цих умовах вільні енергії рідкого і твердого станів рівні.
Процес кристалізації починається, коли виникає різниця вільних енергій, яка утворюється внаслідок меншої вільної енергії твердого металу в порівнянні з рідким. Таким чином, для переходу металу з рідкого стану в тверде потрібне переохолодження нижче рівноважної температури кристалізації .
Для проведення термічного аналізу випробовуваний материал помещают в тигель і доводять до плавлення. Після цього метал повільно охолоджують з постійною швидкістю і через рівні проміжки часу заміряють його температуру. Для виміру високих значень температур зазвичай використовують термоелектричні пірометри. Термоелектричні пірометри складаються з термопари і реєструючого пристрою .
Термопара складається з двох провідників різних металів або сплавів і має ту властивість, що якщо з'єднати (зварити) одні кінці проввідників, а інші приєднати до гальванометра, то при нагріві спаю виникає електрорушійна сила, що викликає відхилення стрілки гальванометра. Величина електрорушійної сили залежить від матеріалу термопари і температури замкнених кінців кола. Результуюча ЕРС тим більше, чим більше різниця температур гарячого і холодного спаїв. При постійній температурі одного з кінців, виведених до вимірювального приладу (званого холодним спаєм), результуюча ЕРС визначається температурою другого кінця (гарячого спаю), який вводиться в розплавлений метал.
В якості термопар застосовують наступні
поєднання металів : платинородій (10% Rh)
- платина (ПП1); платинородій (30% Rh ) -
платинородій(ПР30/6), хромель-алюмель
(ХА); хромель-копель(ХК).
якості термопар застосовують наступні
поєднання металів : платинородій (10% Rh)
- платина (ПП1); платинородій (30% Rh ) -
платинородій(ПР30/6), хромель-алюмель
(ХА); хромель-копель(ХК).
Таблиця 1
Хімічний склад сплавів для термопар
Хромель |
Алюмель |
Копель |
Константан |
Платинородій |
Ni - 89,0 % Cr - 9,8 % Fe - 1,0 % Mn - 0,2 % |
Ni - 94 % Al - 2 % Si - 1,0 % Fe - 0,5 % Mn - 2,5 %
|
Ni - 43 - 44 % Fe - 2 - 3 % Cu - 53 - 55 %
|
Ni - 40 % Cu - 59 % Mn - 1 %
|
Pt - 90 % Rh - 10 % |
Таблиця 2
Сфера застосування термопар
Термопара |
Температурна межа, оС |
Медь - константан Хромель - копель Срібло - константан Залізо - константан Хромель - алюмель Платина - платинородій |
400 600 600 650 1100 1600 |
Гарячий спай термопари, захищений від контакту з рідким металом, занурюється в метал з таким розрахунком, щоб спай знаходився в середині об'єму металу, що дозволяє характеризувати його дійсну температуру. Холодний спай термопари виводять до вимірювальних приладів. За показамии цих приладів - по окремих замірах температури через певні проміжки часу отримують графіки
Т=f(τ), в координатах температура - час ( рис.2 ).
Сплав ця речовина, отримана сплавлянням двох або більше компонентів. Будова сплаву залежить від типу взаємодії компонентів. У металевих сплавах можливе одержання механічної суміші, хімічних сполук і твердих розчинів.
Діаграми стану сплаву будують експериментальним шляхом, які представляються в графічній формі і показують зміну складу залежно від вмісту компонентів і температури. Діаграми стану дозволяють визначити, яку структуру матимуть повільно охолоджені сплави, а також вирішити питання про те, чи можна змінити мікроструктуру в результаті термічної обробки сплаву.
Вид діаграми визначається характером взаємодії, які виникають між компонентами в рідкому і твердому станах.
Загальні закономірності співіснування стійких фаз, що відповідають теоретичною умовою рівноваги, можуть бути виражені правилом фаз.
![]() ,
,
де:
С- число ступенів вільності
К - кількість компонентів тих, що становлять сплав
f - кількість фаз
2 - число змінних (тиск і температура).
Для двокомпонентної системи (К=2) діаграми розглядають без урахування газової фази, тобто вважають що p=const, а зовнішнім чинником, що змінюється, вважають тільки температуру (n=1).
Тоді правило фаз набере наступного вигляду.
![]()
При числі ступенів вільності рівної "0" система знаходиться в рівновазі при строго певній температурі (рідка і тверда фази).
Якщо число ступенів вільності дорівнює одиниці, то можлива зміна в деяких межах одного з перерахованих параметрів, і це не викличе зменшення або збільшення числа фаз.
Властивості будь-якого сплаву залежать від того, які з'єднання або які фази утворили компоненти сплаву.
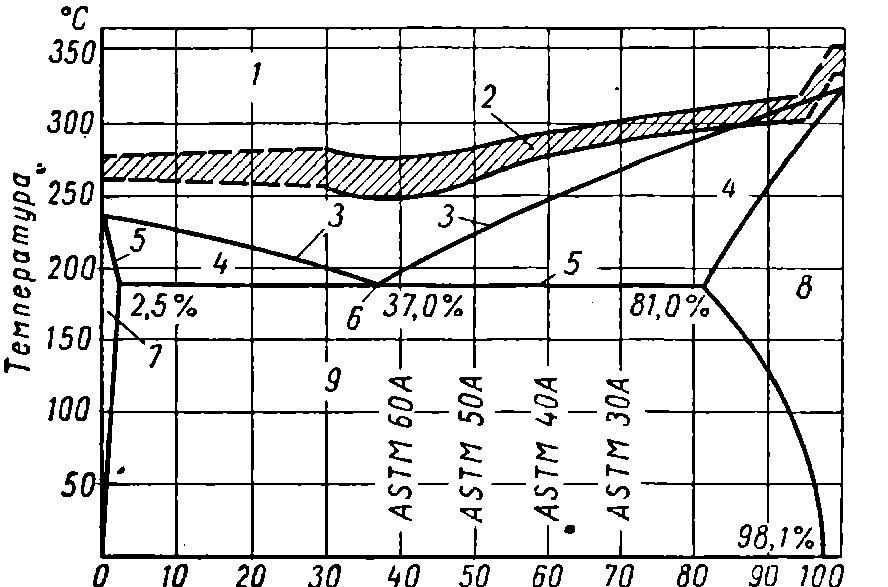
Як приклад по вивченню фазового і структурного стану сплавів розглянемо діаграму системи "олово−свинець"(див. рис. 6).
Сплав системи Sn − Pb відноситься до сплавів типу "механічні суміші".
Діаграмою стану цього сплаву є діаграма з обмеженою розчинністю компонентів в твердому стані.
Згідно цієї діаграми лінія 3 − лінія ліквідус, а лінія 5 − солідус. Крім того, лінія 5 відповідає температурі, при якій в процесі охолодження сплавів в них протікає евтектична реакція з утворенням евтектики при температурі 1830С і змісті ( 37% Pb і 63% Sn.
Особливості кристалізації сплавів Pb − Sn розглянемо для наступних складів:
1. 10% Pb і 90% Sn
2. 37% Pb і 63% Sn
3. 70% Pb і 30% Sn
Криві охолодження цих сплавів представлені на рис. 3, 4, 5.
Кристалізація сплаву починається при температурі T1 (верхня критична температура) і протікає при змінній температурі до T2 (нижня критична температура).
В інтервалі температур T1 - T2 з рідини виділяються кристали надмірного компонента (β).
Якщо з рідини виділяються кристали β, то концентрація Sn в рідкій фазі зменшується, а концентрація Pb в рідкій фазі збільшується. В процесі кристалізації концентрація компонентів в рідкій фазі змінюється і прагне до такої концентрації (37% Pb і 63% Sn), коли обидва компоненти α і β з рідини кристалізуються сумісно. Одночасна кристаллизація α і β протікає при постійній температурі.
У сплаві, що містить 37% Pb і 63% Sn, з рідкої фази проходить одночасна кристалізація обох компонентів (рис. 4). В результаті утворюється однорідна механічна суміш. Структуру, що складається з двох або більше твердих фаз, що одночасно кристалізуються з рідини, називається евтектикою.
У сплаві, що містить 70% Pb і 30% Sn, процес кристалізації починається при температурі T1. В.ПоповичЗ рідкої фази починають кристалізуватися кристали компонента, що знаходиться в надлишку відносно евтектичної концентрації, тобто α (рис.3). Якщо з рідини виділяються кристали α, то в процесі кристалізації рідка фаза збагачується оловом. Коли концентрація компонентів в рідкій фазі досягне евтектичної концентрації (тобто 37% Pb і 63% Sn), то почнеться сумісна кристалізація обох компонентів при постійній температурі T2.
Криві охолодження показують, що сплави системи Pb − Sn в інтервалі концентрацій 2,5 ÷ 81 % свинцю остаточно тверднуть при постійній температурі − T2. Це дає основу вважати, що тверднуча при постоійній температурі - T2 частина рідкого сплаву має постійний склад. Такому складу відповідає сплав, що містить 37% Pb і 63% Sn. Для сплавів типу механічні суміші температура кінця кристалізації не залежить від концентрації сплаву, вона постійна для усіх сплавів. Температура початку кристалізації змінюється залежно від концентрації компонентів в сплаві.
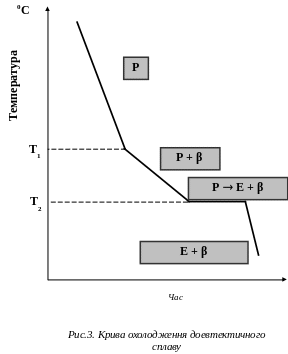
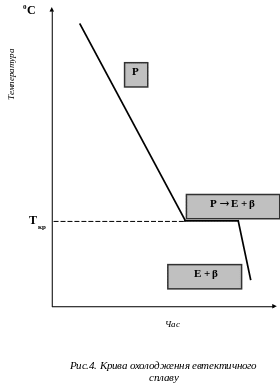
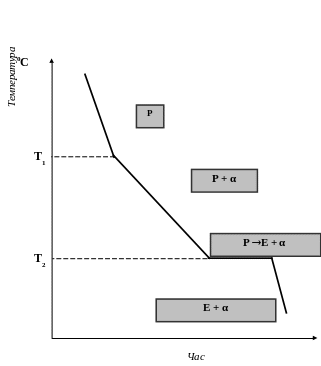
Рис.5. Крива охолодження заевтектичного
сплаву
 Sn %
Pb
Pb
Sn %
Pb
Pb
Рис.6. Інженерний варіант діаграми стану системи Sn - Pb:
1 − рідкий стан; 2 − рекомендована температура припою при змочуванні;
3 − ліквідус; 4 − кашкоподібний стан; 5 − солідус; 6 − евтектика (α + β);
7 − твердий розчин свинцю в олові (β); 8 − твердий розчин олова у свинці (α); 9 − твердий сплав
