
- •Кулонометрия
- •Кулонометрия при постоянном контролируемом потенциале
- •Кулонометрия при постоянной контролируемой силе тока (кулонометрическое титрование)
- •Практическое применение кулонометрии
- •Лабораторная работа 1. Определение галогенидных ионов методом кулонометрического титрования с амперометрической индикацией конечной точки титрования Цель работы
- •Проведение измерений для определения концентрации хлорид-ионов
- •Проведение измерений для определения концентрации тиосульфата
Кулонометрия
Принцип и теоретические основы кулонометрии были известны давно. С середины прошлого столетия кулонометрия широко применяется в аналитической химии и для решения различных физико-химических задач.
В кулонометрических методах определяют количество электричества, которое расходуется при электролизе в ходе электрохимической реакции, и рассчитывают количество анализируемого вещества на сновании закона Фарадея
![]() ,
(1)
,
(1)
где g масса вещества, выделившегося при электролизе; Q количество электричества M молекулярная ил атомная масса продукта электрохимической реакции; n число электронов, участвующих в реакции; F=96485 число Фарадея, равное количеству электричества, которое требуется для выделения молярной массы эквивалента вещества; I сила тока, t время электролиза.
При проведении кулонометрического анализа необходимо соблюдать следующие требования:
электролиз следует вести в таких условиях, чтобы протекала только одна электрохимическая реакция, т. е. выход по току должен быть равен 100%. Для этого нужно знать поляризационные кривые I=f(E) для всех веществ, присутствующих в растворе;
необходимо иметь способ обнаружения конца электрохимической реакции.
Различают два основных вида кулонометрических определений: прямую кулонометрию (кулонометрия при постоянном контролируемом потенциале) и кулонометрическое титрование (кулонометрия при постоянном контролируемом токе). В методах прямой кулонометрии анализируемое вещество непосредственно подвергается электрохимическому превращению в кулонометрической ячейке. В методе кулонометрического титрования определяемое вещество реагирует с титрантом, который получается в кулонометрической ячейке при электролизе специально подобранного раствора.
Кулонометрия при постоянном контролируемом потенциале
В прямой кулонометрии измерения обычно проводят при постоянном контролируемом потенциале, т.е. в потенциостатическом режиме. Принципиальная схема установки для потенциостатической кулонометрии приведена на рис. 1.
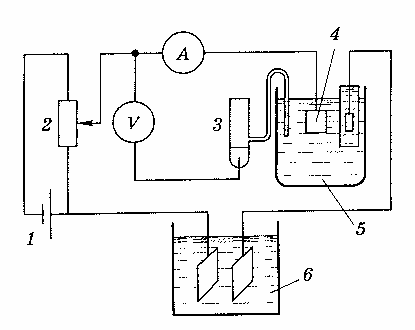
Рис. 1. Схема установки для потенциостатической кулонометрии.
Напряжение с аккумуляторной батареи 1 через делитель напряжения 2 подается на рабочий электрод 4 кулонометрической ячейки. Потенциал электрода определяется милливольтметром или потенциометром, сила тока – амперметром. Количество израсходованного электричества измеряется кулонометром 6. В современных установках в качестве источника стабилизированного напряжения обычно используют специальные электронные приборы – потенциостаты, поддерживающие заданный потенциал с точностью примерно ±10 мВ в интервале от -2,5 до 2,5 В. Потенциал рабочего электрода устанавливают с помощью поляризационной кривой (I–E - кривой) в области, где достигается предельный ток.
Рабочим электродом кулонометрической ячейки обычно служит платиновая пластинка или ртуть, хотя иногда используют также золотые, серебряные или графитовые электроды. Вспомогательный электрод изготовляется из тех же материалов. Электродные пространства рабочего и вспомогательного электродов разделены. Контакт между ними осуществляется через пористую перегородку. В качестве электрода сравнения 3 (рис. 1) обычно выбирают каломельный или хлорсеребряный.
Определение количества электричества, израсходованное на протекание электрохимической реакции, производится путем измерения тока в течение всего процесса электролиза с последующим определением величины, соответствующего площади, ограниченной осями координат it кривой. Эта операция может быть выполнена автоматически с помощью электронных интеграторов тока.
Более точный способ определения количества электричества это включение в цепь последовательно с кулонометрической ячейкой химического
кулонометра, т.е. второй электрохимической ячейки. В кулонометре со 100%-ным выходом протекает хорошо известная электрохимическая реакция. Измерение количества электричества сводится к определению количества вещества, полученного в результате этого процесса, и расчета количества электричества по закону Фарадея. В зависимости от способа измерения количества вещества различают газовые, др. электрогравиметрические, титрационные, колориметрические и кулонометрические кулонометры. В газовых кулонометрах, например водяном, определяется объём газа, выделившегося в результате электрохимического процесса. В электрогравиметрических кулонометрах определяется масса вещества. Например, в медных кулонометрах находят массу металлической меди, выделившейся при электролизе сульфата меди, в серебряных – массу серебра, полученного при электролизе нитрата серебра, и т.д.
Принцип действия кулонометрических кулонометров основан на катодном осаждении меди из концентрированного раствора ее соли на платиновом электроде. После завершения основной реакции осажденный металл растворяют анодно в гальваностатическом режиме. Продолжительность процесса растворения определяют с помощью секундомера или хронометра, а окончание процесса растворения обнаруживают по резкому скачку потенциала анода, измеряемого относительно электрода сравнения. Данный кулонометр позволяет измерять количество электричества в пределах от 0,01 до 100 Кл с достаточной точностью.
Малые количества электричества (0,01 - 1 Кл) можно с хорошей точностью определять с помощью колориметрических кулонометров, принцип работы которых основан на изменении оптической плотности растворов при электролизе. В таких кулонометрах используются электрохимические реакции, сопровождающиеся изменением окраски растворов. Например, разложение или образование перманганата, изменение интенсивности окрашивания комплекса иода с крахмалом, образующегося при окислении иодида, и др. Изменение оптической плотности растворов регистрируется с помощью фотоколориметра или спектрофотометра.
При прямом кулонометрическом определении, например, олова(IV) или железа(III) в ячейке происходит восстановление Sn(IV) до Sn(II) или Fe(III) до Fe(II). По мере уменьшения концентрации восстанавливающегося иона сила тока в цепи падает. Эта зависимость приближенно выражается уравнением:
![]() ,
(2)
,
(2)
где It – сила тока в момент времени t; I0 – начального тока; k – константа, включающая коэффициент диффузии, площадь электрода и другие величины.
Уравнение (2) может быть использовано для определения количества электричества Q, израсходованного на электрохимическое превращение вещества, поскольку
![]() .
(3)
.
(3)
Подставляем уравнение (2) в (3) и интегрируем:
![]() .
(4)
.
(4)
Величина k находится графически. При логарифмировании (2) получаем
![]()
Или
![]() .
(5)
.
(5)
Как видно, в координатах lgIt – t зависимость (5) представляет прямую с угловым коэффициентом -k / 2,303. При экстраполяции эта прямая отсекает на ординате отрезок, равный I0. В практических условиях длительность процесса редко превышает 30 мин. Окончание восстановления обычно фиксируется по прекращению изменения силы тока в течение некоторого времени: сила тока при этом уменьшается почти до нуля. В некоторых случаях, например, при большом остаточном токе применяют химические или физико-химические способы индикации. Массу определяемого вещества рассчитывают по формуле (1).
Поправку на остаточный ток вводят, зная его силу и время электролиза.
