
- •Лекція 1: Предмет та основні поняття аналітичної хімії. Мета: Засвоїти предмет та основні поняття аналітичної хімії.
- •1. Основні поняття аналітичної хімії
- •2. Основні вимоги до аналітичних реакцій
- •3. Контрольні питання
- •1. Основні поняття аналітичної хімії
- •2. Основні вимоги до аналітичних реакцій
- •3. Контрольні питання
- •Лекція 2-3: Теоретичні основи аналітичної хімії. Мета: Засвоїти теоретичні основи аналітичної хімії.
- •1. Іонний добуток води та рН середовища
- •2. Буферні розчини
- •3. Розчинність малорозчинних сполук та добуток розчинності
- •4. Способи вираження концентрацій в аналітичній хімії
- •3. Контрольні питання
- •Лекція 4: Якісний аналіз.Кислотно-основна класифікація катіонів та аніонів Мета: Засвоїти кислотно-основну класифікація катіонів та аніонів
- •Кислотно-основна класифікація катіонів
- •2. Поділ аніонів на аналітичні групи
- •3. Основні визначення
- •Лекція 5: Кількісний аналіз. Гравіметричний метод аналізу. Мета: Засвоїти предмет та основні поняття аналітичної хімії.
- •1. Хімічні методи кількісного аналізу
- •2. Гравіметричний метод аналізу
- •Лекції 6-7: Титриметричний аналіз. Мета: Засвоїти основни титриметрії.
- •Мірні колби, мірні циліндри, піпетки.
- •Блок автоматичного титрування.
- •2. Метод нейтралізації
- •Титрування сильної кислоти лугом (або навпаки).
- •Титрування слабкої кислоти лугом.
- •Титрування слабкої основи сильною кислотою.
- •Титрування слабкої кислоти слабкою основою.
- •3. Метод оксидиметрії
- •4. Інші методи титриметрії
- •5. Контрольні питання
- •Лекція 8: Основні принципи та класифікація фізико-хімічних методів аналізу. Визначення густини. Мета: Засвоїти принципи та класифікацію фізико-хімічних методів аналізу.
- •1. Основні принципи фізико-хімічних методів аналізу
- •2. Класифікація фізико-хімічних методів аналізу.
- •3. Визначення густини.
- •Визначення густини за допомогою ареометра та ареометр з вмонтованим термометром.
- •Визначення температури плавлення та кипіння.
- •Лекція 9: Рефрактометрія, поляриметрія. Мета: Засвоїти основи рефрактометрії та поляриметрії.
- •Поляриметрія.
- •Лекція 10: Атомно-емісійний спектральний аналіз. Мета: Засвоїти принципи атомно-емісійного спектрального аналізу.
- •1. Основні принципи атомно-емісійного спектрального аналізу.
- •2. Принципова схема роботи полуменевого фотометра.
- •Лекція 11: Атомно-абсорбційний аналіз. Мета: Засвоїти принципи атомно-абсорбційного аналізу.
- •1. Основні принципи атомно-абсорбційного спектрального аналізу.
- •2. Принципова схема роботи атомно-абсорбційного спектрофотометра.
- •3. Практичне застосування методу.
- •Лекція 12: Фотометричний аналіз. Метод молекулярної абсорбції. Мета: Засвоїти основи фотометричного аналізу (метод молекулярної абсорбції).
- •Лекція 13: Фотометричний аналіз. Турбидиметрія, нефелометрія; люмінесцентний аналіз (флуориметрія). Мета: Засвоїти основи фотометричного аналізу (турбидиметрії, нефелометрії та флуориметрії).
- •Люмінесцентний аналіз
- •Флуориметри.
- •Явище люмінесценції
- •Лекція 14: Потенціометрія та потенціометричне титрування. Мета: Засвоїти основи потенціометрії.
- •Хлор срібний, скляний електроди та йонселективні електроди.
- •Лекція 15: Кондуктометрія та кондуктометричне титрування. Мета: Засвоїти основи кондуктомтрії.
- •Лекція 16: Електрогравіметрія та кулонометрія. Мета: Засвоїти основи електрогравіметрії та кулонометрії.
- •Лекція 17: Хроматографія та мас хроматографія. Мета: Засвоїти основи хроматографії.
- •Лекція 9: Рефрактометрія, поляриметрія. Мета: Засвоїти основи рефрактометрії та поляриметрії.
- •Поляриметрія.
- •Лекція 10: Атомно-емісійний спектральний аналіз. Мета: Засвоїти принципи атомно-емісійного спектрального аналізу.
- •1. Основні принципи атомно-емісійного спектрального аналізу.
- •2. Принципова схема роботи полуменевого фотометра.
- •Лекція 11: Атомно-абсорбційний аналіз. Мета: Засвоїти принципи атомно-абсорбційного аналізу.
- •1. Основні принципи атомно-абсорбційного спектрального аналізу.
- •2. Принципова схема роботи атомно-абсорбційного спектрофотометра.
- •3. Практичне застосування методу.
- •Лекція 12: Фотометричний аналіз. Метод молекулярної абсорбції. Мета: Засвоїти основи фотометричного аналізу (метод молекулярної абсорбції).
- •Лекція 13: Фотометричний аналіз. Турбидиметрія, нефелометрія; люмінесцентний аналіз (флуориметрія). Мета: Засвоїти основи фотометричного аналізу (турбидиметрії, нефелометрії та флуориметрії).
- •Люмінесцентний аналіз
- •Флуориметри.
- •Явище люмінесценції
- •Лекція 14: Потенціометрія та потенціометричне титрування. Мета: Засвоїти основи потенціометрії.
- •Хлор срібний, скляний електроди та йонселективні електроди.
- •Лекція 15: Кондуктометрія та кондуктометричне титрування. Мета: Засвоїти основи кондуктомтрії.
- •Лекція 16: Електрогравіметрія та кулонометрія. Мета: Засвоїти основи електрогравіметрії та кулонометрії.
- •Лекція 17: Хроматографія та мас хроматографія. Мета: Засвоїти основи хроматографії.
Титрування сильної кислоти лугом (або навпаки).
Крива титрування сильної кислоти лугом (залежність рН розчину від доданого об’єму титранту) в цьому випадку має вигляд :

Крива титрування лугу розчином сильної кислоти є дзеркальним відображенням наведеної кривої.
Оскільки в цьому випадку стрибок титрування великий (рН змінюється від 3 до 11), можна використовувати будь який індикатор, інтервал переходу якого лежить у цих межах рН. Точка еквівалентності відповідає рН =7.
Титрування слабкої кислоти лугом.
Крива титрування в цьому випадку має вигляд:
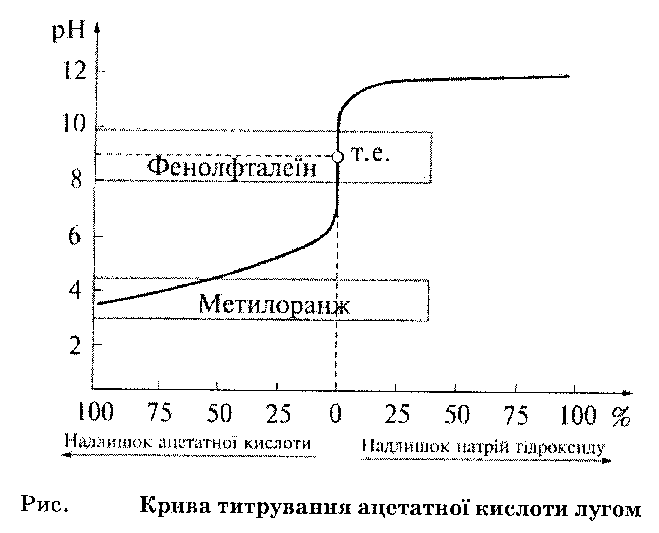
Стрибок титрування значно менший (від рн 7,5 до 10,5). Середина лежить при рН=9. Для визначення кінця точки еквівалентності використовують фенолфталеїн або тимолфталеїн.
Титрування слабкої основи сильною кислотою.
Крива титрування в цьому випадку має вигляд:

Стрибок титрування в межах від рн 6,2 до 3,8). Середина лежить при рН=5. Для визначення кінця точки еквівалентності використовують метиловий оранжевий або метиловий червоний.
Титрування слабкої кислоти слабкою основою.
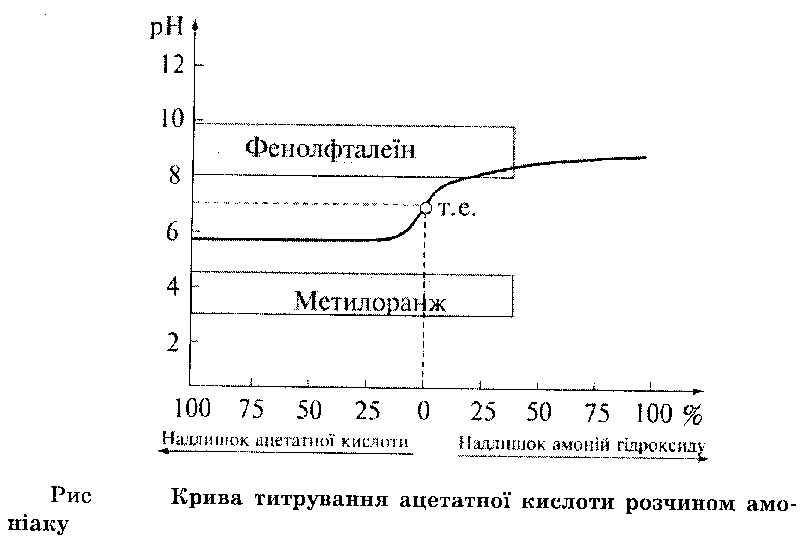
В цьому випадку стрибок титрування малопомітний, різкої зміни забарвлення індикатора не спостерігається, точку еквівалентності виявити складно. Тому таку систему на практиці не використовують.
3. Метод оксидиметрії
Методи обємного аналізу, що ґрунтуються на застосуванні окисно-відновних реакцій, називають оксидиметрією серед них перманганатометрія, йодометрія, броматометрія, нітратометрія.
В перманганатометрії робочий розчин калій перманганат. Титрування ведуть в кислому середовищі з попереднім додаванням у колбу для титрування 10-20 мл. розбавленого розчину сульфатної кислоти. Використовують для визначення відновників. В точці еквівалентності розчин набуває кольору калій перманганату (до точки еквівалентності розчин прозорий), тому індикатор не потрібний.
При розчиненні калій перманганату у воді може змінювати свою концентрацію за рахунок окислення мікрокількостей органічних речовин, що знаходяться у воді, тому робочий розчин калій перманганату готують за декілька днів заздалегідь та остаточно встановлюють титр або нормальність розчину безпосередньо перед аналізом титруючи його розчином оксалатної кислоти точно відомої концентрації. Концентрація розчину калій перманганату може також змінюватись під дією світла або при дуже довгому стоянні розчину.
Враховуючи що у сильнокислому середовищі манган у калій перманганаті змінює свій ступень окислення з плюс 7 на плюс два (приймає 5 електронів) еквівалентна маса розчину калій перманганату буде у 5 разів менше ніж його молярна маса.
В інших випадках точку еквівалентності фіксують по зміні окисно-відновного потенціалу (редокс-потенціалу). Для цього можна використовувати індикатори окисно-відновного титрування. Ці індикатори змінюють свій колір при зміні окисно-відновного потенціалу системи.
Дифеніламін – перехід від безколірного до синього Е0 = 0,76 В. Використовують розчин в концентрованій сульфатній кислоті.
Фенілантранілова кислота. Перехід від безколірного до червоно-фіолетового. Е0 = 1,08 В. Використовують розчин в сульфатній кислоті.
Специфічні індикатори:
Крохмаль – стає синім при наявності вільного йоду. Використовують в йодометрії.
Розчин калій перманганату. В точці еквівалентності розчин більше не знебарвлюється. Використовують в перманганатометрії.
Кожний індикатор має свій інтервал переходу індикатора – це область зміни окисно-відновного потенціалу, в якій індикатор змінює свій колір
Індикатори також характеризуються показником титрування рТ який є серединою інтервалу переходу індикатору.
В оксидиметрії крива титрування виражається в координатах зміни окисно-відновного потенціалу системи від об’єму титранта.
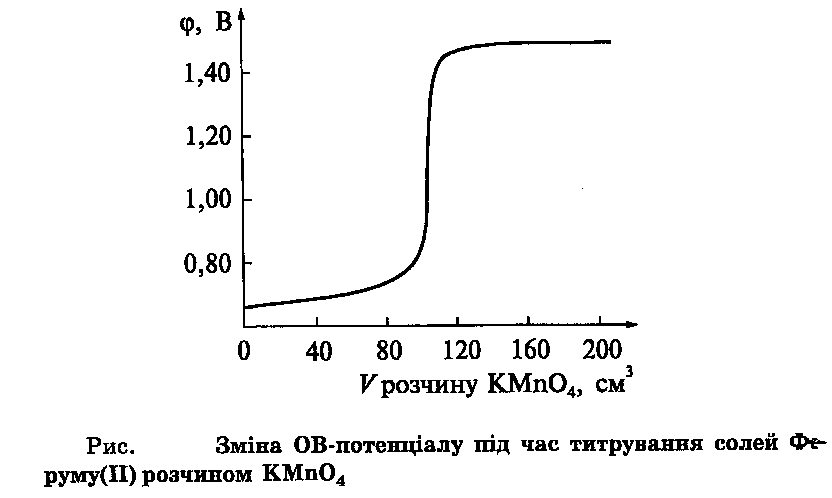
В йодометрії визначення відновників проводять прямим титруванням робочим розчином йоду, або методом зворотнього титрування. Суть зворотнього титрування в тому, що до певного об’єму розчину відновника додають надлишок титрованого розчинц йоду, а потім йод що не прореагував, титрують робочим розчином натрій тіосульфату (відновника).
Кількісне визначення окисників в йодометрії здійснюють так: до підкисленого розчину окисника додають надлишок розчину калій йодиду. В результаті реакції утворюється еквівалентна кількість йоду, який потім відтитровують розчином натрій тіосульфату. За об’ємом розчину натрій тіосульфату що пішов на титрування можна визначити кількість окисника в досліджуваному розчину.
