- •Лекція 1: Предмет та основні поняття аналітичної хімії. Мета: Засвоїти предмет та основні поняття аналітичної хімії.
- •1. Основні поняття аналітичної хімії
- •2. Основні вимоги до аналітичних реакцій
- •3. Контрольні питання
- •1. Основні поняття аналітичної хімії
- •2. Основні вимоги до аналітичних реакцій
- •3. Контрольні питання
- •Лекція 2-3: Теоретичні основи аналітичної хімії. Мета: Засвоїти теоретичні основи аналітичної хімії.
- •1. Іонний добуток води та рН середовища
- •2. Буферні розчини
- •3. Розчинність малорозчинних сполук та добуток розчинності
- •4. Способи вираження концентрацій в аналітичній хімії
- •3. Контрольні питання
- •Лекція 4: Якісний аналіз.Кислотно-основна класифікація катіонів та аніонів Мета: Засвоїти кислотно-основну класифікація катіонів та аніонів
- •Кислотно-основна класифікація катіонів
- •2. Поділ аніонів на аналітичні групи
- •3. Основні визначення
- •Лекція 5: Кількісний аналіз. Гравіметричний метод аналізу. Мета: Засвоїти предмет та основні поняття аналітичної хімії.
- •1. Хімічні методи кількісного аналізу
- •2. Гравіметричний метод аналізу
- •Лекції 6-7: Титриметричний аналіз. Мета: Засвоїти основни титриметрії.
- •Мірні колби, мірні циліндри, піпетки.
- •Блок автоматичного титрування.
- •2. Метод нейтралізації
- •Титрування сильної кислоти лугом (або навпаки).
- •Титрування слабкої кислоти лугом.
- •Титрування слабкої основи сильною кислотою.
- •Титрування слабкої кислоти слабкою основою.
- •3. Метод оксидиметрії
- •4. Інші методи титриметрії
- •5. Контрольні питання
- •Лекція 8: Основні принципи та класифікація фізико-хімічних методів аналізу. Визначення густини. Мета: Засвоїти принципи та класифікацію фізико-хімічних методів аналізу.
- •1. Основні принципи фізико-хімічних методів аналізу
- •2. Класифікація фізико-хімічних методів аналізу.
- •3. Визначення густини.
- •Визначення густини за допомогою ареометра та ареометр з вмонтованим термометром.
- •Визначення температури плавлення та кипіння.
- •Лекція 9: Рефрактометрія, поляриметрія. Мета: Засвоїти основи рефрактометрії та поляриметрії.
- •Поляриметрія.
- •Лекція 10: Атомно-емісійний спектральний аналіз. Мета: Засвоїти принципи атомно-емісійного спектрального аналізу.
- •1. Основні принципи атомно-емісійного спектрального аналізу.
- •2. Принципова схема роботи полуменевого фотометра.
- •Лекція 11: Атомно-абсорбційний аналіз. Мета: Засвоїти принципи атомно-абсорбційного аналізу.
- •1. Основні принципи атомно-абсорбційного спектрального аналізу.
- •2. Принципова схема роботи атомно-абсорбційного спектрофотометра.
- •3. Практичне застосування методу.
- •Лекція 12: Фотометричний аналіз. Метод молекулярної абсорбції. Мета: Засвоїти основи фотометричного аналізу (метод молекулярної абсорбції).
- •Лекція 13: Фотометричний аналіз. Турбидиметрія, нефелометрія; люмінесцентний аналіз (флуориметрія). Мета: Засвоїти основи фотометричного аналізу (турбидиметрії, нефелометрії та флуориметрії).
- •Люмінесцентний аналіз
- •Флуориметри.
- •Явище люмінесценції
- •Лекція 14: Потенціометрія та потенціометричне титрування. Мета: Засвоїти основи потенціометрії.
- •Хлор срібний, скляний електроди та йонселективні електроди.
- •Лекція 15: Кондуктометрія та кондуктометричне титрування. Мета: Засвоїти основи кондуктомтрії.
- •Лекція 16: Електрогравіметрія та кулонометрія. Мета: Засвоїти основи електрогравіметрії та кулонометрії.
- •Лекція 17: Хроматографія та мас хроматографія. Мета: Засвоїти основи хроматографії.
- •Лекція 9: Рефрактометрія, поляриметрія. Мета: Засвоїти основи рефрактометрії та поляриметрії.
- •Поляриметрія.
- •Лекція 10: Атомно-емісійний спектральний аналіз. Мета: Засвоїти принципи атомно-емісійного спектрального аналізу.
- •1. Основні принципи атомно-емісійного спектрального аналізу.
- •2. Принципова схема роботи полуменевого фотометра.
- •Лекція 11: Атомно-абсорбційний аналіз. Мета: Засвоїти принципи атомно-абсорбційного аналізу.
- •1. Основні принципи атомно-абсорбційного спектрального аналізу.
- •2. Принципова схема роботи атомно-абсорбційного спектрофотометра.
- •3. Практичне застосування методу.
- •Лекція 12: Фотометричний аналіз. Метод молекулярної абсорбції. Мета: Засвоїти основи фотометричного аналізу (метод молекулярної абсорбції).
- •Лекція 13: Фотометричний аналіз. Турбидиметрія, нефелометрія; люмінесцентний аналіз (флуориметрія). Мета: Засвоїти основи фотометричного аналізу (турбидиметрії, нефелометрії та флуориметрії).
- •Люмінесцентний аналіз
- •Флуориметри.
- •Явище люмінесценції
- •Лекція 14: Потенціометрія та потенціометричне титрування. Мета: Засвоїти основи потенціометрії.
- •Хлор срібний, скляний електроди та йонселективні електроди.
- •Лекція 15: Кондуктометрія та кондуктометричне титрування. Мета: Засвоїти основи кондуктомтрії.
- •Лекція 16: Електрогравіметрія та кулонометрія. Мета: Засвоїти основи електрогравіметрії та кулонометрії.
- •Лекція 17: Хроматографія та мас хроматографія. Мета: Засвоїти основи хроматографії.
Лекції 6-7: Титриметричний аналіз. Мета: Засвоїти основни титриметрії.
План:
1. Основи титриметрії
2. Метод нейтралізації
3. Метод оксидиметрії
4. Інші методи титриметрії
5. Контрольні питання
1. Основи титриметрії
Суть аналізу полягає в тому, що в конічну колбу для титрування наливають за допомогою мірної піпетки певний точно виміряний об’єм розчину, що аналізується. Далі підбирають речовину (її називають робочою або титрантом), яка реагує з тою, яку визначають. Наприклад для визначення кислоти можна використати луг, для визначення окисника – відновник і т.д. Цю речовину використовують у вигляді робочого розчину – розчину з точно відомою концентрацією. Як правило концентрація робочого розчину 0,100 н., але при необхідності може бути іншою. Робочий розчин заливають у бюретку (довгу тонку трубку з поділками для точного визначення об’єму використаного титранту і пристроєм для дозування цього розчину) та поступово додають до речовини яку визначаємо. При цьому фіксують точку еквівалентності, коли прореагує вся речовина яку визначаємо, але ще не буде надлишку титранту.
Для фіксації точки еквівалентності як правило використовують індикатори. Це речовини, які при досягненні точки еквівалентності змінюють свій колір.
Тобто до досягнення точки еквівалентності у надлишку перебуває речовина яку визначаємо. Після досягнення точки еквівалентності у надлишку буде перебувати тирант.
В точці еквівалентності титрант та речовина яку визначаємо знаходяться в еквівалентних кількостях.
При досягненні точки еквівалентності фіксують об’єм титранту та проводять розрахунки згідно закону еквівалентів який можна записати у вигляді:
![]()
або
![]()
При цьому обчислюють концентрацію розчину речовини яку визначаємо або масу визначаємої речовини.
Якщо точку еквівалентності фіксують за допомогою фізичних приладів то розрізняють:
Потенціометричне титрування – точку еквівалентності фіксують по зміні потенціалу
Кондуктометричне титрування – точку еквівалентності фіксують по зміні електропровідності
Фотометричне титрування – точку еквівалентності фіксують по зміні оптичної густини
...
Для автоматизації процесів титрування використовують БАТи – блоки автоматичного титрування.
При застосуванні фізичних приладів точку еквівалентності фіксують за допомогою кривих титрування – графіків залежності зміни параметру системи (рН, окисно-відновного потенціалу, електричного опору, оптичної густини і т.д.) від об’єму титранту.
При цьому в точці еквівалентності змінюється хід кривої. Або є область різкої зміни параметра системи яка називається стрибком титрування. В цьому випадку точка еквівалентності знаходиться посередині стрибка титрування. Для більш точного визначення точки еквівалентності корисно побудувати графік з стрибком титрування в диференціальному вигляді. Точка еквівалентності визначається піком на кривій.

Точка еквівалентності по графікам (інтегральна та диференціальна форми):
Титрування – додавання до певного об’єму досліджуваної речовини розчину реактиву точно відомої концентрації до досягнення точки еквівалентності.
Точка еквівалентності – це стан коли прореагувала вся визначаєма речовина але ще немає надлишку титранта. Розрахунки в титриметричному аналізі проводяться по досягненні точки еквівалентності.
Титрант або робочий розчин – розчин реактиву точної та відомої концентрації, яким титрують розчин, що аналізується. Його заливають в бюретку. Як правило його готують використовуючи фіксанали – ампули з точною наважкою речовини, яка розрахована на приготування 1 літра титранту. Інколи робочий розчин готують по наважці речовини, або встановленням (уточненням) концентрації розчину шляхом титрування.
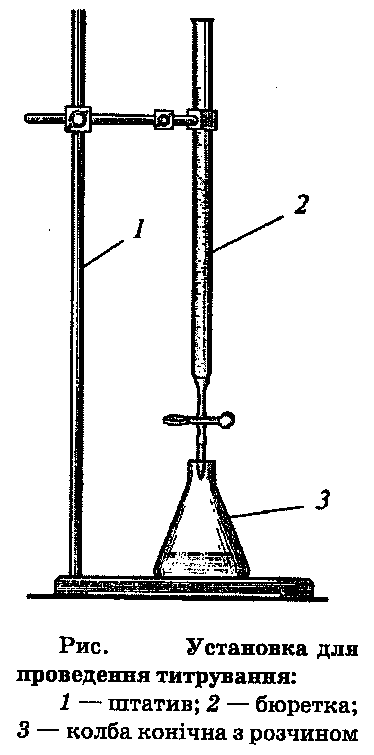
Бюретка – складається з скляної проградуйованої трубки що дозволяє визначати об’єм титранту та пристроєм для дозованої подачіі титранта в аналізуєму пробу (носик).
Фіксанал – ампула з точно відомою наважкою речовини чи об’ємом розчину, яка використовується для для приготування робочих розчинів. Як правило один фіксанал розчиняють в літровій мірній колбі. При цьому утворюється 0,1000 н. робочий розчин.
Мірна колба – проградуйована колба яка використовується для вимірювання об'ємів розчинів в аналітичній хімії з високою точністю. Бувають 1-го, 2-го класів точності. Має тонку довгу шийку з рискою.
Установка для титрування установка що складається з штативу, бюретки, та конічної колби з аналізуємим розчином та магнітної мішалки.
Індикатори – речовини що візуалізують точку еквівалентності змінюючи в точці еквівалентності свій колір.